Химия.Шиманович. Решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентовзаочников инженернотехнических (нехимических) специальностей вузов
 Скачать 10.69 Mb. Скачать 10.69 Mb.
|
|
Пример 3. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления образующих их атомов? Какие гидроксиды называются амфотерными (амфолитами)? Решение. Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э-O и О-Н может протекать по двум направлениям: 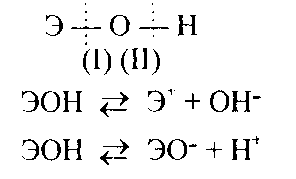 Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами атомов. Диссоциация по кислородному типу (II) протекает, если ЕО-H « ЕЭ-О (высокая степень окисления), а по основному типу, если Ео-н » EЭ-О (низкая степень окисления). Если прочность связей О-Н и Э-О близки или равны, то диссоциация гидроксида может одновременно протекать и по (I), и по (II) направлениям. В этом случае речь идет об амфотерных электролитах (амфолитах): где Э — элемент; n— его положительная степень окисления. В кислой среде амфолит проявляет основной характер, а в щелочной среде — кислотный характер: 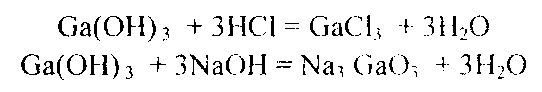 К ОНТРОЛЬНЫ Е ВОПРОСЫ 41. Исходя из положения германия и технеция в периодической системе, составьте формулы мета- и ортогерманиевой кислот, и оксида технеция, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
окисления.
оксидам и изобразите их графически? Химическая связь и строение молекул. Конденсированное состояние вещества Пример 1. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном (*) состояниях? Р 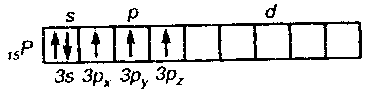 ешение. Распределение электронов внешнего энергетического уровня фосфора ... 3s23p3 (учитывая правило Хунда, 3s23px3py3pz) по квантовым ячейкам имеет вид: ешение. Распределение электронов внешнего энергетического уровня фосфора ... 3s23p3 (учитывая правило Хунда, 3s23px3py3pz) по квантовым ячейкам имеет вид:Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного Зs-электрона в Зd-состояние: Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном — пяти. Пример 2. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа АВn, если связь в них образуется за счет sp-, sp2 sp 3-гибридизации орбиталей атома А? Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только чистых АО, но и смешанных, так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и с одинаковой энергией. Число гибридных орбиталей (q) равно числу исходных. Ответ см. в габл. 4. Таблица 4. Гибридизация орбиталей и пространственная конфигурация молекул 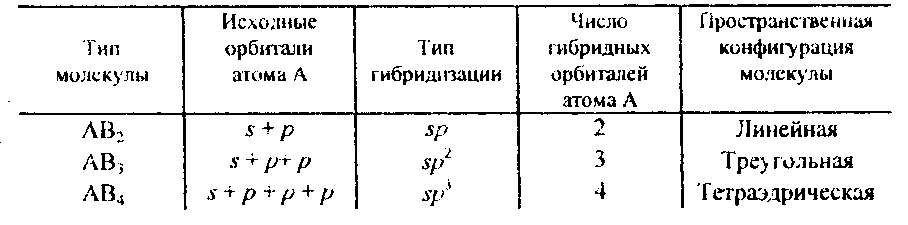 33 2-136 Пример 3. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода? Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы 02; большую прочность связей в молекулярных ионах F2+ и О2+, чем, соответственно, в молекулах F2 и 02; наоборот, меньшую прочность связи в ионе N2+, чем в молекуле N2; существование молекулярного иона Не2+ и неустойчивость молекулы Не2 и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи — метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомной, соответствует более высокая энергия, чем атомной орбитали. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (св) и разрыхляющими (разр). Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности: 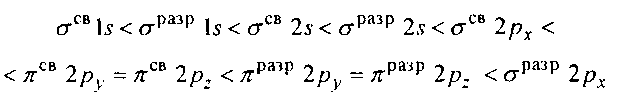 На рис. 2 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных Элементов. 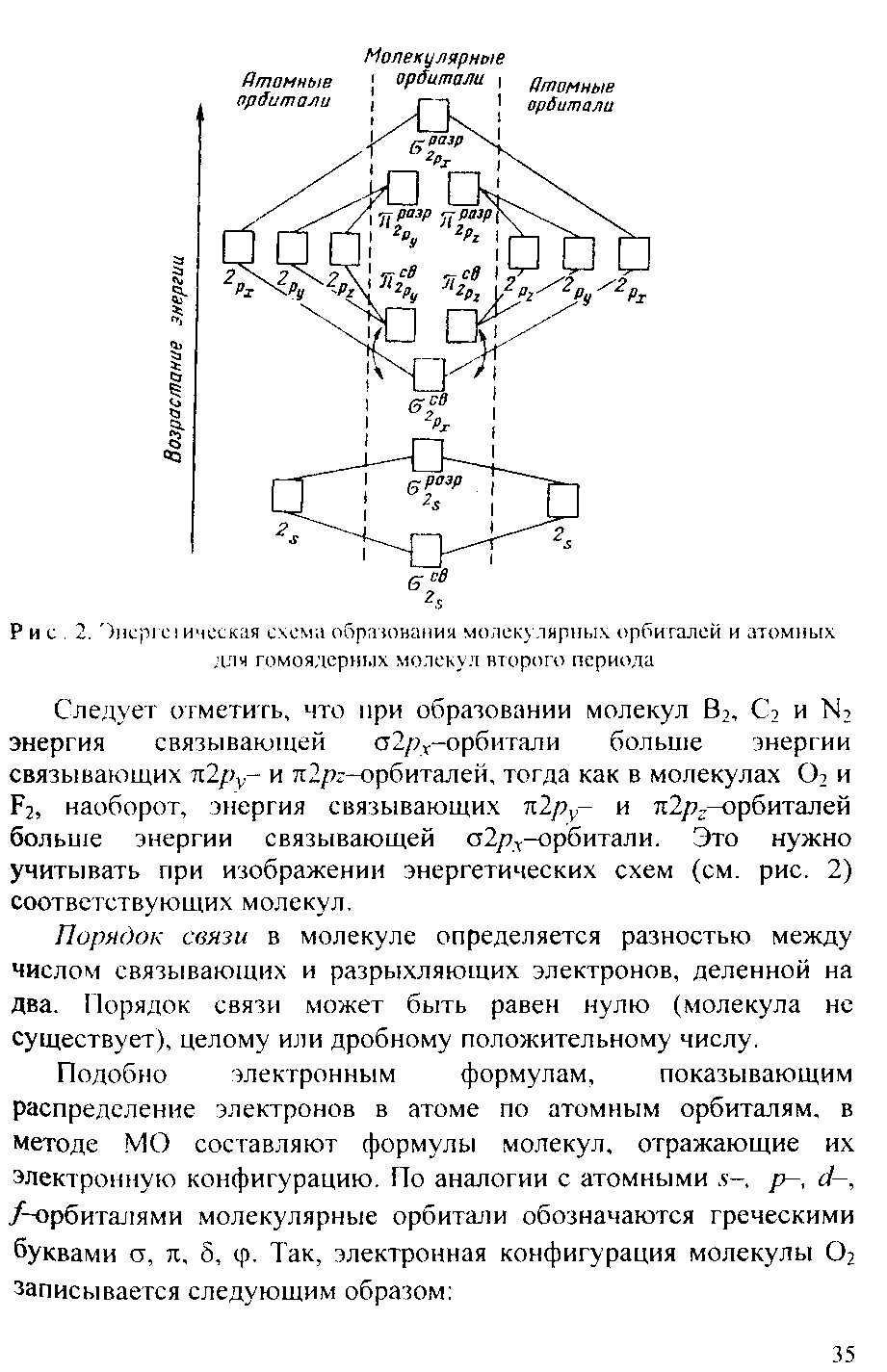 Буквами КК показано, что четыре ls-электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь. КОНТРОЛЬНЫЕ ВОПРОСЫ
Энергетика химических процессов (термохимические расчеты) При решении задач этого раздела см. табл. 5. Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях. При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а те, которые сопровождаются поглощением теплоты, — эндотермическими. Теплота реакции является, таким образом, мерой изменения свойств системы, и знание ее может иметь большое значение при определении условий протекания той или иной реакции. При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы — закона сохранения материи. Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии А17 и на совершение работы А: Q = AU + A. Внутренняя энергия системы U — это общий ее запас, включающий энергию поступательного и вращательного движений молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия — полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение внутренней энергии U веществ неизвестно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, т.е. ее изменение одно-        борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации), к уменьшению Н;с другой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением, а вторая — с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией. Энтропия S, так же как внутренняя энергия Uэнтальпия H, объем V и др., является свойством вещества, пропорциональным его количеству. S, U,Н, V обладают аддитивными свойствами, т.е. при соприкосновении системы суммируются. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п.— ведут к уменьшению энтропии. Энтропия является функцией состояния, т.е. ее изменение (ΔS) зависит только от начального (S1)и конечного (S2) состояний и не зависит от пути процесса: 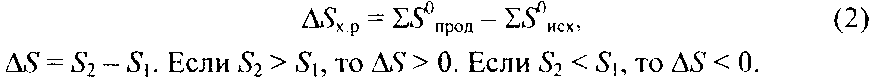 Так как энтропия увеличивается с повышением температуры, то можно считать, что мера беспорядка равна ≈ TΔS. Энтропия выражается в Дж/(моль·К). Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS). При р = const и Т = const общую движущую силу процесса, которую обозначают ΔG, можно найти из соотношения Величина Gназывается изобарно-изотермическим потенциалом или энергией Гиббса. Итак, мерой химического сродства является убыль энергии Гиббса (ΔG), которая зависит от природы вещества, его количества и температуры. Энергия Гиббса является функцией состояния, поэтому Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и, в частности, в сторону уменьшения ΔG. Если ΔG < 0, процесс принципиально осуществим; если ΔG > 0 процесс самопроизвольно проходить не может. Чем меньше AG, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором ΔG = 0 и АН = TΔS. Из соотношения ΔG = ΔН - TΔS видно, что самопроизвольно могут протекать и процессы, для которых ΔН>0 (эндотермические). Это возможно, когда ΔS > О, но \ TΔS\ > \ΔН\ и тогда ΔG < 0. С другой стороны, экзотермические реакции (ΔН < 0) самопроизвольно не протекают, если при ΔS < 0 окажется, что ΔG > 0. Пример 1. В каком состоянии энтропия 1 моль вещества больше при одинаковой температуре: в кристаллическом или парообразном? |
