|
|
ФАРМ_ХИМИЯ. кр_фарм_химия. Республики государственная образовательная организация высшего профессионального образования донецкий национальный медицинский университет им. М. Горького
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ ДОНЕЦКОЙ НАРОДНОЙ
РЕСПУБЛИКИ ГОСУДАРСТВЕННАЯ ОБРАЗОВАТЕЛЬНАЯ
ОРГАНИЗАЦИЯ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ДОНЕЦКИЙ НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМ.М.ГОРЬКОГО
Кафедра фармацевтической и медицинской химии
Контрольная работа по фармацевтической химии № 1
Вариант_____________________63________________
Студентки_______3_____ курса__3_ группы__
заочного отделения фармацевтического факультета
Ф.И.О.______Тимофеевой А.М.____________________
1. Определение окраски жидкостей (2 метода). Приготовление исходных растворов (желтый раствор, красный раствор, голубой раствор). Принцип приготовления эталонов цветности. При написании ответа воспользоваться ОФС 42-0050-07 «Степень окраски жидкостей» (ГФ XII, часть 1, стр. 93)
Окраску жидкостей определяют визуально одним из методов, приведенных ниже, путем сравнения с соответствующими эталонами.
Метод 1.Испытания проводят в одинаковых пробирках из бесцветного, прозрачного, нейтрального стекла с внутренним диаметром около 12 мм, используя равные объемы – 2,0 мл испытуемой жидкости и воды, или растворителя, или эталона сравнения, описанного в статье. Сравнивают окраску при рассеянном дневном свете, горизонтально (перпендикулярно оси пробирок) на матово-белом фоне.
Метод 2.Испытания проводят в одинаковых пробирках из бесцветного, прозрачного, нейтрального стекла с внутренним диаметром от 15 до 25 мм, используя равные слои высотой 40 мм испытуемой жидкости и воды, или растворителя, или эталона сравнения, описанного в статье. Сравнивают окраску при рассеянном дневном свете сверху вдоль вертикальной оси пробирок на матово-белом фоне.
Приготовление исходных растворов.
Желтый раствор:46,0 г (точная навеска) железа(III) хлорида
(FeC13 ∙ 6 Н2О; М.м. 270,30) помещают в мерную колбу вместимостью 1000 мл, растворяют в 900 мл смеси, приготовленной из
25 мл концентрированной хлористоводородной кислоты и 975 мл воды, доводят объем раствора этой же смесью до метки и перемешивают. Определяют количественное содержание железа(III) хлорида в 1 мл раствора. Объем раствора железа(III) хлорида разбавляют этой же смесью таким образом, чтобы содержание железа(III) хлорида в 1 мл составляло 45,0 мг. Раствор хранят в защищенном от света месте.
Красный раствор: 60,0 г (точная навеска) растертого кобальта хлорида (СоС12 ∙ 6 Н2О; М.м. 237,93) помещают в мерную колбу вместимостью 100 мл, растворяют в 900 мл смеси, приготовленной из 25 мл концентрированной хлористоводородной кислоты и 975 мл воды, доводят объем раствора этой же смесью до метки и перемешивают. Определяют количественное содержание кобальта хлорида в 1 мл раствора. Объем раствора кобальта хлорида разбавляют этой же смесью таким образом, чтобы содержание кобальта хлорида в 1 мл раствора составляло 59,5 мг.
Голубой раствор: 63,0 г (точная навеска) меди(II) сульфата
(CuSO4 ∙5 Н2О; М.м. 249,68) помещают в мерную колбу вместимсотю 1000 мл, растворяют в 900 мл смеси, приготовленной из 25 мл концентрированной хлористоводородной кислоты и 975 мл воды, доводят объем раствора этой же смесью до метки и перемешивают. Определяют количественное содержание меди(II) сульфата в 1 мл раствора. Объем раствора меди(II) сульфата разбавляют этой же смесью таким образом, чтобы содержание меди(II) сульфата в 1 мл раствора составляло 62,4 мг.
Принципы приготовления эталонов цветности. Эталоны готовят из пяти стандартных растворов путем разбавления их 1 % раствором хлористоводородной кислоты. Отмеривание исходных и стандартных растворов для приготовления шкал производят при помощи калиброванной пипетки или бюретки с точностью до 0,02 мл. Эталоны для определения степени окраски жидкостей по методу I хранят в ампулах из бесцветного прозрачного нейтрального стекла с наружным диаметром 12 мм, в защищенном от света месте в течение 1 года. Эталоны, используемые для определения степени окраски жидкостей по методу II, готовят из соответствующих стандартных растворов непосредственно перед использованием. Количества компонентов для приготовления эталонов цветности приведены в табл. 2-6 ГФ XII, часть 1, ОФС.1.2.1.0006.15 [1].
2. Рассчитайте процентное содержание водорода пероксида (М.м. 34,01) в растворе, если на титрование 10,00 г субстанции перманганатометрическим методом израсходовано 18,40 мл 0,02 М раствора калия перманганата (КП = 1,0018); объем мерной колбы – 100 мл, объем пипетки – 10 мл.
Решение
Метод перманганатометрии. Метод основан на способности перекиси водорода окислятся перманганатом калия в кислой среде
5H2O2 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 5O2 + 8H2O
H2O2 – 2e = H2O + 2H+, f = ½
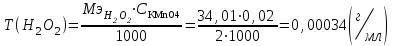 
Процентное содержание водорода пероксида рассчитаем по формуле:
X= 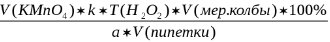
где V(KMnO4) – объем титранта, мл;
k – поправочный коэффициент;
Т(H2O2) – титр пероксида водорода, 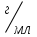 ; ;
V(мер.колбы) – объем мерной колбы, мл;
V(пипетки) –аликвота, взятая для разведения, мл.
а – навеска, взятая для титрования, мл.
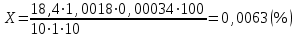
Ответ: 0,063 %.
3. Рассчитать удельное вращение и оценить качество камфоры по данному показателю, если средний угол вращения 10% спиртового раствора равен +8,4о. Длина кюветы 200,01 мм. Удельное вращение должно быть от +41 до +44о.
Решение
Рассчитаем величину удельного вращения по формуле:
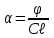 , ,
где φ – измеренный угол вращения, градусы; l – толщина слоя, дм; c – концентрация раствора,%.
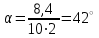
Ответ: 42°. Спиртовой раствор камфоры приготовлен удовлетворительно, так как рассчитанное значение удельного показателя входит в допустимые пределы от +41 до +44о .
4. Определить численное значение предела содержания цинка в кальция хлориде, если известно, что раствор 1 г препарата в 10 мл воды не должен давать реакции на цинк (ГФХ, ФС 119).
Решение
Как видно из методики анализа, контроль предела содержания цинка в препарате осуществляется безэталонным методом, поэтому численное значение предела содержания цинка в препарате следует вычислять по уравнению:
Сн = Сч·V·Р / А,
где Сн – численное значение предела содержания цинка; Сч – чувствительность метода открытия примеси, равная минимальной открываемой концентрации, 0,0001% (таблица); V – объем приготовленного раствора примеси, мл (по условию 10); Р – кратность разведения приготовленного раствора при приготовлении из него испытуемого раствора, равна 1;
После подстановки значений в уравнение имеем:
Сн = 0,0001·10·1 / 1 = 0,001%
Ответ: не более 0,001% цинка в препарате.
5. В чем суть прямого и обратного броматометрического количественного определения? Для определения каких лекарственных препаратов, производных фенолов, включены в НД эти методы?
Метод прямой броматометрии основан на использовании окислительных свойств KBrO3 в кислой среде (HCl):
BrO3– + 6 H+ + 6 ē → Br– + 3 H2O;
В качестве титранта применяют 0,05 н. или 0,1 н растворы KBrO3, которые готовят по точной навеске. Молярная масса эквивалента бромата равна 1/6 молярной массы KBrO3. Растворы KBrO3 не требуют стандартизации, устойчивы при хранении. Титруют восстановители (например, As2O3) в среде HCl при добавлении небольших количеств KBr:
3 As2O3 + 2 KBrO3 + 2 HCl → 3 As2O5 + 2 KCl + 2 HBr
По окончании титрования в растворе появляется избыток KBrO3, который реагирует с бромид-ионами, имеющимися в растворе:
BrO3– + 5 Br– + 6 Н+ → 3 Br2 + 3 H2O
Выделяющийся бром действует на индикаторы – метиловый оранжевый или метиловый красный, изменяя окраску из оранжевой в бесцветную и из красной в бледно-желтую, соответственно. Действие индикаторов необратимо, поэтому титрование проводится медленно. Обязательно проведение холостого опыта.
Метод обратной броматометрии (бромид-броматный метод, бромометрия) основан на использовании реакции бромирования фенола (или его производных) до 2,4,6-трибромфенола свободным бромом, выделяющимся при взаимодействии бромата с бромидом в кислой среде. При этом протекают следующие реакции:
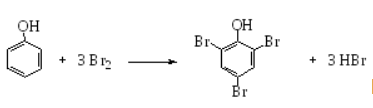
По окончании реакции бромирования фенола ( 10 мин) не вступивший в реакцию бром определяется иодометрически путем прибавления иодида калия и оттитровывания выделившегося йода тиосульфатом натрия:
Br2 + 2 КI → I2 + 2 KBr
I2 + 2Na2S2O3 → 2 NaI + Na2S4O6
В качестве индикатора используют крахмал (добавляют в конце титрования) или проводят безиндикаторное титрование в присутствии хлороформа (титруют до обесвечивания хлороформных шариков).
Броматометрия – один из важнейших методов количественного анализа лекарственных веществ. Прямая броматометрия чаще всего используется для анализа препаратов As(III), например, осарзола, As2O3, а также соединений Sb(III).
Обратное (бромид – броматное титрование) используется при анализе лекарственных веществ – производных фенола: резорцина, п – аминосалициловой кислоты, салициловой кислоты и др. Кроме того, обратное броматометрическое титрование применяют для анализа непредельных соединений (бромирование по двойной связи), какими являются некоторые алкалоиды алифатического ряда [2].
6. Двухосновную адипиновую кислоту НООС - (СН2)4 - СООН в больших количествах используют для получения различных лекарственных препаратов. В пищевой промышленности она может заменять лимонную и винную кислоты. Сейчас адипиновую кислоту получают окислением циклогексана кислородом. Рассчитайте массу адипиновой кислоты, которую можно получить из 336 кг циклогексана, если массовая доля выхода кислоты составляет 75% от теоретически возможного.
Решение
Синтез адипиновой кислоты из циклогексана можно описать уравнением:
С6H12 + [O] → HOOC – (CH2)4 – COOH
Необходимые величины для решения задачи: M(С6Н12) = 84кг/кмоль;
M(адипиновой кислоты) = 146 кг/кмоль.
Рассчитаем количество молей циклогексана:
n(C6H12)= m(C6H12) / M(C6H12)= 336000/84=4(кмоль).
По уравнению реакции 1 моль циклогексана равен 1 молю адипиновой кислоты, следовательно теоретически полученное кол-во молей равно 4 кмоль. Рассчитаем массу теоретическую адипиновой кислоты:
mт(ад.к-ты) = n(ад.к-ты)٠ M(ад.к-ты) = 584(кг).
Учитывая массовую долю выхода рассчитаем практическую массу адипиновой кислоты, полученной в ходе синтеза
m(практ.) = ∙m(теор.)= 0,75∙584= 438 (кг).
Ответ: 438кг.
7. Напишите на латинском языке состав лекарственной формы:
Натрия гидрокарбоната 0,4
Натрия тетрабората 0,2
Воды 20,0
Предложите методики качественного и количественного анализа компонентов лекарственной формы (напишите соответствующие уравнения химических реакций). Рассчитайте молярные массы эквивалентов натрия гидрокарбоната и натрия тетрабората, титры рабочих растворов по определяемым веществам.
Rp.: Natrii hydrocarbonatis 0,4
Natrii tetraboratis 0,2
Aquae purificatae 20,0
Natrii hydrocarbonatis – натрия гидрокарбонат – NaHCO3.
Подлинность: качественные реакции на гидрокарбонаты.
Для отличия от карбонат-иона проводят реакцию взаимодействия с насыщенным раствором сульфата магния. Гидрокарбонаты образуют осадок только при нагревании (после того, как переходят в карбонаты). Испытание основано на образовании магния карбоната основного:
2NaHCO3 + MgSO4 → Mg(HCO3)2 + Na2SO4
При кипячении раствора образуется белый осадок:
t0
4Mg(HCO3)2 → 3MgC03·Mg(OH)2·3H2O↓ + 5CO2↑
Natrii tetraborax ‒ натрия тетраборат ‒ Na2B4O7 ∙ 10H2O. Подлинность: реакции 1, 2 для борной кислоты (после подкисления) + реакции на натрий: окрашивание пламени в желтый цвет и реакция осаждения цинкуранилацетатом в уксусной среде:
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9Н20 → NaZn[(UO2)3(CH3COO)9] • 9H2O↓ + H+
1. Раствор кислоты в спирте с концентрированной серной кислотой горит пламенем, окаймленным в зеленый цвет.
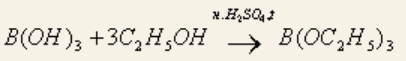
2. На куркумовой бумаге светло-желтого цвета. На бумагу наносят 1 каплю H3BO3, 1 каплю HCl, высушивают, бумага окрашиваются в розовый цвет.
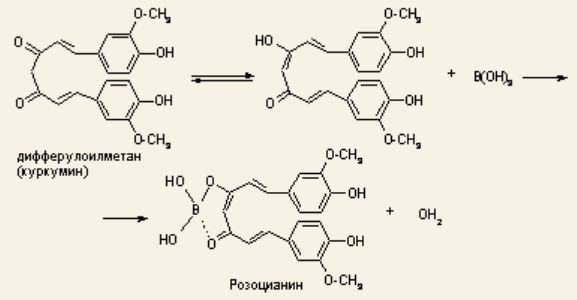
При обработке аммиаком, бумага окрашивается в фиолетовый или зеленовато-черный цвет:
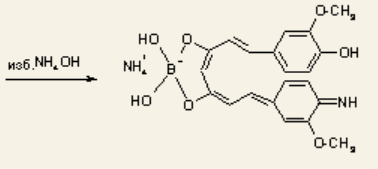
Совместное количественное определение. Титрование 0,1 М раствором соляной кислоты, индикатор ‒ метиловый оранжевый.
Молярная масса эквивалента натрия гидрокарбоната:
Mэ(NaHCO3)= fэ∙ (NaHCO3)= 1∙84,007= 84,007 (г/моль).
Титр HCl по натрия гидрокарбонату T(HCl / NaHCO3) в г/мл можно рассчитать по формуле:
T(HCl/NaHCO3) = С(HCl)∙Mэ(NaHCO3)/1000=0,1∙84,007/1000=0,0084(г/мл).
Молярная масса эквивалента натрия тетрабората:
Mэ(Na2B4O7 ∙ 10H2O)= fэ∙ (Na2B4O7 ∙ 10H2O)= 1/2∙381,37 = 190,685 (г/моль).
Титр HCl по натрия тетраборату T(HCl / Na2B4O7 ∙ 10H2O) в г/мл можно рассчитать по формуле:
T(HCl/ Na2B4O7 ∙ 10H2O) = С(HCl)∙Mэ(Na2B4O7∙10H2O)/1000=0,1∙190,685 /1000=0,01906(г/мл).
8. Общие реакции на подлинность фторид, нитрат, нитрит ионов. Приведите реакции, используемые в фармацевтическом анализе, позволяющие отличить нитраты и нитриты. Химизм, аналитический эффект, условия проведения.
Фторид-ион реакции на подлинность:
- к 2 мл раствора добавляют 0.5 мл раствора кальция хлорида. Образуется белый желатиновый преципитат, который растворяется при добавлении 5 мл раствора железа хлорида:
NaF + CaCI2 CaF2 + 2NaCI
F- + Ca2+ CaF2
- фторид-ионы обнаруживают с помощью 1 % спиртового раствора ализарина, который предварительно смешивают с 2 % раствором нитрата циркония в 5 % хлороводородной кислоте. Растворимые соли циркония образуют с ализарином комплексы красно-фиолетового цвета [3].
Нитраты и нитриты реакции на подлинность (NO3-, NO2-):
- Нитраты и нитриты (общая) образуют синее окрашивание с раствором дифениламина в концентрированной серной кислоте (pеакция окислительния дифениламина до дифенилбензидинвиолета):
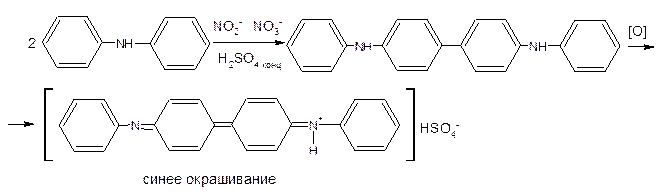
- Нитраты. К лекарственному средству (2–5 мг нитрат-иона) прибавляют по 2–3 капли воды и серной кислоты концентрированной, кусочек металлической меди и нагревают; выделяются пары бурого цвета.
2NaNO3 + H2SO4 → Na2SO4+ 2HNO3
Cu + HNO3 → Cu(NO3)2 + NO2↑ + H2O
- Нитриты. К лекарственному средству (около 30 мг нитрит-иона) прибавляют 1 мл серной кислоты разведенной 16 %; выделяются желто-бурые пары (отличие от нитратов).
NaNO2 + H2SO4 → NaHSO4 + HNO2
2HNO2 → NO↑ + NO2↑ + H2O
- Нитриты. Несколько кристаллов антипирина растворяют в фарфоровой чашке в 2 каплях хлористоводородной кислоты разведенной 8,3 %, прибавляют 2 капли раствора нитрита (около 1 мг нитрит-иона); появляется зеленое окрашивание (отличие от нитратов).
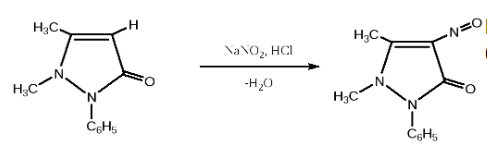 . .
9. Назовите методы количественного определения серебра нитрата и коллоидных препаратов серебра, укажите условия, титранты, способы фиксирования точки эквивалентности (приведите расчеты молярных масс эквивалентов и титров по определяемому веществу для 0,1 моль/л растворов). Напишите соответствующие уравнения химических реакций. Соответствует ли серебра нитрат (ГФ X, ст.75) требованиям ГФ X, если на титрование 0,2976 г препарата израсходовано 17,39 мл 0,1 моль/л раствора роданида аммония (К попр.0,9999).
К коллоидным препаратам серебра относятся: колларгол и протаргол.
Количественное определение – методом тиоцианатометрии (вариант прямого титрования). Предварительно проводят минерализацию колларгола и протаргола в колбе Кельдаля при кипячении в смеси с концентрированными серной и азотной кислотами для переведения связанного серебра в ионное состояние:
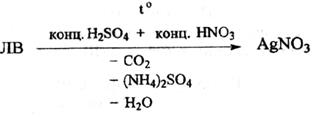 . .
Основан на свойстве серебра нитрата количественно осаждаться аммония тиоцианатом:
AgNO3 + NH4SCN→AgSCN↓ + NH4NO3.
белыйосадок
Индикатор – железоаммонийные квасцы; среда ‒ азотнокислая (для предотвращения гидролиза индикатора); титрант – раствор роданида (тиоцианата) амммония. В точке эквивалентности избыточная капля титранта – аммония тиоцианата взаимодействует с индикатором ‒ железоаммонийными квасцами, окрашивая смесь в розовый цвет:
Fe(NH4)(SO4)2 + 3NH4SCN → Fe(SCN)3 + 2(NH4)2SО4
розовое окрашивание
fэкв(серебра нитрата) =1.
Молярная масса эквивалента натрия гидрокарбоната:
Mэ(AgNO3)= fэ∙ М(AgNO3)= 1∙169,87= 169,87 (г/моль).
Титр роданида аммония по серебра нитрату T(NH4SCN / AgNO3) в г/мл можно рассчитать по формуле:
T(NH4SCN / AgNO3)=С(NH4SCN)∙Mэ(AgNO3)/1000 = 0,1∙169,87/ 1000 =
=0,001699(г/мл).
Для того, чтобы определить соответствует ли серебра нитрат (ГФ X, ст.75) требованиям ГФ X, необходимо рассчитать массовую долю серебра нитрата в препарате (его в препарате в препарате должно быть не менее 99,75%). При прямом титровании для массовой доли вещества (W) в процентах пользуются формулой:
 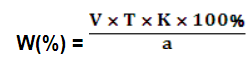 , ,
где V – количество титранта, израсходованного на титрование определяемого веществ, мл;
T – титр титранта по определяемому веществу, г/мл;
K – поправочный коэффициент титранта;
a – навеска вещества в г или объем в мл лекарственной формы.
Подставим значения условий представленных в нашей ситуационной задаче в формулу:
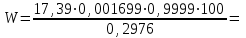 9,92(%). 9,92(%).
Препарат нитрата серебра не соответствует требованиям ГФ X, ст.75.
10. Обоснуйте кислотно-основные свойства калия ацетата. Напишите уравнения реакций, лежащих в основе методов количественного определения. Укажите растворитель, индикатор. Приведите фактор эквивалентности, молярную массу эквивалента, титр, расчетную формулу для определения массовой доли вещества (в %) в препарате.
Обосновать кислотно-основные свойства можно ниже представленными уравнениями химических реакций [4]:
- Кислотные свойства: реакции на анион уксусной кислоты – ацетат СН3СОО–. Реакция образования сложного эфира при взаимодействии препарата с этиловым спиртом и серной кислотой.
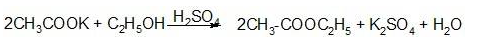
- Водные растворы имеет щелочную реакцию среды, т.к. при гидролизе образуется гидроксид калия:
CH3COOK+ H2O↔CH3COOН + КОН
Количественное определение происходит методом прямой ацидиметрии в среде протогенного растворителя – безводной уксусной кислоты. Титрант – хлорная кислота. Метод основан на нейтрализации ацетата калия как слабого основания и образовании солей с анионом титранта. Титрование прямое, индикатор кристаллический фиолетовый (переход от фиолетового окрашивания до зеленого).
В растворе лекарственного вещества его протонизация:
СНзСООК + СНзСООН → СН3СООКН+ + СНзСОО-
ацетат-ион
Усиление слабых основных свойств ЛВ.
В титранте перенос протона:
НС1O4 + СНзСООН → С1O4- + СН3СООН2+
перхлорат-ион ион ацетония (ацилония)
Усиление кислотных свойств титранта.
Нейтрализация протонированной соли – солеобразование
СНзСООКН+ + С1O4-→ КСlO4 + СНзСООН
Регенерация растворителя
СН3СООН2+ + СНзСОО- → 2 СН3СООН
Суммарно:
СН3СООК + НСlO4 → КСlO4 + СН3СООН
fэкв.=l
Молярная масса эквивалента калия ацетата:
Mэ(CH3COOK)= fэ∙ М(CH3COOK)= 1∙98,15= 98,15 (г/моль).
Титр T(НСlO4/ CH3COOK) в г/мл рассчитывается по формуле:
T(НСlO4/ CH3COOK)=С(HCl)∙Mэ(NaHCO3)/1000.
При прямом титровании для массовой доли вещества (W) в процентах пользуются формулой:
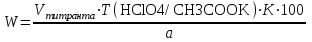 , %. , %.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Государственная фармакопея Российской Федерации / МЗ РФ. – XIII изд. – Т.1,2,3. – Москва, 2007.
2. Харитонов Ю.Я. Аналитическая химия (аналитика). В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – 615 с.
3. Илларионова Е. А. Фармакопейный анализ неорганической лекарственных веществ : учебное пособие / Е. А. Илларионова, И. П. Сыроватский ; ФГБОУ ВО ИГМУ Минздрава России, Кафедра фармацевтической и токсикологической химии. – Иркутск : ИГМУ, 2016. – 132 с.
4. Алексеев, А. Д. Фармацевтическая химия. Органические лекарственные средства. В 2 ч. Ч. 1. Углеводороды и их производные : тексты лекций для студентов специальности 1-48 02 02 «Технология лекарственных препаратов». – Минск : БГТУ, 2018. – 146 с. |
|
|
 Скачать 197.62 Kb.
Скачать 197.62 Kb.
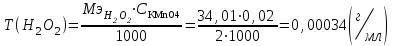

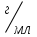 ;
;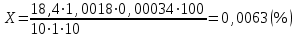
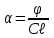 ,
,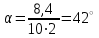

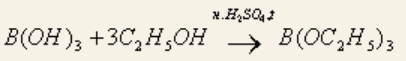


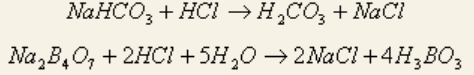

 .
.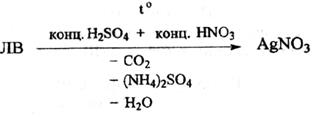 .
.
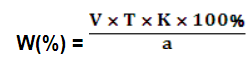 ,
,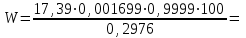 9,92(%).
9,92(%).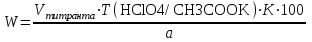 , %.
, %.