Патфиз. Роль нуклеиновых кислот в патологии
 Скачать 88.63 Kb. Скачать 88.63 Kb.
|
|
Федеральное Государственное бюджетное образовательное учреждение высшего образования «Ставропольский государственный медицинский университет» Министерства здравоохранения России (ФГБОУ ВО СтГМУ Минздрава России) Кафедра патологической физиологии Заведующий кафедрой патофизиологии , профессор Е.В. Щетинин Д О К Л А Д Тема: «Роль нуклеиновых кислот в патологии» Выполнила: Студентка 301 группы Щедринова Софья Проверил: ассистент кафедры патофизиологии Гатило Юрий Юрьевич г. Ставрополь, 2021 План: Введение 1.Нахождение нуклеиновых кислот в природе……………………….5 2. Получение нуклеиновых кислот…………………………………….6 3. Роль нуклеиновых кислот в физиологии и патологии иммунитета…….9 4.Распад нуклеотидов в тканях человека……………………………………11 3.1. Причины развития и диагностика гипо- и гиперурикемии 5.Терапевтические нуклеиновые кислоты……………………………….15 5.1. Препараты на основе нуклеиновых кислот 5.2. Генотерапия Заключение………………………………………………………………..20 Список используемой литературы………………………………………….21. Введение: Нуклеиновые кислоты как один из компонентов живой материи были открыты в 1869 году швейцарским ученым Иоганом Мишером. Однако бурное развитие химии и биохимии нуклеиновых кислот началось в конце 40-х - начале 50-х годов ХХ века, когда было установлено, что один из двух главных типов нуклеиновых кислот - дезоксирибонуклеиновая кислота (ДНК) является носителем наследственной информации. На протяжении второй половины XX века нуклеиновые кислоты были важнейшим объектом исследований химии и биологии. Химики создали методы установления детальной химической структуры нуклеиновых кислот, их искусственного синтеза, изучили их поведение при разных химических воздействиях. Биохимики направили свои усилия на выяснение многочисленных аспектов функционирования нуклеиновых кислот в живых организмах или выделенных из них системах. Поскольку было выяснено, что строение молекул нуклеиновых кислот специально приспособлено для выполнения некоторых основополагающих биологических функций, область биохимии, изучающая поведение нуклеиновых кислот в живых и модельных системах, обособилась в автономную область знания, получившую название молекулярная биология. Открытие нуклеиновых кислот как класса органических веществ, связано с именем молодого швейцарского врача Фридриха Мишера, работавшего в Тюбингенской физиолого-химической лаборатории, известной в середине 19 века всему учёному миру. Изучая химический состав лейкоцитов гноя, молодой учёный получил вещество с необычными для известных тогда органических соединений свойствами. Мишер предположил, что это вещество сдержится в ядре клетки. В то время ещё никто в биохимических лабораториях не пытался выделить ядра или какие-либо другие субклеточные компоненты. Поэтому Мишер предпринял более тщательные эксперименты по выделению клеточных ядер. В конечном итоге, исследователь повторно выделил новое вещество. Оно не разлагалось протеолитическими ферментами, то есть не являлось белком. Отсутствие растворимости в горячем спирте указывало на то, что вещество не являлось фосфолипидом. По-видимому, оно относилось к новому классу биохимических соединений. Ввиду ядерного происхождения Мишер предложил для него название «нуклеин» (от лат. nucleus - ядро). В дальнейшем Ф. Мишер использовал другой материал для изучения состава ядер клеток. Он исследовал сперматозоиды - молоки рейнского лосося. Исследования дали новые важные результаты: удалось разделить нуклеин на белок (протамин), необходимый для стабилизации молекулы - полимера и кислый остаток. Свободный от белка остаток нуклеина был назван в 1889 году нуклеиновой кислотой. Нахождение нуклеиновых кислот в природе Нуклеиновые кислоты в природе встречаются во всех живых клетках. Живые клетки, за исключением сперматозоидов, в норме содержат значительно больше рибонуклеиновой, чем дезоксирибонуклеиновой кислоты. На методы выделения дезоксирибонуклеиновых кислот оказало большое влияние то обстоятельство, что, тогда как рибонуклеопротеиды и рибонуклеиновые кислоты растворимы в разбавленном (0,15 М) растворе хлористого натрия, дезоксирибонуклеопротеидные комплексы фактически в нем нерастворимы. Поэтому гомогенизированный орган или организм тщательно промывают разбавленным солевым раствором, из остатка с помощью крепкого солевого раствора экстрагируют дезоксирибонуклеиновую кислоту, которую осаждают затем добавлением этанола. В клетках эукариот (например, животных или растений) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК, так называемый нуклеотид, прикреплена изнутри к клеточной мембране. У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами. Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов. 2..Получение нуклеиновых кислот В клетках нуклеиновые кислоты связаны с белками, образуя нуклеопротеиды. Выделение нуклеиновых кислот сводится к очистке их от белков. Для этого препараты, содержащие нуклеиновые кислоты, обрабатывают ПАВ и экстрагируют белки фенолом. Послед, очистка и фракционирование нуклеиновых кислот проводятся с помощью ультрацентрифугирования, различных видов жидкостной хроматографии и гель - электрофореза. Для получения индивидуальных нуклеиновых кислот обычно используют различные варианты последнего метода. Современные методы химического синтеза нуклеиновых кислот позволяют получать крупные фрагменты ДНК, в том числе целые гены. Они включают: - химический синтез комплементарных, взаимоперекрывающихся олигонуклеотидов, из которых затем в результате комплементационных взаимодействий выстраиваются дуплексы - фрагменты молекулы синтезируемой ДНК с несовпадающими разрывами в обеих цепях; - соединение (лигирование) таких олигонуклеотидов в составе дуплекса с помощью фермента Т4 ДНК-лигазы. Сборку протяженных ДНК из синтетически однотяжевых олигонуклеотидов проводят в несколько этапов. Сначала собирают небольшие дуплексы с "липкими" концами (однотяжевыми комплементарными участками), из которых затем последовательно формируют более протяженные структуры. Таким образом могут быть получены искусственные фрагменты ДНК большой длины и с любой нуклеотидной последовательностью. С помощью генетической инженерии возможно клонирование (получение в индивидуальном виде и размножение) искусственных ДНК. Несмотря на малую эффективность этого метода, были синтезированы олигонуклеотиды, содержащие до 16 звеньев, из которых были собраны первые синтетические гены. Фосфодиэфирный метод образования межнуклеотидных связей, использованный Кораной, имеет историческое значение. Однако разработанные им приемы введения и избирательные удаления защитных групп широко используются в других методах синтеза нуклеиновых кислот. Важным шагом в совершенствовании синтеза олигонуклеотидов явилась разработка так называемого фосфотриэфирного метода . Образующийся динуклеотид после частичного деблокирования фосфата конденсируют аналогичным образом с другими динуклеотидом и т.д. Применение этого способа, в котором используют защиту фосфатной группы, позволило значительно сократить время синтеза и повысить выходы олигонуклеотидов. Параллельно этим методам, которые осуществляют в растворах, разрабатывались твердофазные способы синтеза нуклеиновых кислот. В последнем случае процесс проводят в двухфазной системе; нуклеозидный компонент связан ковалентно с нерастворимым полимером, а нуклеотидный компонент и необходимые реагенты находятся в растворе. Обычно в этом случае на первой стадии нуклеозид присоединяют с помощью "якорной" группы к нерастворимому полимеру. Затем его 5'-гидроксильную группу деблокируют и конденсируют с нуклеотидным компонентом. У образующегося полностью защищенного динуклеозидмонофосфата деблокируют защитную группу в положении 5' и присоединяют следующему нуклеотид и т.д. Наиболее распространенные методы твердофазного синтеза олигонуклеотидов основаны на использовании нуклеотидного компонента, содержащего Р( III ). В так называемом амидофосфитном способе нуклеотидным компонентом является эфир 3'-амидофосфита дезоксинуклеозида. Достаточно устойчивые амидофосфиты при протонировании в присутствии тетразола превращаются в сильные фосфорилирующие агенты. После завершения синтеза удаляют защитные группы с межнуклеотидных фосфатов, отделяют олигонуклеотид от носителя, деблокируют группы NH2 гетероциклов. Липофильную группу (МеО)2Тr удаляют после первого хроматографического разделения. Стандартность операций в твердофазном синтезе олигонуклеотидов явилась основой для автоматизации процесса . Принцип работы автомата-синтезатора основан на подаче в реактор с помощью насоса (под контролем микропроцессора) защищенных нуклеотидных компонентов реагентов и растворителей по заданной программе в колонку, содержащую полимерный носитель с закрепленным на нем первым нуклеозидом. После окончания синтеза и отделения полностью защищенного олигонуклеотида от полимерного носителя проводят деблокирование, очистку и анализ синтезированных фрагментов ДНК. Так, с помощью гидрофосфорильного метода в автомате - синтезаторе за несколько часов получают 30-40-звенные олигонуклеотиды; возможен синтез более чем 100-звенных фрагментов ДНК. Разработаны синтезаторы, позволяющие проводить одновременно синтез несколько олигонуклеотидов. Синтез олигорибонуклеотидов ферментативным путем осуществляют обычно с использованием рибонуклеаз или полинуклеотидфосфорилаз. В качестве нуклеотидного и нуклеозидного компонента применяют мономеры или олигонуклеотиды. Эту реакцию используют для синтеза ди-, три- и тетрарибонуклеотидов. При увеличении длины олигорибонуклеотида начинает преобладать обратная реакция (гидролиз олигонуклеотида). Химический синтез олигорибонуклеотидов проводят в основном с использованием тех же приемов, как и при синтезе ДНК. 3.Роль нуклеиновых кислот в физиологии и патологии иммунитета. Об участии РНК в регуляции функции клеток свидетельствует выраженная динамика ее содержания при различных патологических состояниях. Так, при тиреотоксикозе, первичном ревмокардите, инфильтративном туберкулезе , дизентерии, отравлениях, радиационных поражениях, установлено достоверное накопление нуклеиновых кислот в сыворотке крови. С другой стороны при ревматоидном артрите, механической желтухе, инфекционном гепатите, сахарном диабете, язвенной болезни желудка и кишечника, ревматизме, алкогольной интоксикации, в пожилом возрасте, отмечается снижение этого показателя. При тапеторетинальной дистрофии это состояние получило название – диснуклеотидоз. При воспалительных и язвенных заболеваниях пищеварительного тракта установлена корреляционная зависимость между сниженными показателями иммунитета (количеством лейкоцитов, Т–клеток, концентрацией IgA) и содержанием РНК в сыворотке крови при высоком уровне значимости (Р < 0,05; < 0,02; < 0,01, соответствен- но r–0,531; –898; 0,873). Одновременно установлена обратная корреляция между повышенным количеством нулевых клеток и концентрацией РНК ( r–0,746; –0,792; Р <0,01). Можно предположить, что в основе иммунной недостаточности при язвенных поражениях лежит первичное расстройство обмена нуклеиновых кислот и, прежде всего, РНК. Ликвидация дефицита нуклеиновой кислоты за счет ее экзогенного введения привела к повышению сниженных показателей: лейкоци- тов, Т–клеток, IgA и снижению повышенного числа нулевых лимфоцитов. Выраженным оказался и клинический эффект. Обнаруженная закономерность сохранялась до 12 месяцев На другой клинической модели – шигеллезе – установлена прямая корреляционная связь между концентрацией в крови (РНК+ДНК) сте- пенью морфологического поражения слизистой кишечника и обратная – с иммунологическими параметрами больных. В специальном исследо- вании было установлено разнонаправленное действие отдельных рибонуклеотидов на рецепторы лимфоцитов больных дизентерией людей. Так, 5’–АМФ достоверно подавляло их экспрессию у Т–клеток и Т–хелперов, 5’–ЦМФ и комбинация 5’–АМФ с 5’–ЦМФ – у Т–лимфоцитов, сочетание 5’–АМФ с 5’–УМФ – у В–клеток, 5’–УМФ и 5’– ЦМФ – увеличило число нулевых лимфоцитов. Интересным представляется тот факт, что у здо- ровых людей нуклеиновые препараты индуцировали другие эффекты Формирование иммунных расстройств при бронхолегочной патологии так же тесно связано с обменом нуклеиновых кислот и прежде всего РНК. По данным Сильвестрова В.П., у больных с хронической пневмонией, осложненной бронхиальной астмой, в периоде обострения было снижено содержание кислоторастворимых и кислото- нерастворимых нуклеотидов РНК и уменьшение включения 3Н–тимидина в лимфоциты. Нормализация содержания РНК в плазме оказалась связанной с выраженностью клинической ремиссии. У тех больных, у которых после лечения не восстанавливалось количество рибонуклеотидов, явного выздоровления не было и отмечалась хронизация процессов. При этом между содержанием плаз- менной РНК и нулевых лимфоцитов обнаружена достоверная обратная коррелятивная связь. Поскольку в популяции нулевых клеток содержатся незрелые предшественники Т– и В–лимфоцитов, то вполне логичным является допущение, что РНК может быть одним из факторов, лимитирующих их созревание. В тоже время у здоровых людей с нормальным нуклеиновым обменом и с ненарушенным иммунным статусом достоверные коррелятивные связи между указанными показателями не обнаруживаются 4.Распад нуклеотидов в тканях человека На рисунке 6 изображен метаболический путь деградации пуриновых нуклеозидов с образованием из аденозина последовательно инозина (1), потом гипоксантина (2). Ксантиноксидаза катализирует превращение двух субстратов - гипоксантина и ксантина (3,4) с формированием конечного продукта для организма человека - мочевой кислоты. Данный фермент является флавопротеином, который содержит кофакторы: ионы Mo2+ и Fe2+. Синтетический аналог ксантина - аллопуринол является необратимым конкурентный ингибитором ксантиноксидазы. Аллопуринол является структурным аналогом ксантина, это способствует его присоединению к активному центру фермента, где структура аллопуринола трансформируется в оксипуринол, который полностью блокирует активность активного центра ксантиноксидазы. Таким образом, действие аллопуринола на фермент может быть классифицировано как суицидальное конкурентное ингибирование активности фермента. Кроме того, аллопуринол конкурирует с гипоксантином в реакции, которую катализирует гипоксантин- гуанинфосфорибозилпирофосфаттрансфераза , это способствует снижению концентрации ФРПФ - метаболита синтеза de novo пуриновых нуклеотидов. Деградация гуанозина представлена тремя реакциями: из гуанозина образуется гуанин (5), который включается в гидролитическое дезаминирование с образованием ксантина (6), затем ксантин превращается в мочевую кислоту . Следует отметить, что мочевая кислота может быть в двух таутомерных формах: енольной и кето-формах, первая форма легко образует соли ураты с катионами натрия. Ураты являются солями со специальными свойствами: их растворимость в воде снижается при снижении температуры среды. Это свойство становится причиной накопления уратов в мягких тканях человека в условиях гиперурикемии (повышение уровня мочевой кислоты в плазме крови выше нормы) при переохлаждении организма. 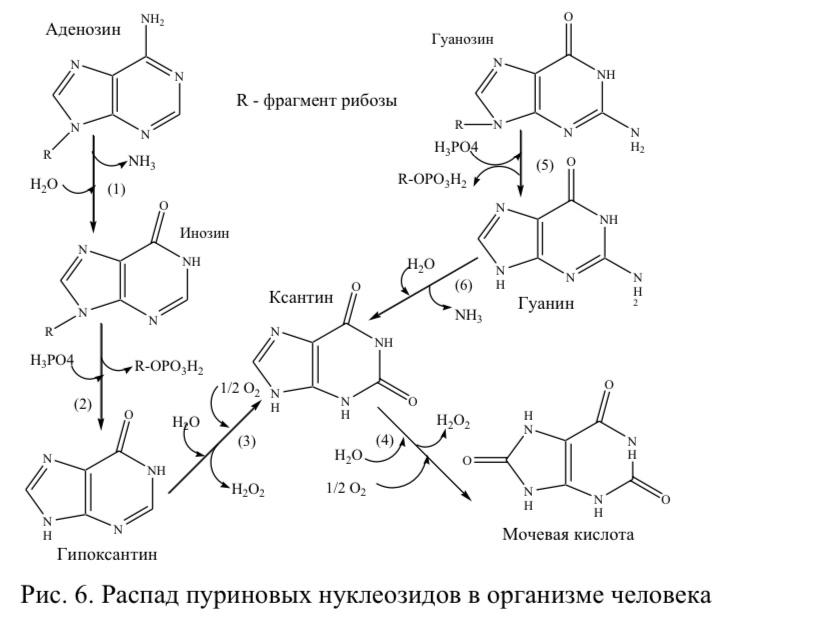 4.1.Причины развития и диагностика гипо- и гиперурикемии Мочевая кислота и ее соли ураты натрия фильтруются в мочу, их нормальное содержание в моче должно быть в пределах 400-600 мг/сутки. Некоторые фармацевтические препараты влияют на реабсорбцию уратов в почечных канальцах, например, высокие дозы аспирина конкурируют с уратами в процессе секреции и реабсорбции уратов. Количество мочевой кислоты в плазме крови зависит от скорости синтеза пуриновых нуклеотидов и скорости их распада, которые, в свою очередь, лимитированы скоростью ключевых ферментативных реакций обоих метаболических путей. Нормальные концентрации мочевой кислоты в плазме крови должны быть в пределах не более 0,42 ммоль∕л (для мужчин) и не более 0,3 ммоль∕л (для женщин). Содержимое мочевой кислоты (уратов) в плазме крови выше этих значений обусловливает развитие гиперурикемии в организме пациентов. При гиперурикемии уровень уратов является критическим для их растворимости в биологических жидкостях организма, что приводит к кристаллизации уратов в мягких тканях и суставах с образованием отложений - их называют тофусами. Формирование тофусов стимулирует развитие воспаления и эрозии суставов, развития подагрического артрита в острой форме, которая затем переходит в хроническую форму. Выше описанные симптомы сопровождают заболевание подагру. Только у 15% пациентов, имеющих гиперурикемию в анамнезе, наблюдается развитие клинических симптомов подагры. Какие факторы необходимо помнить врачу как факторы провокации развития подагры у пациентов с гиперурикемией? - Это, прежде всего, низкая температура окружающей среды, которая может вызывать переохлаждение организма человека и снижение растворимости уратов в плазме крови. Вторым фактором является резкое изменение диеты пациента с гиперурикемией: с высококалорийной (мясной) на вегетарианскую диету. Больным подагрой следует уменьшить в рационе питания количество продуктов богатых пуринами (в основном продукты животного происхождения). В период обострения болезни назначается обильное питье. При устойчивой гиперурикемии в организме возникают условия для образования в почках мочевых камней – уратов. Образование почечных камней на фоне высоких уровней уратов в крови пациентов могут стать причиной смерти пациента по причине развития почечнокаменной болезни и почечной недостаточности. Необходимо помнить, что увеличение концентрации мочевой кислоты в крови может возникать не только при подагре. Гиперурикемия наблюдается также при воспалительных заболеваниях почек, которые сопровождаются нарушением их мочеобразующей функции (при хроническом гломерулонефрите), а также при болезнях, ассоциированных со значительным распадом нуклеиновых кислот в тканях (например, при лейкемии и лучевых поражениях). Гиперурикемия сопровождает ряд генетических заболеваний. Другим наследственным нарушением обмена пуринов является ксантинурия. Эта патология встречается достаточно редко и проявляется тем, что у больных резко возрастает экскреция ксантина с мочой. Увеличение концентрации ксантина в моче у больных ксантинурией приводит к образованию почечных камней. Причина развития ксантинурии до настоящего времени досконально не выяснена. Считается, что возникновение данной болезни связано с изменением активности ксантиноксидазы. Диагностика ксантинурии основана на определении уровня мочевой кислоты и ксантина в сыворотки крови. Уровень мочевой кислоты при данной болезни снижается, что отвечает состоянию гипоурикемии. Лечение ксантинурии сводится к назначению обильного щелочного питья с целью повышения рН мочи и предотвращения формирования почечных камней. 5. Терапевтические нуклеиновые кислоты Одним из наиболее обещающих подходов к созданию эффективных высокоизбирательных средств терапии является конструирование препаратов на основе нуклеиновых кислот, мишенями для которых являются генетические программы инфекционных агентов и клеточные генетические программы, ответственные за развитие заболеваний. К настоящему времени расшифрованы геномы большинства инфекционных агентов, поражающих человека, интенсивно идет поиск мутаций и специфических клеточных генов, ответственных за развитие патологических процессов. Уже идентифицированы или в ближайшее время будут известны конкретные генетические мишени для воздействия с целью лечения различных инфекционных заболеваний и заболеваний, связанных с нарушениями функций генов (генетические заболевания, заболевания, связанные с недостаточной продукцией клетками определенных белков или синтезом неактивных продуктов). Работы по созданию терапевтических нуклеиновых кислот могут успешно развиваться в России. Российские ученые лидировали в развитии этого направления в 80е годы, и в стране сохранились сильные школы и специалисты, в настоящее время успешно работающие в данной области. Важно то, что в России имеются оригинальные технологии и приборы, необходимые для развития данного направления. Фирма Биоссет в Новосибирске производит робототехнику для манипуляций с нуклеиновыми кислотами и оригинальные эффективные синтезаторы олигонуклеотидов, которые экспортируются в развитые страны, в том числе, в США. Фирма Эконова производит надежные микроколоночные хроматографы, необходимые для выделения и анализа нуклеиновых кислот. Можно с уверенностью утверждать, что в ближайшее время на основе нуклеиновых кислот будут созданы эффективные противовирусные и противоопухолевые препараты, иммуномодулирующие препараты и вакцины. Можно ожидать создания средств генотерапии для лечения наследственных заболеваний, таких как иммунодефицитные состояния, эндокринные нарушения. Особо следует отметить возможность быстрой разработки противовирусных препаратов, обеспечиваемую универсальной схемой синтеза нуклеиновых кислот. Создание базы для быстрой разработки и синтеза противовирусных препаратов необходимо для защиты от вновь возникающих опасных вирусов, таких, как высокопатогенные штаммы вируса гриппа. 5.1. Препараты на основе нуклеиновых кислот Нуклеиновые кислоты (НК) выполняют роль хранителей и переносчиков генетической информации и являются неотъемлемой частью многих биологических процессов, начиная с синтеза белков и заканчивая узкоспецифичными регуляторными и каталитическими функциями. Без всякого преувеличения можно сказать, что НК представляют один из основополагающих элементов всех известных науке живых систем. Неудивительно, что интерес к НК за время их исследования приобрел не только фундаментальный, но и прикладной характер, что привело к разработке нового класса потенциальных терапевтических агентов на основе НК. К таким препаратам относятся экспрессирующие векторы, малые шпилечные РНК (shРНК) и короткие интерферирующие РНК (siРНК), антисмысловые, антигенные и иммуностимулирующие олигонуклеотиды, аптамеры, рибозимы и ДНКазимы. Одним из наиболее важных преимуществ использования НК в качестве терапевтических агентов по сравнению с ныне существующими низкомолекулярными лекарственными соединениями является селективность их взаимодействия с молекулярными мишенями, что обеспечивается высокоточными комплементарными взаимодействиями между гетероциклическими основаниями взаимодействующих цепей. Именно такая точность взаимодействия определяет высокую специфичность вызываемых НК биологических эффектов. Универсальная технологическая платформа получения различных НК позволяет легко нарабатывать необходимые количества препаратов на их основе, используя автоматизированный синтез для олигонуклеотидов и генно-инженерные процедуры для плазмидных ДНК (пДНК). Сегодня большинство препаратов на основе НК находятся либо на стадии разработки, либо на ранних стадиях клинических испытаний. Тем не менее, на основании полученных научных и клинических результатов уже можно сказать, что в рамках этого класса биологически активных веществ создаются перспективные кандидаты для лечения широкого спектра заболеваний, включая онкологические и сердечно-сосудистые заболевания, неврологические болезни, такие как болезни Паркинсона и Альцгеймера, тяжелые наследственные нарушения развития (например, некоторые мышечные дистрофии) и вирусные инфекции. Препараты на основе НК достаточно разнообразны: они отличаются по механизму и продолжительности действия, типу используемой молекулы НК и локализации мишени. Общей чертой таких терапевтических агентов является необходимость селективной доставки НК внутрь клеток in vitro или in vivo. Существуют методы, позволяющие добиться проникновения различных молекул НК одновременно во многие ткани организма, либо в определенные типы клеток. В зависимости от размера доставляемой молекулы НК, требуемого количества введений в организм или в культуру клеток и типа клеток предпочтение отдается различным способам доставки НК к внутриклеточным мишеням. 5.2. Генотерапия Это терапевтический метод, основанный на введении в клетки ДНК, содержащей функциональные гены и полученной методами генной инженерии. При генотерапии в клетки с помощью процедур, проводимых in vitro, in vivo или ex vivo, вводится новый генетический материал. В зависимости от мишени могут быть использованы различные стратегии: “выключение” гена-мишени (“knockout”); замена дефектной копии гена на функциональную; “стратегия самоубийства”, приводящая к запуску механизмов апоптоза в трансформированных клетках; иммуномодуляция. Помимо коррекции приобретенных с течением жизни нарушений генная терапия имеет потенциальное применение для лечения наследственных генетических заболеваний. Основной проблемой, сдерживающей развитие генотерапевтических технологий, является очень низкая эффективность включения терапевтических нуклеиновых кислот в дифференцированные клетки организма. При in vivo генотерапии, функции дефектного гена в организме корректируются лишь временно. Задачей является развитие методов, позволяющих долговременную коррекцию функций генов. Ex vivo генотерапия позволяет решить проблему долговременной коррекции функций генов. Этот подход основан на манипуляциях с клетками, временно извлеченными из организма, а также со стволовыми клетками, что позволяет использовать для введения в них нуклеиновых кислот более широкий арсенал методов. Извлеченные из организма клетки (мезенхимальные или гематопоэтические стволовые, предшественники дендритных клеток) выращивают лабораторных условиях. Терапевтические ДНК или РНК вводят в отдельные клетки, и эти трансфицированные клетки вводятся пациенту. Эти клетки и обеспечивают долговременный эффект в организме. Заключение : Таким образом , можно сделать вывод , что всего лишь несколько десятилетий тому назад биологическая роль нуклеиновых кислот была совершенно неясна, в настоящее же время установлено их первостепенное значение в живой природе. Значение нуклеиновых кислот очень велико. Особенности их химического строения обеспечивают возможность переноса в цитоплазму и передачи по наследству дочерним клеткам информации о структуре белковых молекул, которые синтезируются в каждой клетке. Белки обусловливают большинство свойств и признаков клеток. Из этого следует, что стабильность структуры нуклеиновых кислот - важнейшее условие нормальной жизнедеятельности клеток и организма в целом. Любые изменения строения нуклеиновых кислот влекут за собой изменения структуры клеток или активности физиологических процессов в них, влияя, таким образом, на жизнеспособность. Исследование нуклеиновых кислот и нуклеопротеинов позволяет понимать механизмы возникновения инфекционных заболеваний, поскольку по химической природе функциональная часть любого вируса есть не что иное, как нуклеопротеин. Поэтому борьба с многочисленными вирусными заболеваниями невозможна без глубокого познания строения и свойств нуклеиновых кислот. И, наконец, сами мономерные звенья нуклеиновых кислот - нуклеотиды играют важную самостоятельную роль в метаболизме: некоторые из них - коферменты, другие - аккумуляторы энергии в клетке, третьи - циклические нуклеотиды - регуляторы обмена веществ. Список используемой литературы : 1. М. С. Гиляров, А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. «Биологический энциклопедический словарь»; 2.В. Зенгер «Принципы структурной организации нуклеиновых кислот» М., 2015; 3.. Н. С. Курбатова, Е. А. Козлова "Конспект лекций по общей биологии"; 4.. З. А. Шабарова, А. А.Богданов, «Химия нуклеиновых кислот и их компонентов», 2011; 5.. А. П. Горкин «Биология. Современная иллюстрированная энциклопедия», М.: Росмэн, 2018;; 6. Д. Г. Кнорре «Биохимия нуклеиновых кислот», 2016 |
