Санкт-Петербургский государственный педиатрический медицинский университет
Кафедра общей и медицинской химии
|
Специальность
«Педиатрия»
|
Дисциплина «Химия»
|
Семестр 1
|
БИЛЕТ № 7
Вопрос №1 (Тест)
При увеличении давления равновесие в системе 4 Fe(тв) + 3 O2(г) ⇄ 2 Fe2O3(г)
1) не сместится 2) сначала сместится в сторону продуктов обратной реакции, затем – прямой
3) сместится в сторону продуктов прямой реакции 4) сместится в сторону продуктов обратной реакции
Диссоциация внутренней сферы комплексного соединения при снижении концентрации свободных ионов комплексообразователя
1) уменьшается 2) сначала увеличивается, затем уменьшается 3) не изменяется 4) увеличивается
Осмотическое давление крови составляет при 37 °С
1) 500-600 кПа 2) 200-300 кПа 3) 360-400 кПа 4) 750-800 кПа
рН желудочного сока примерно равен
1) 7,36 2) 7 3) 1,5 4) 4,6
К фосфатной буферной системе прибавили щелочь
1) обе концентрации не меняются
2) концентрация H2PO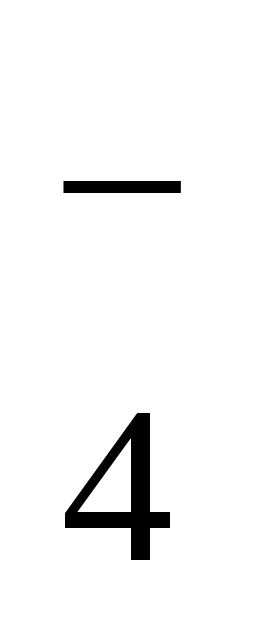 увеличивается, концентрация HPO увеличивается, концентрация HPO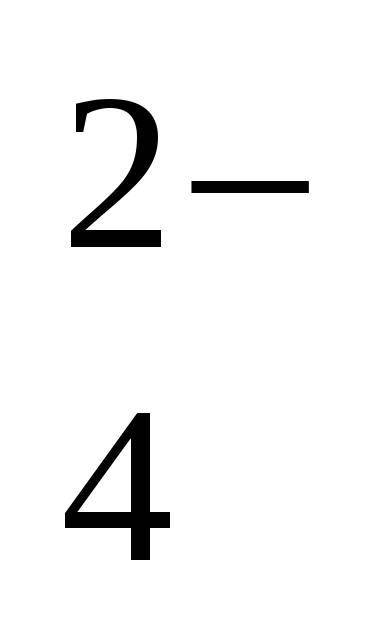 уменьшается уменьшается
3) концентрация компонентов увеличиваются одинаково
4) концентрация H2PO4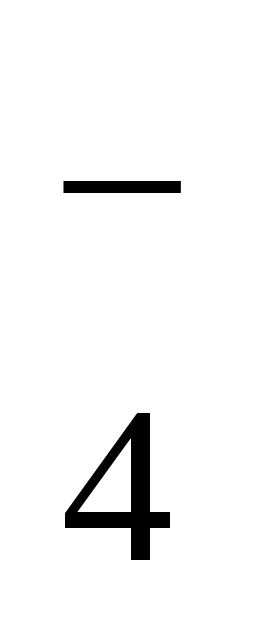 - уменьшается, концентрация HPO - уменьшается, концентрация HPO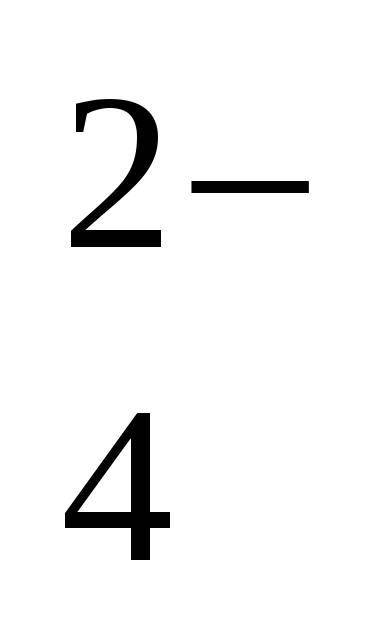 увеличивается увеличивается
Закрытой называют такую систему, которая
1) обменивается с окружающей средой энергией, но не обменивается веществом
2) обменивается с окружающей средой и веществом, и энергией
3) не обменивается с окружающей средой ни веществом, ни энергией
4) не обменивается с окружающей средой энергией, но обменивается веществом
Величина поверхностного натяжения при добавлении ПАВ
1) увеличивается 2) не изменяется 3) уменьшается 4) увеличивается неоднозначно
У эмульсии II типа (обратной) (ДФ – дисперсная фаза, ДС – дисперсионная среда)
1) ДФ и ДС – неполярны 2) ДФ – неполярная, ДС – полярная 3) ДФ и ДС – полярны 4) ДФ – полярная, ДС – неполярная
Ядром мицеллы золя, образующегося по реакции, уравнение которой
AgNO3 + NaCl(изб) → AgCl↓ + NaNO3, является
1) NaNO3 2) AgCl 3) Ag+ 4) Na+
Самопроизвольный процесс получения растворов ВМС характеризуется следующими знаками энтальпии и энтропии
1) ΔS = 0 и ΔH < 0 2) ΔS < 0 и ΔH > 0 3) ΔS > 0 и ΔH > 0 4) ΔS > 0 и ΔH < 0
Вопрос №2
Основные положения протолитической теории кислот и оснований Бренстеда-Лоури. Молекулярные и ионные кислоты и основания, сопряженная протолитическая пара, амфолиты. (рассмотреть на примере конкретных соединений – H3PO4, H2CO3, H2S, H2SO3, CH3COOH)
Вопрос №3
Комплексные соединения. Диссоциация. Константы нестойкости и устойчивости комплексов. Устойчивость и разрушение комплексных соединений в растворах. Рассмотреть на конкретных комплексных соединениях).Токсическое действие солей тяжелых металлов. Антидоты.
Вопрос №4
СaCl2 - кровоостанавливающее, противоаллергическое средство. Приготовили 200 мл 3%-ного
раствора СaCl2 (ρ = 1 г/мл). Найти титр этого раствора и массу хлорид- ионов (мг), содержащихся в нем.
Вопрос №5
L-яблочная кислота в цикле Кребса образуется путём гидратации фумаровой кислоты и далее окисляется в щавелевоуксусную кислоту. Рассчитайте рН и [OH-] 0,25 М раствора яблочной кислоты (рКд1 кислоты = 3,4).
|
«Утверждаю»
Зав. кафедрой, профессор В.В.Хорунжий _______________________
| |
 Скачать 1.64 Mb.
Скачать 1.64 Mb.