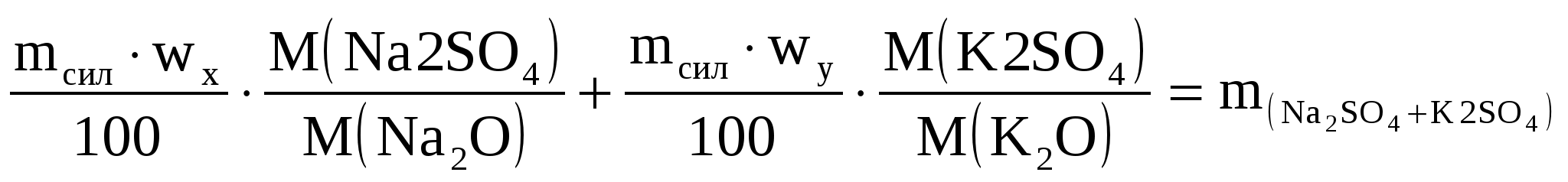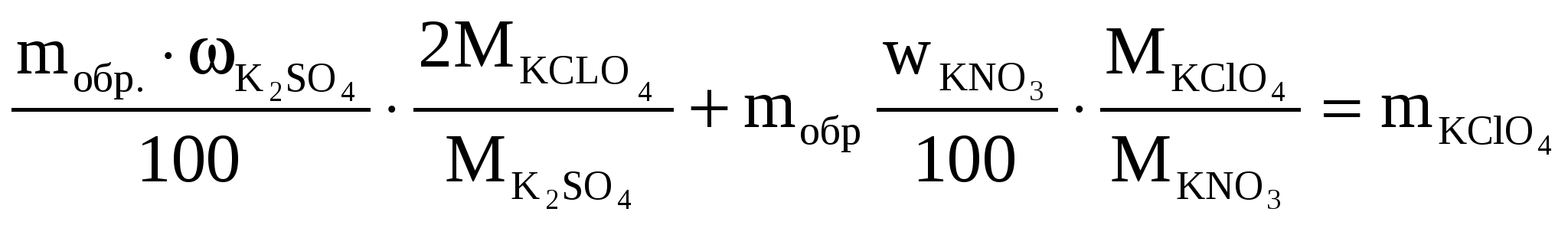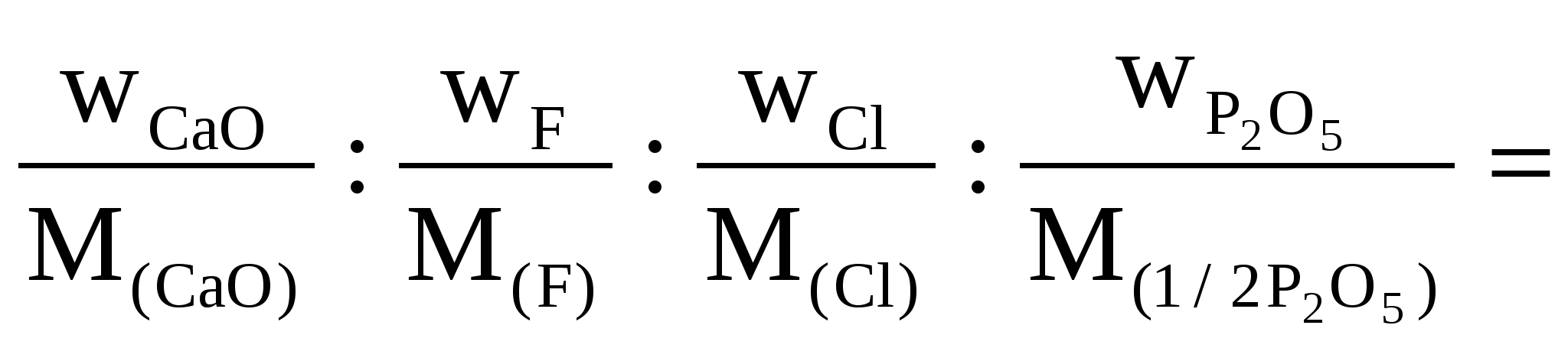2 Расчеты в гравиметрических методах анализа
2.1 Основные расчетные формулы в гравиметрических методах анализа.
Содержание определяемого вещества обычно вычисляют в граммах или процентах. Расчет ведут с помощью аналитического фактора F - отношения молекулярной массы определяемого вещества (МА) к молекулярной массе его гравиметрической (весовой) формы (Мгр.ф.)
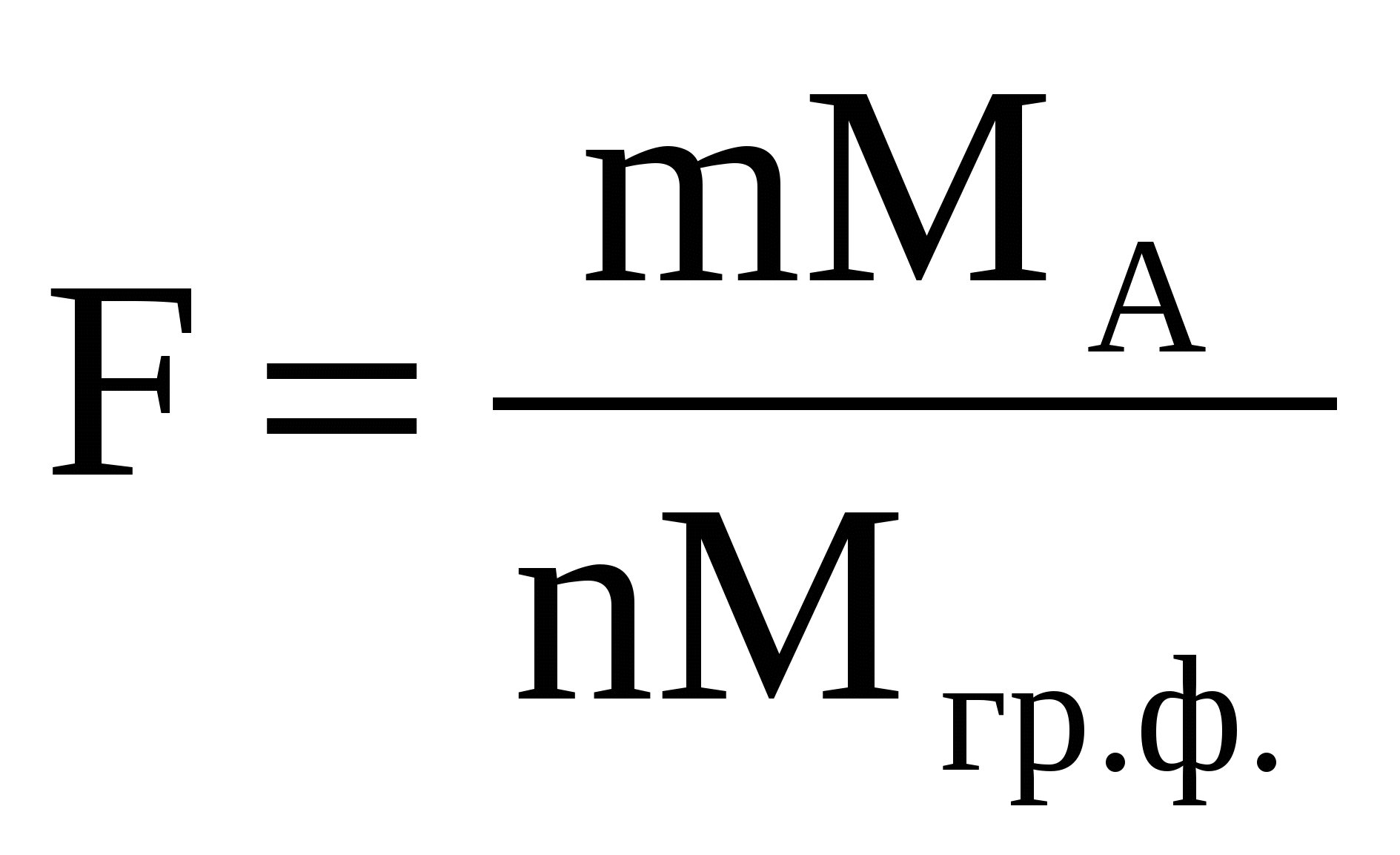 (29) (29)
При вычислении гравиметрического фактора в числителе указывают формулу определяемого вещества, в знаменателе- формулу его весовой(гравиметрической формы), m,n-стехиометрические коэффициенты. Например,
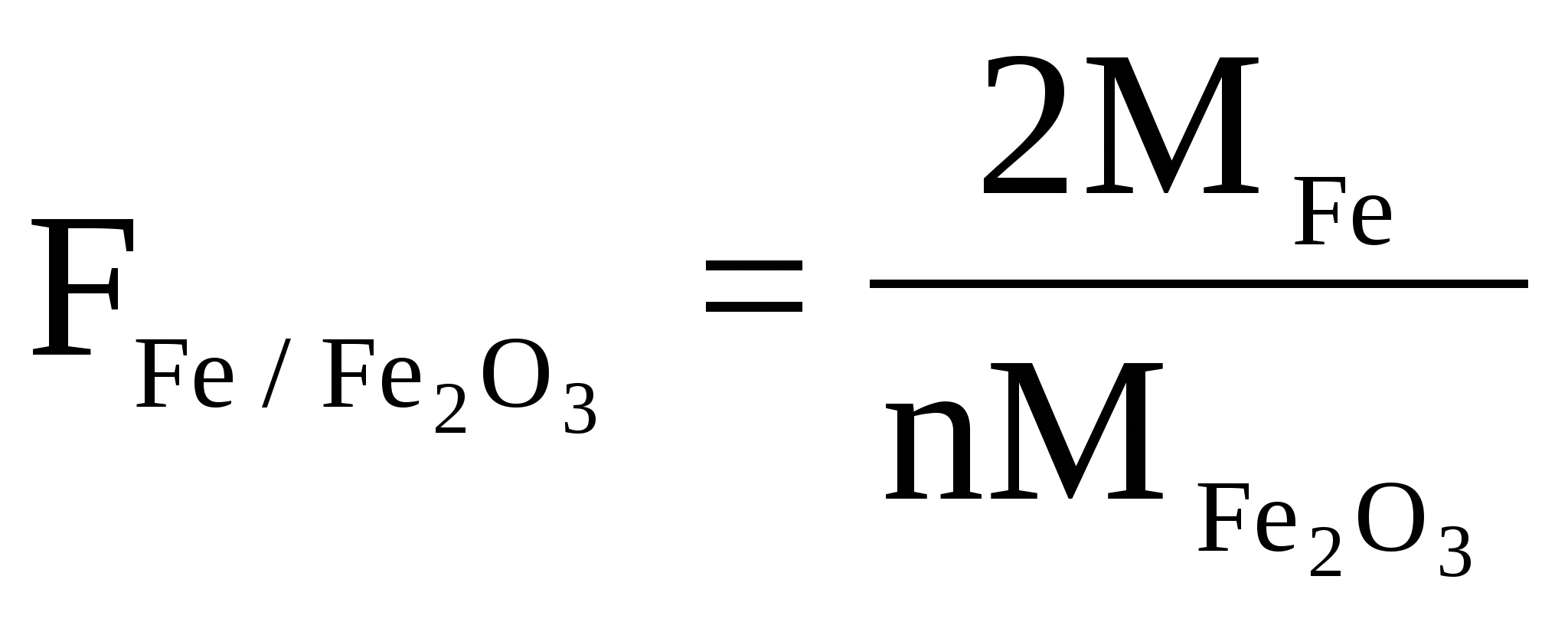
Расчет определяемого вещества в граммах
qA = mгр.ф∙F (30)
Расчет определяемого вещества в процентах
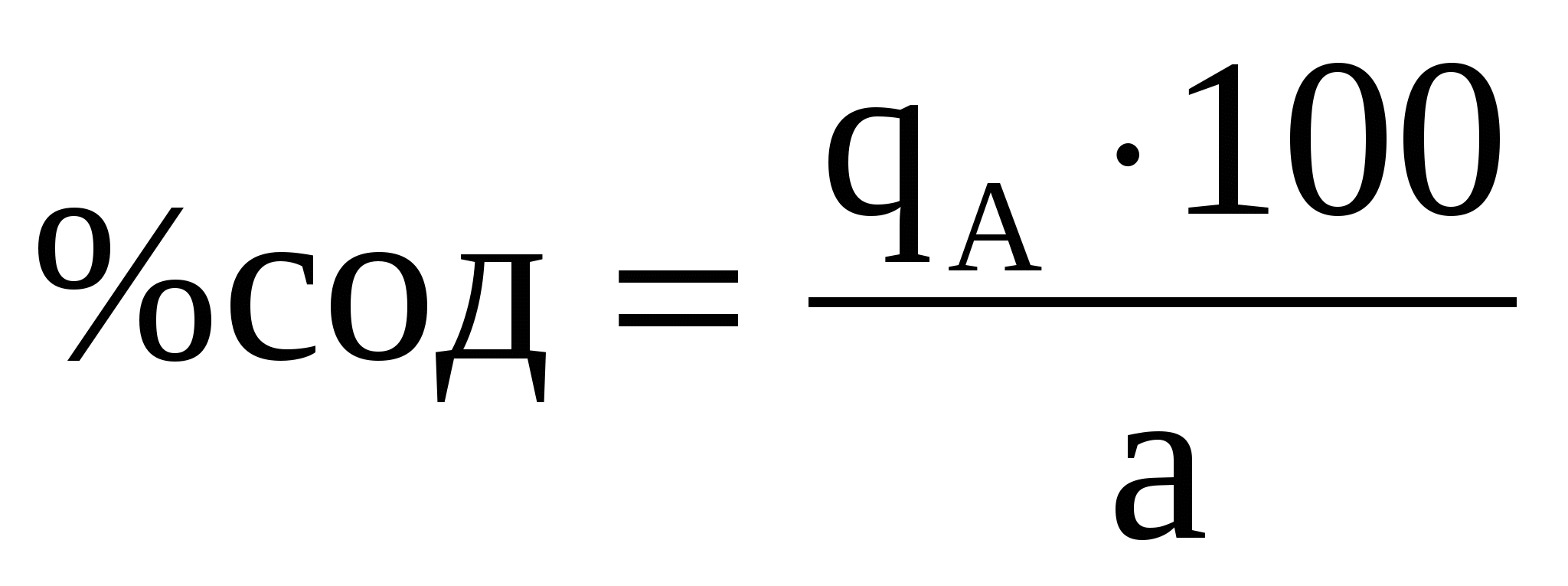 (31) (31)
2.1.1 Расчет навески определяемого вещества
При определении кристаллических осадков
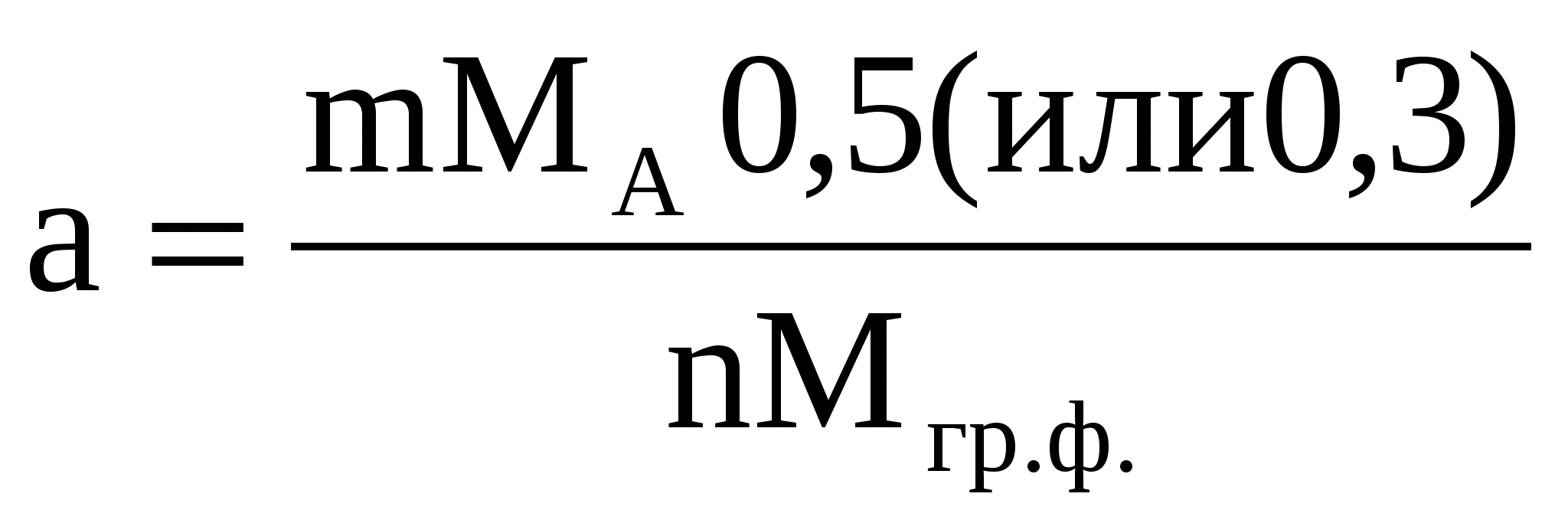 , (32) , (32)
где МА и Мгр.ф. - молекулярные веса определяемого вещества и
гравиметрической формы соответственно;
m,n- стехиометрические коэффициенты.
При определении аморфных осадков
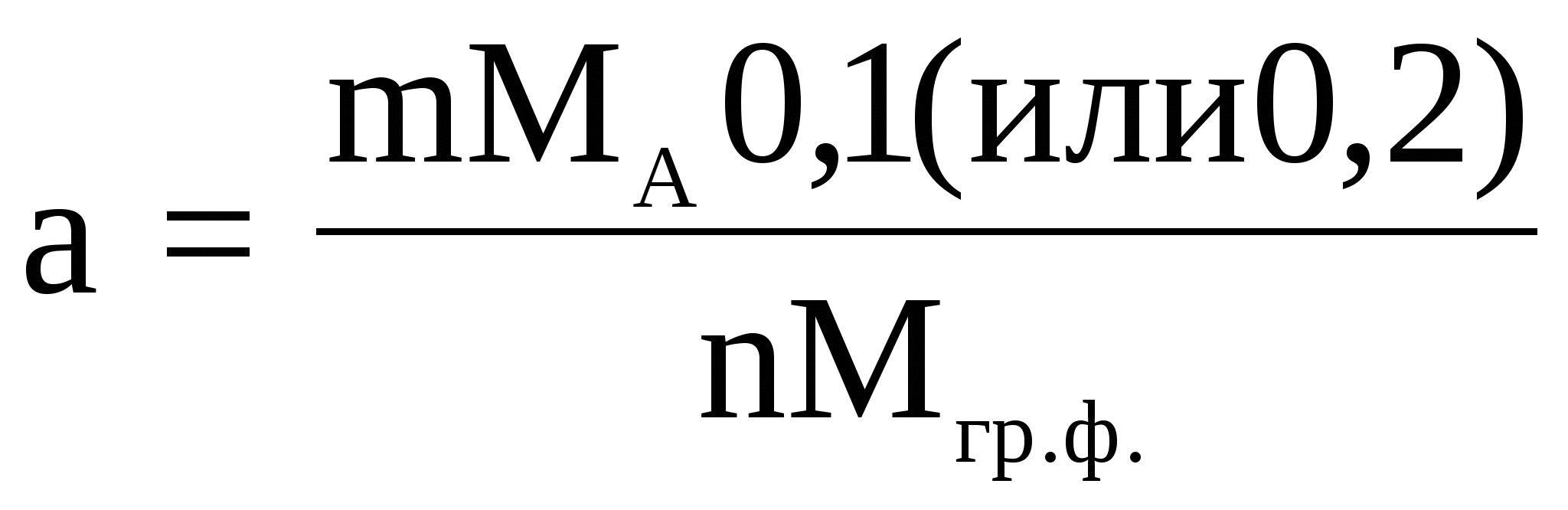 (33) (33)
Опытным путем было найдено, что 0,5 - 0,3 - практически удобная масса весовой формы вещества для кристаллических осадков (г); 0,1-0,2- практически удобная масса весовой формы вещества для аморфных осадков(г).
Объем осадителя находим по формуле
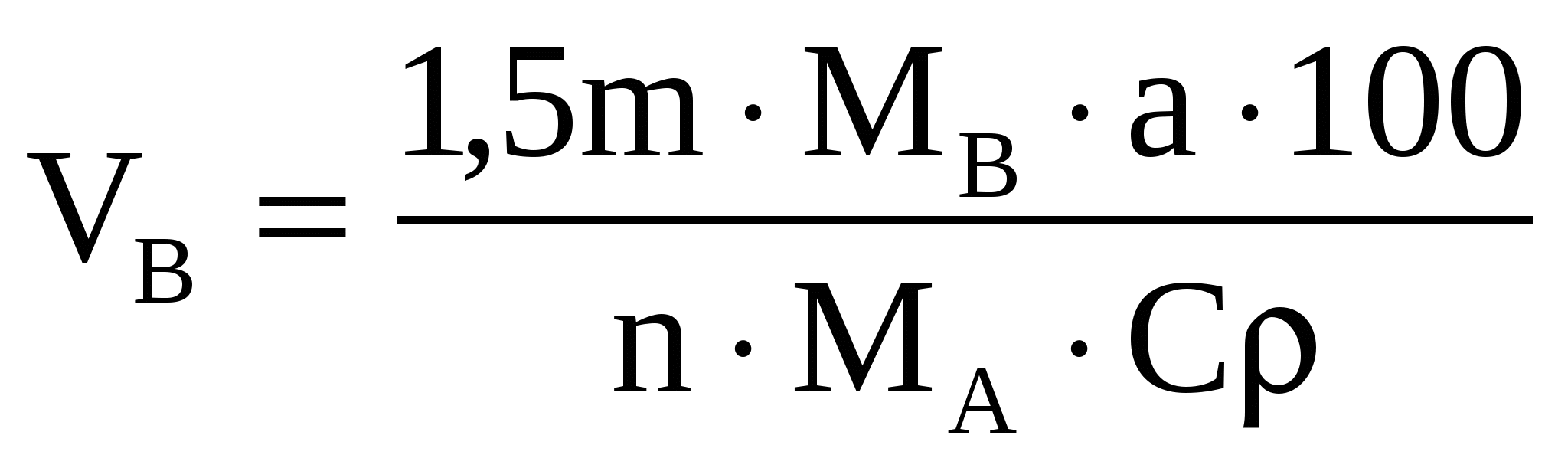 , ,  (34) (34)
где 1,5- const- коэффициент, найденный практическим путем
(берется с учетом того, что осадитель по обыкновению
является летучим веществом);
МВ- молекулярный вес осадителя;
МА- молекулярный вес определяемого вещества;
а- навеска определяемого вещества, г;
С- процентная концентрация;
ρ- плотность г/см3.
Примеры решения задач.
Пример 1
Из навески глины 0,5340 г. после соответствующей обработки получено 0,2345 г CaO. Рассчитать массовую долю CaCO3 в глине.
Решение
Найдем аналитический фактор
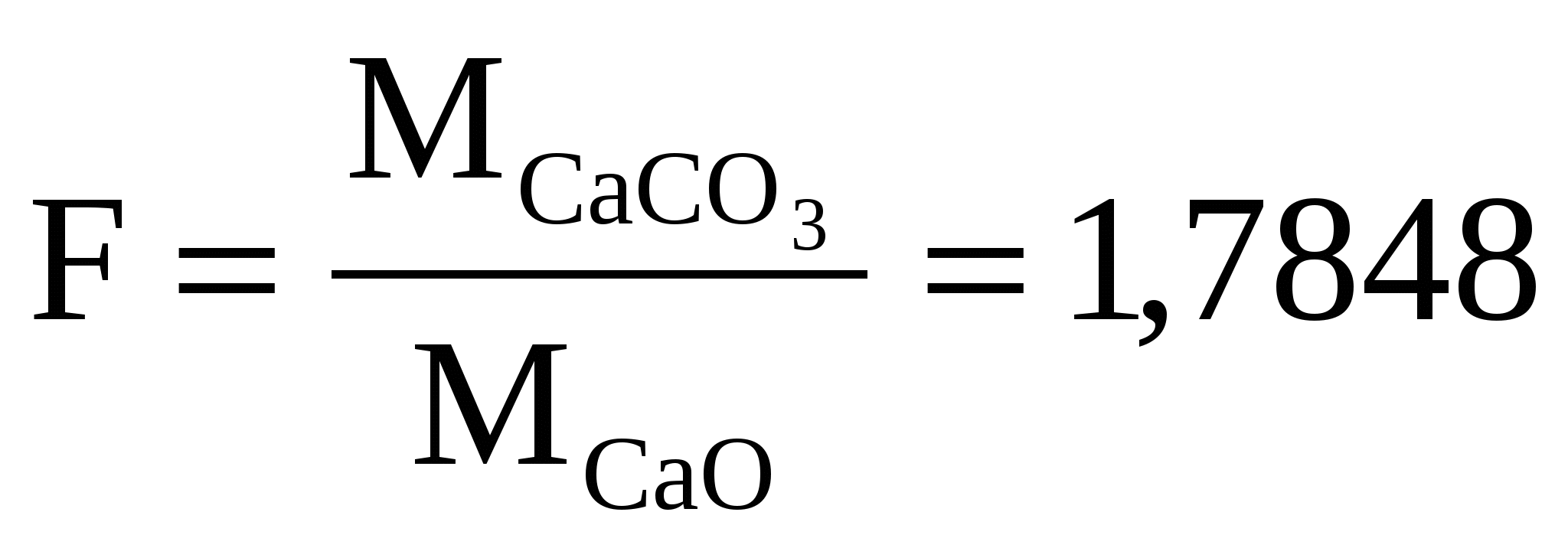
Зная аналитический фактор, можем найти % содержание
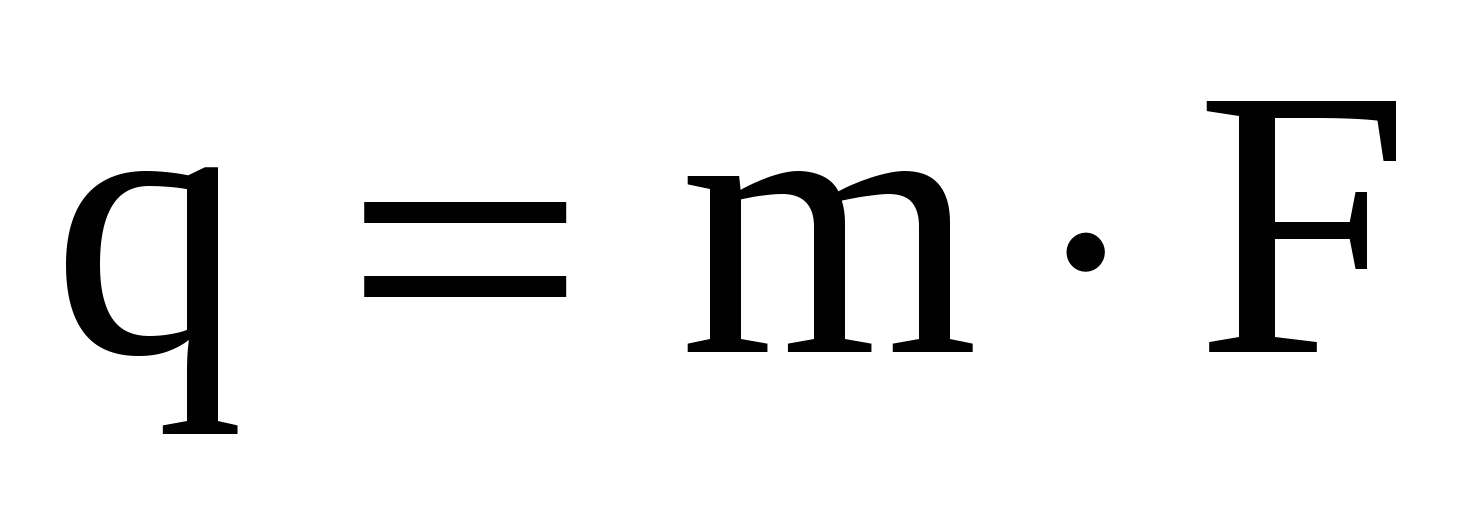
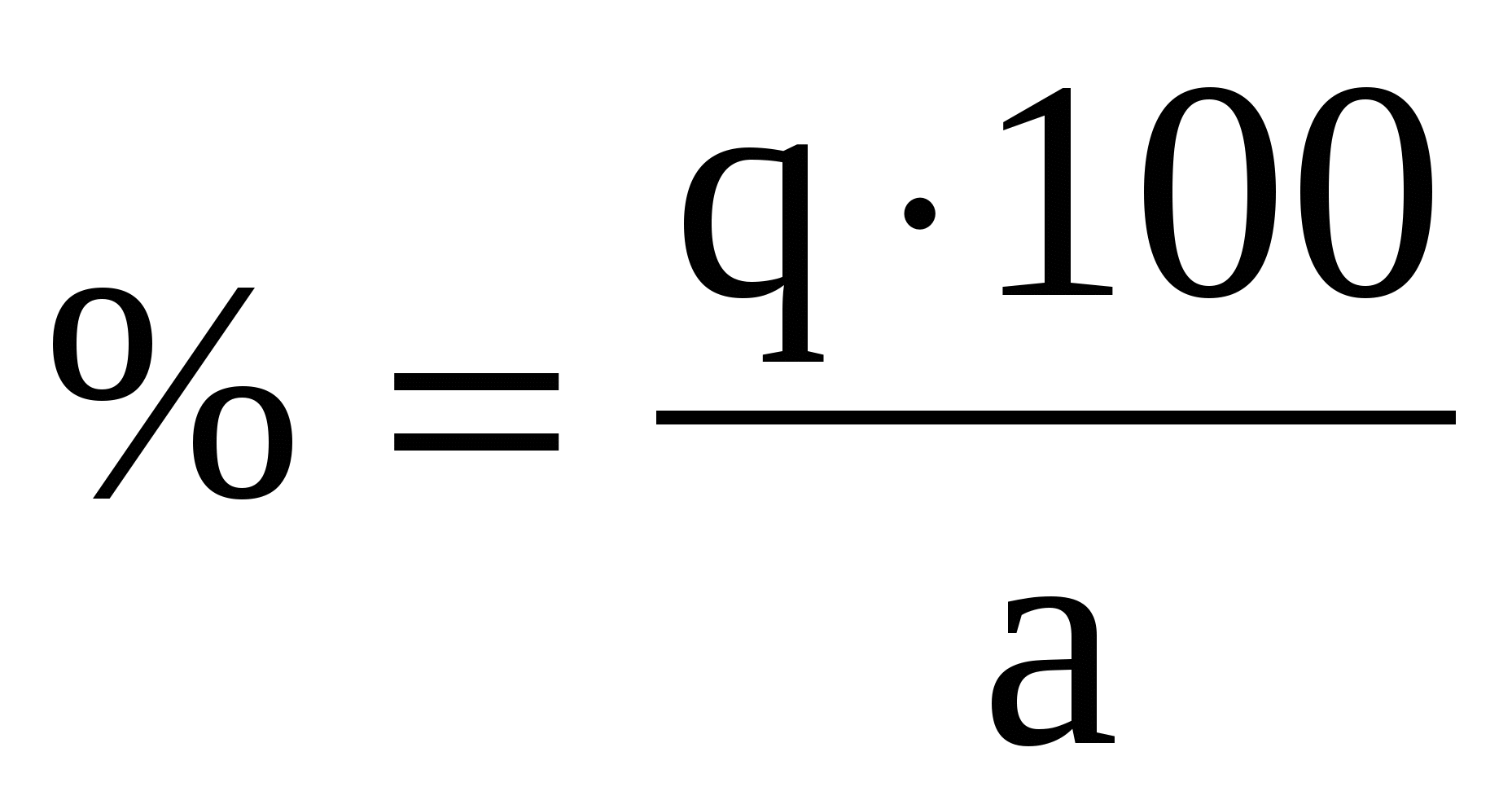
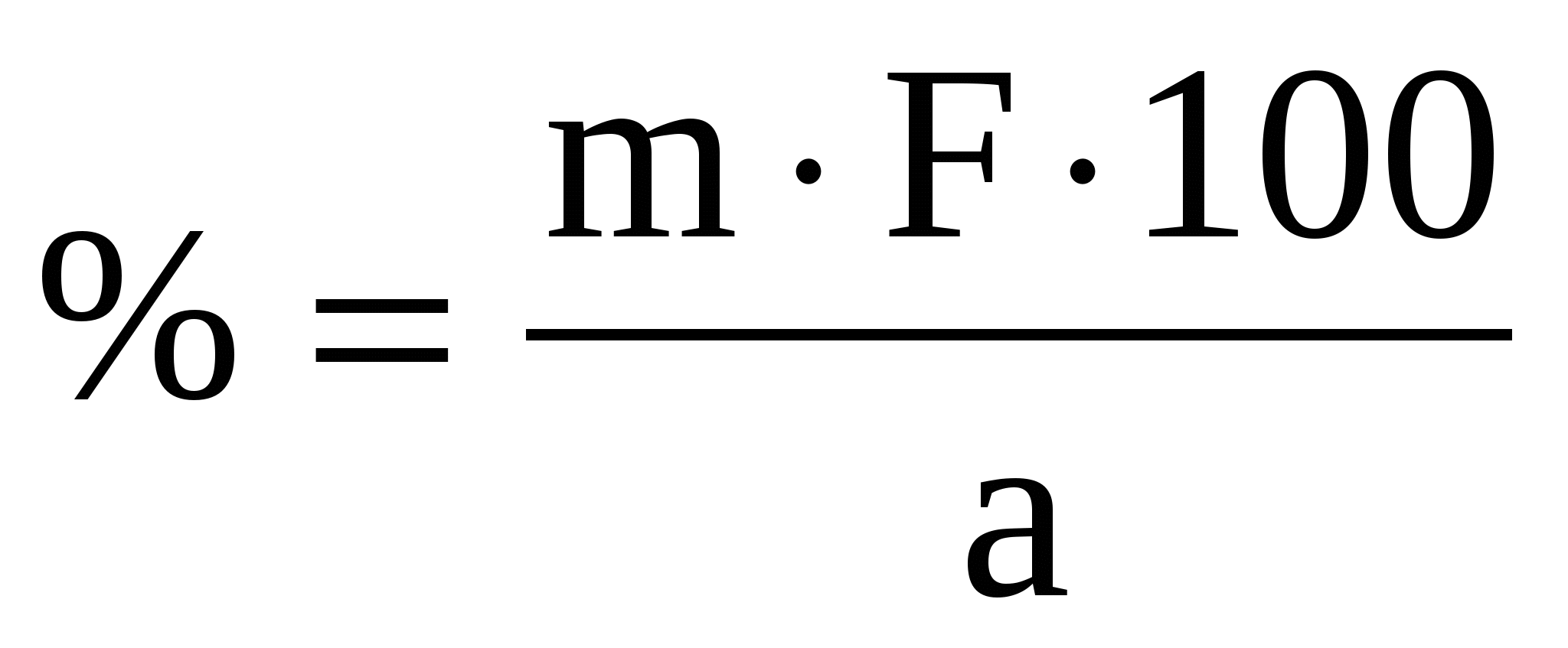
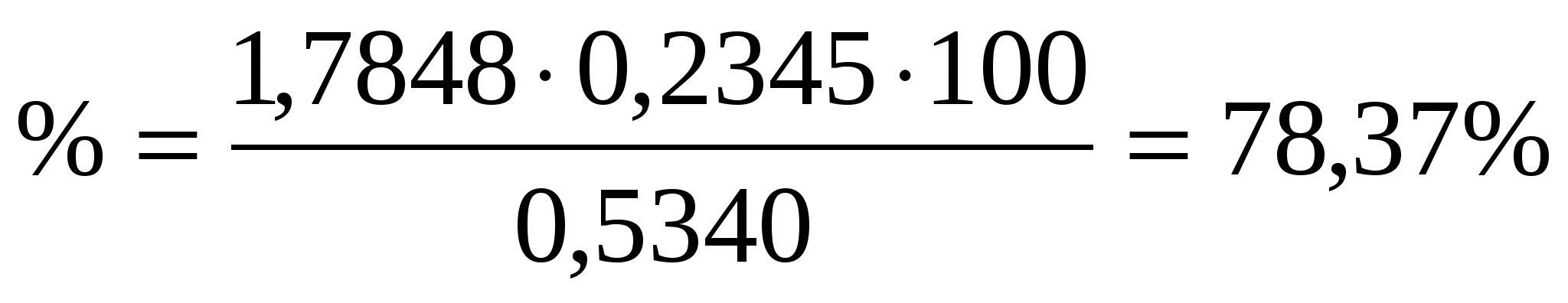
Пример 2
При определении Fe в препарате сульфата железа (III) взвешивали BaSO4 .Написать выражение для гравиметрического фактора.
Решение
Между Fe и BaSO4 существует стехиометрическое соотношение
2M(Fe)  1MFe2(SO4)3 1MFe2(SO4)3  3M(SO42-) 3M(SO42-) 3M(BaSO4) 3M(BaSO4)
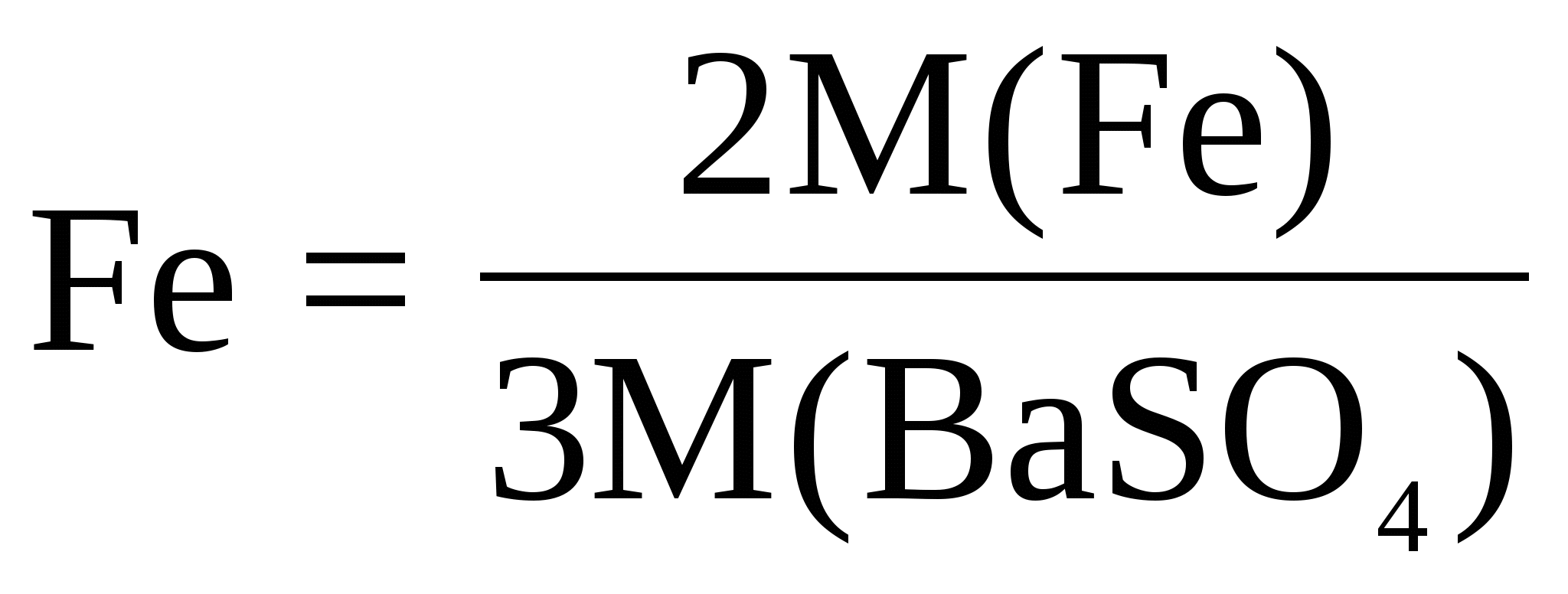
Пример 3
Навеску алюминиевого сплава массой 0,14252 г растворили в колбе вместимостью 200 мл. Из 20,00 мл этого раствора получили осадок оксихинолината алюминия Al(C9H6ON)3,массой 0,2012 г. Вычислить массовую долю (%) алюминия в сплаве.
Решение
Найдем аналитический фактор
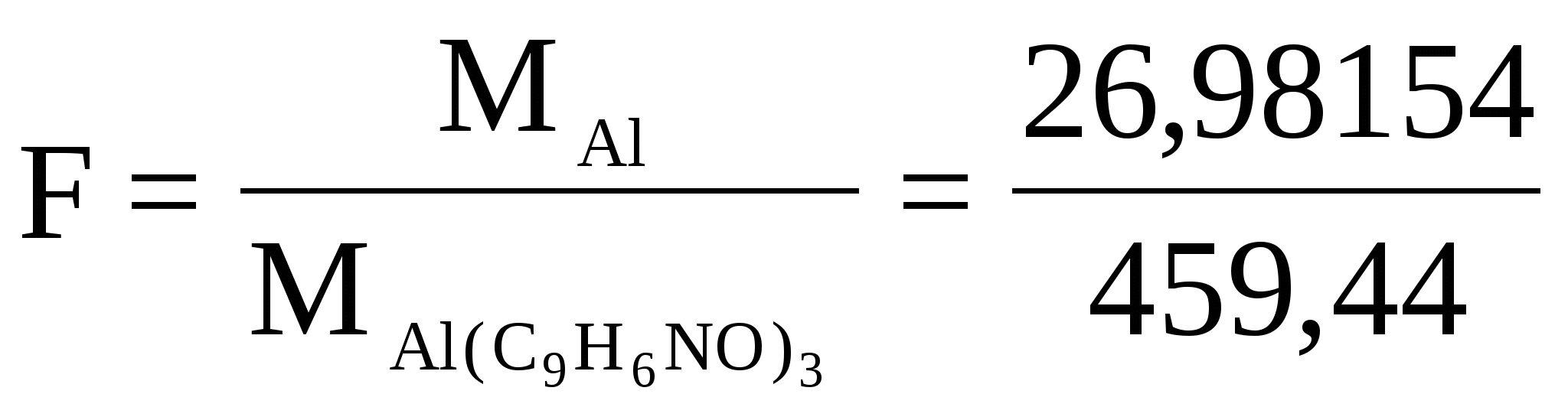
Преобразуя несколько формул, найдем % содержание алюминия в сплаве
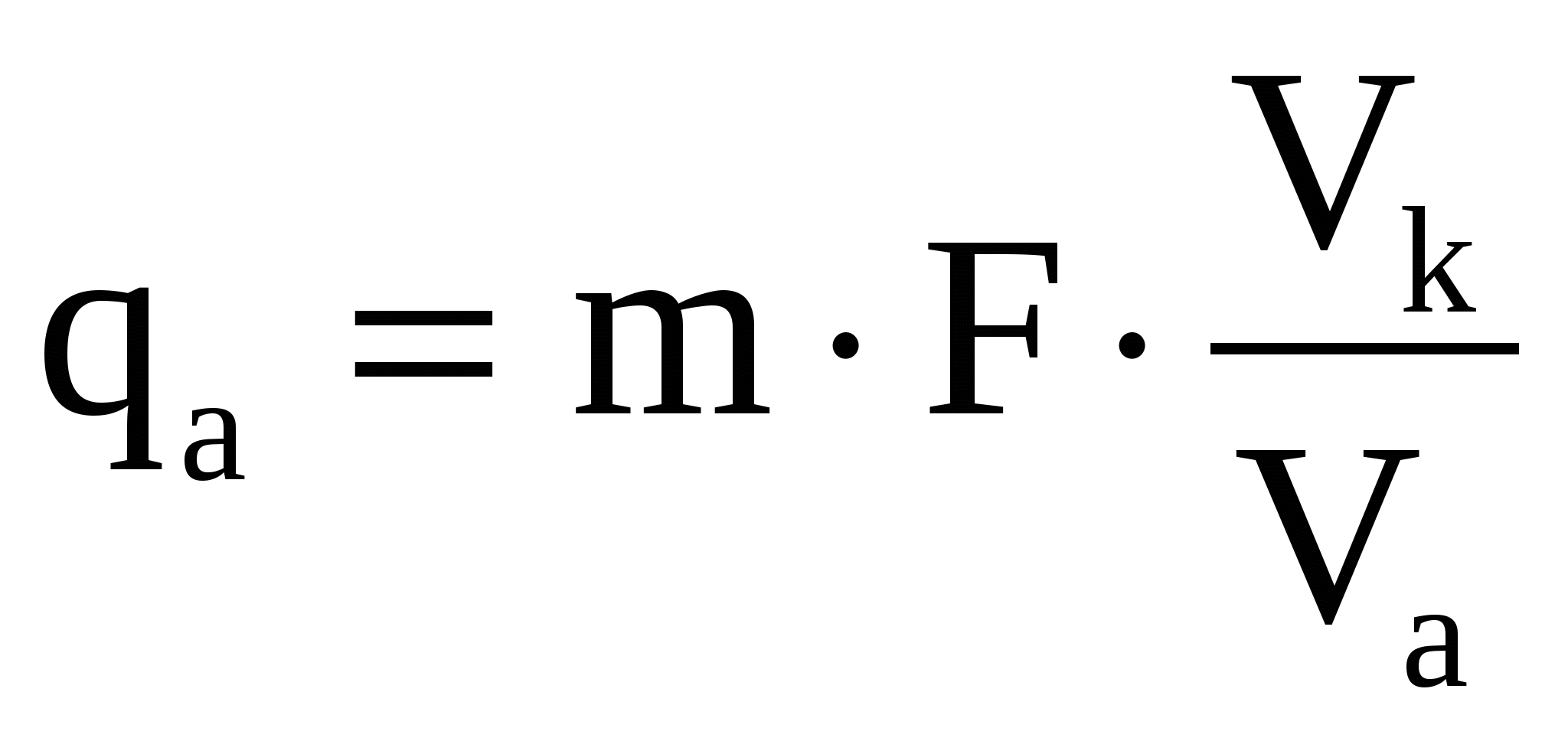
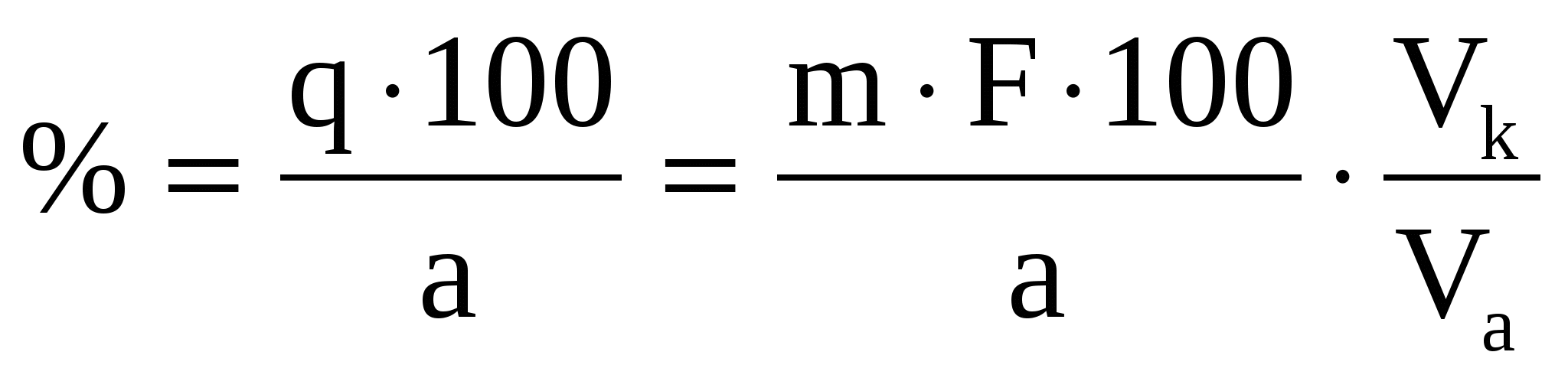
Тогда
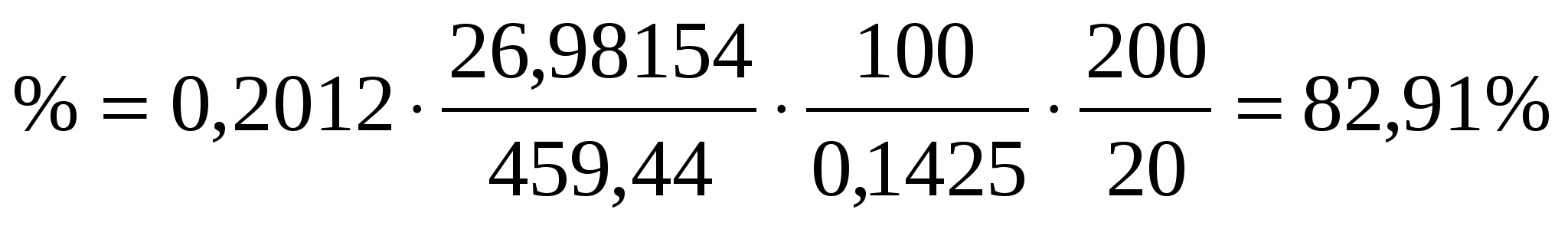
Пример 4
Вычислить число молекул воды в кристаллогидрате хлорида магния, если из навески его массой 0,5000 г. получается 0,2738 г Mg2P2 O7.
Решение
Кристаллогидрат магния: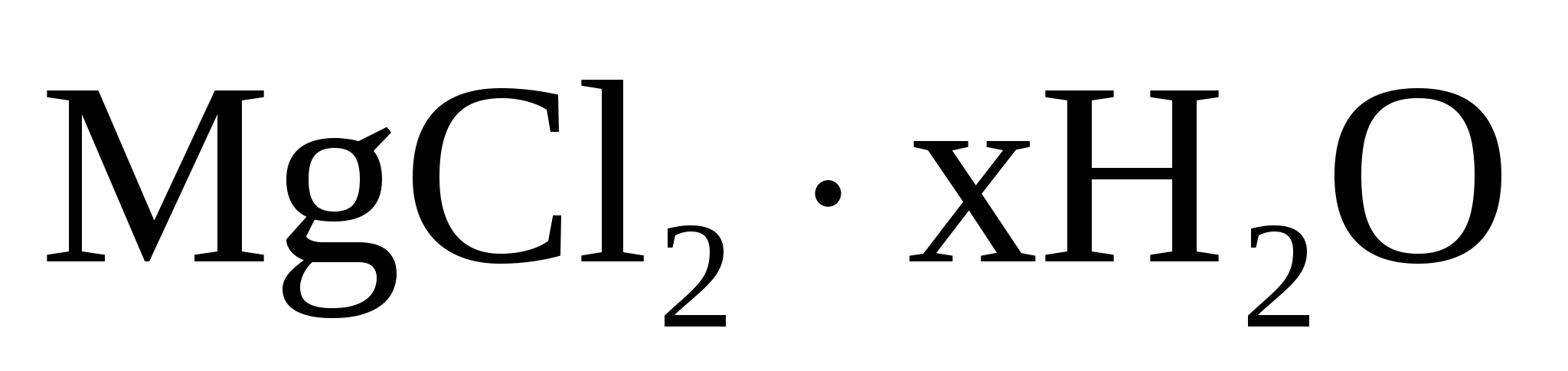
Определяемое вещество 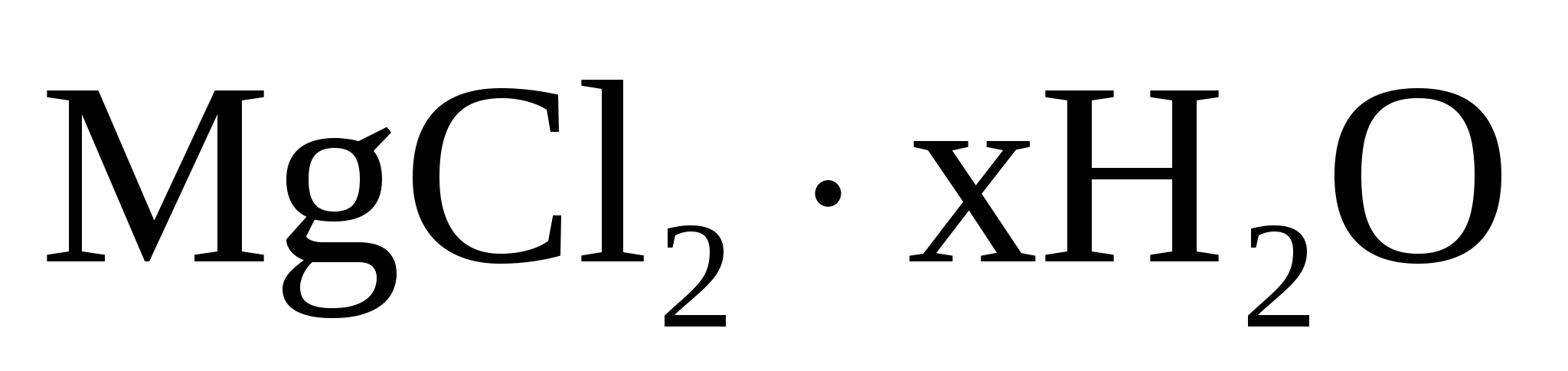
Гравиметрическая форма 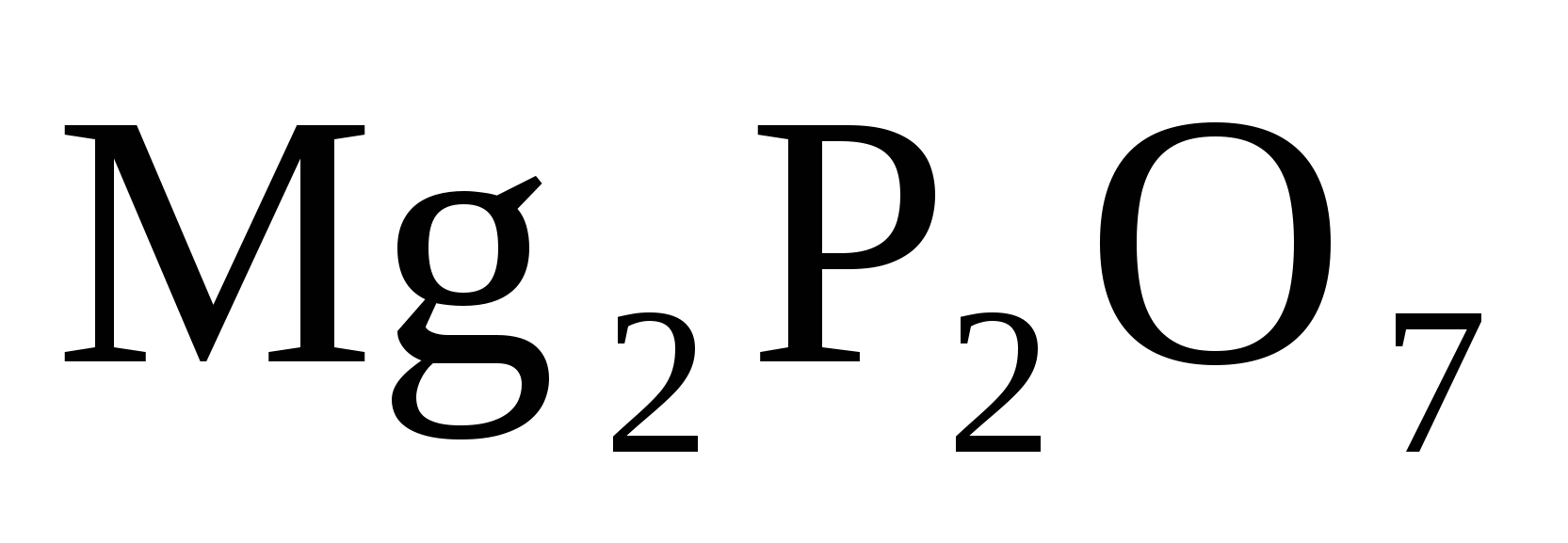
Считаем фактор пересчета
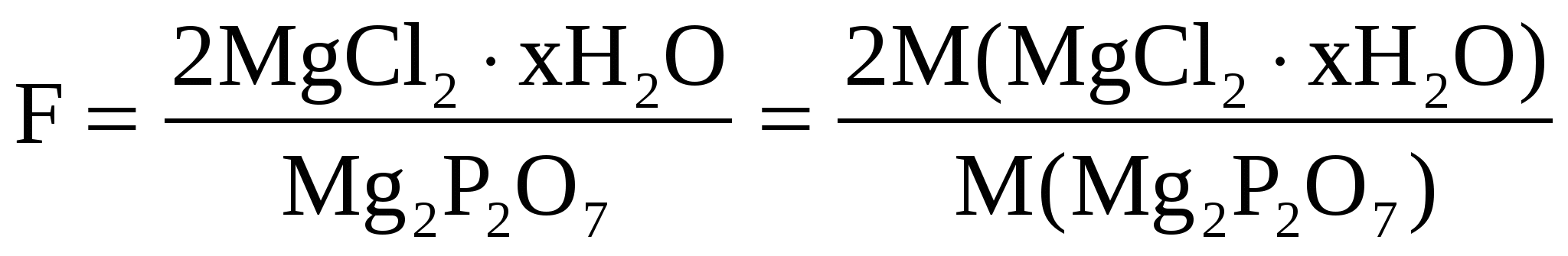
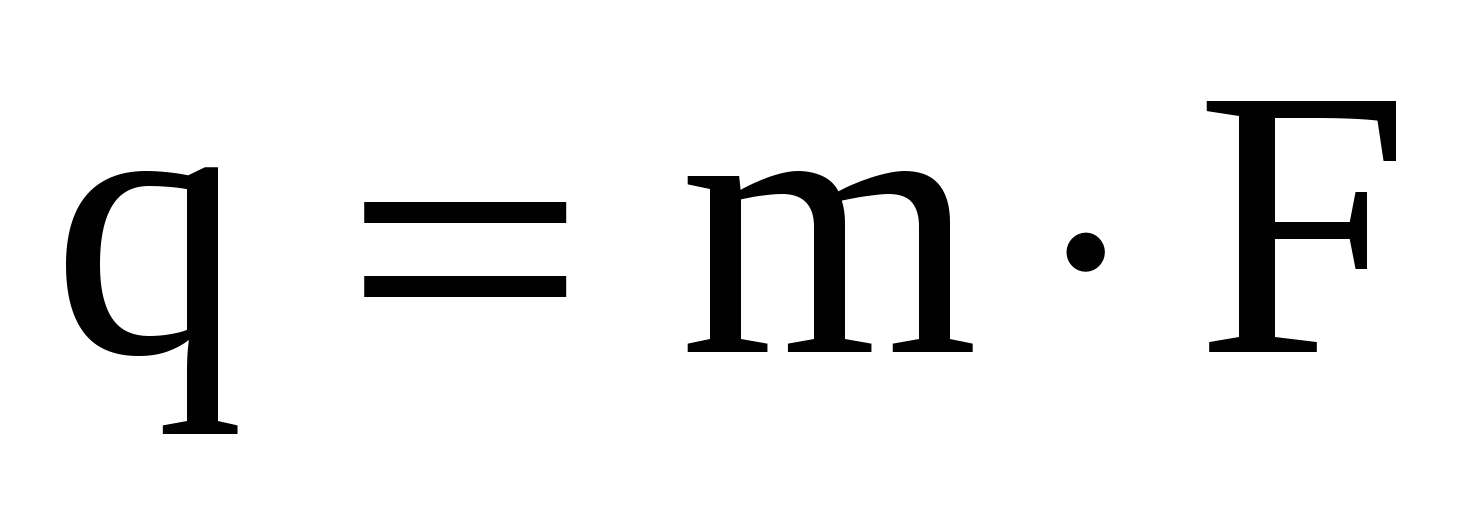
Здесь навеска – это q. Значит
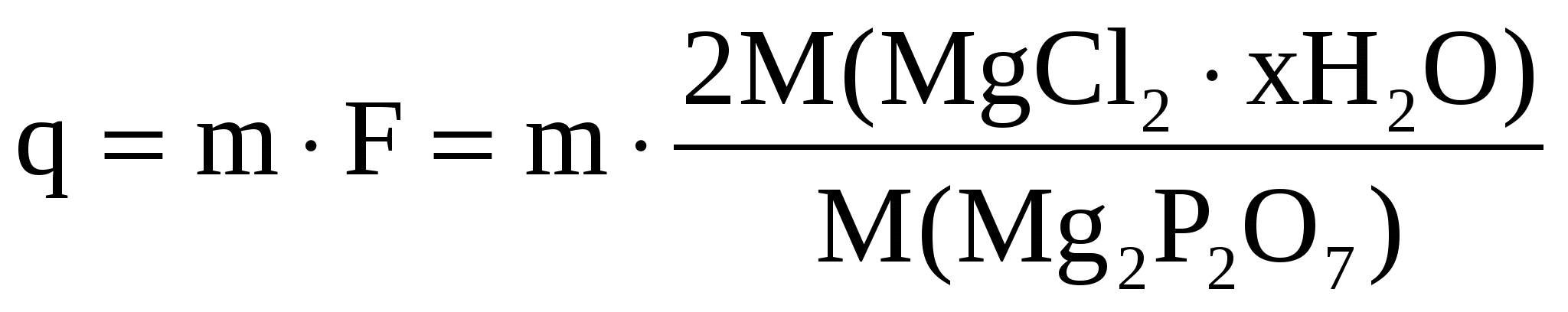
2M(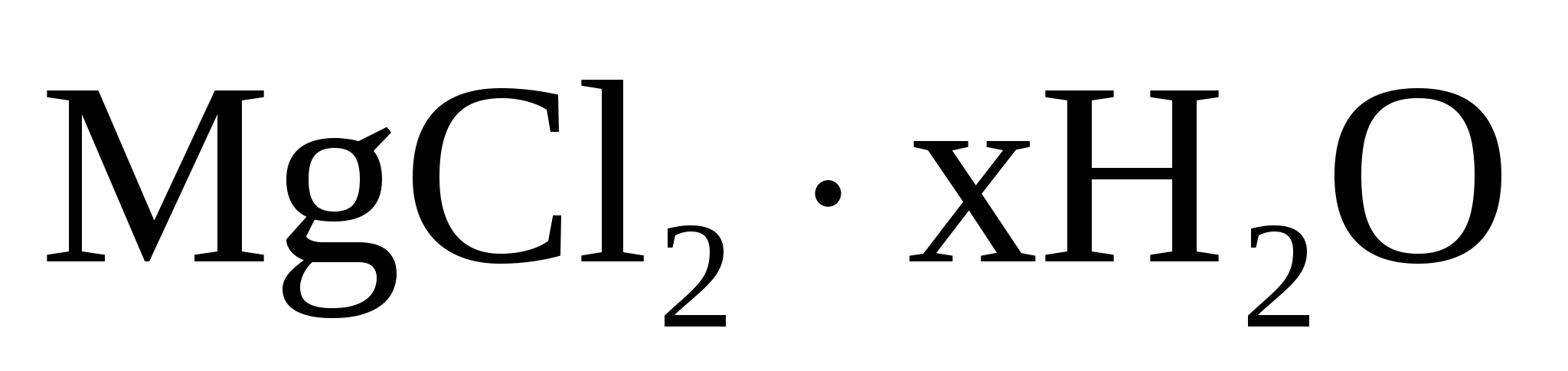 ) = ) = 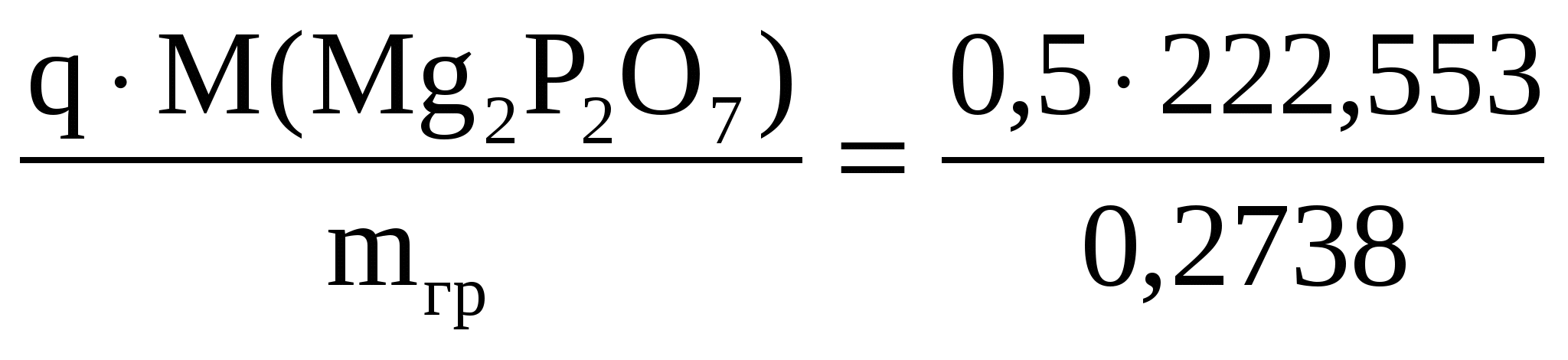
M(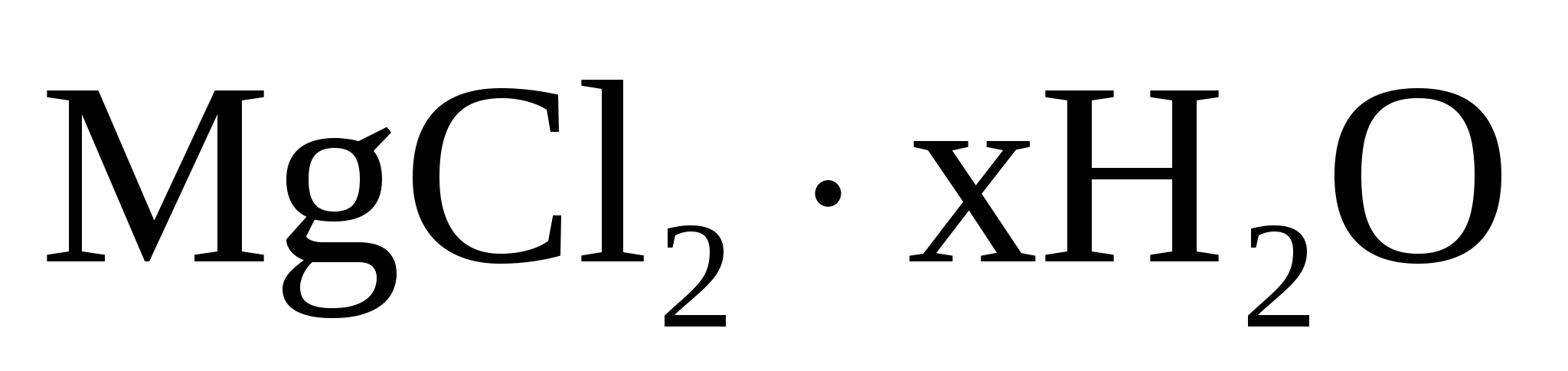 )= )=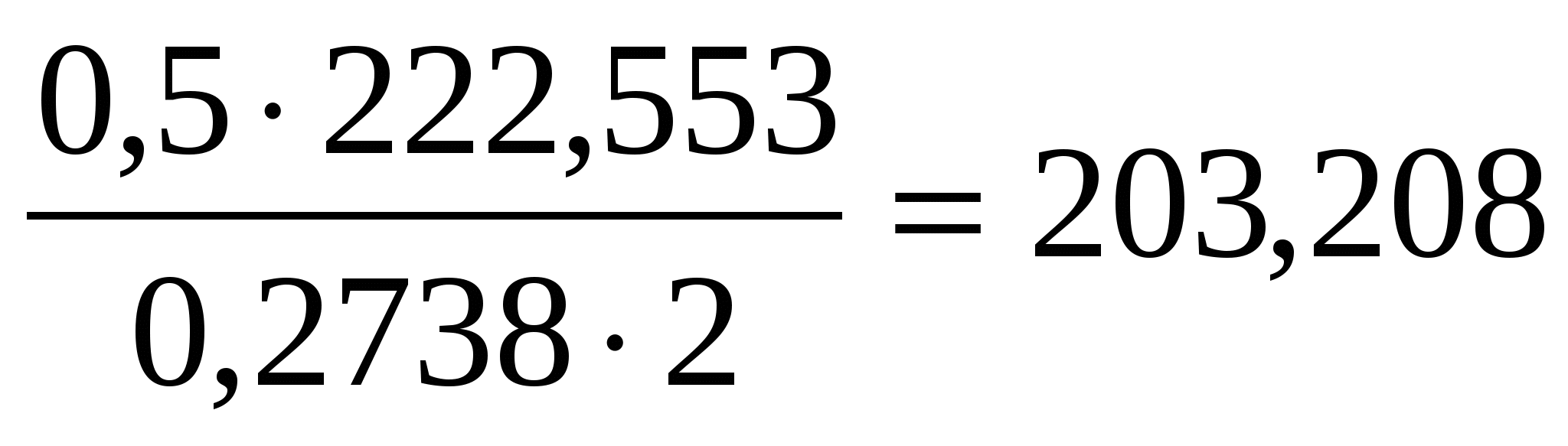
Число молекул в кристаллогидрате находим
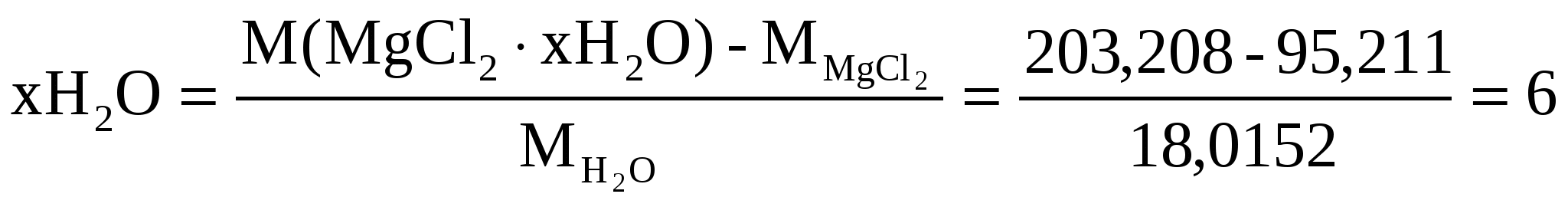
Значит соль 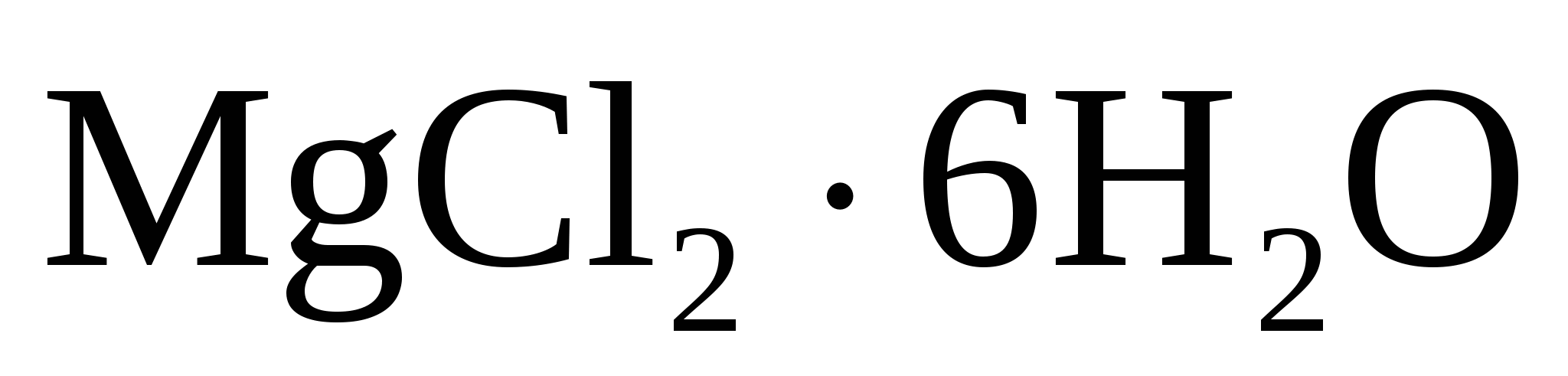
Пример 5
Рассчитать массу навески апатито- нефелиновой руды, содержащей 30 % P2O5 необходимую для получения 0,9 г осадка.
Решение
Определяемое вещество 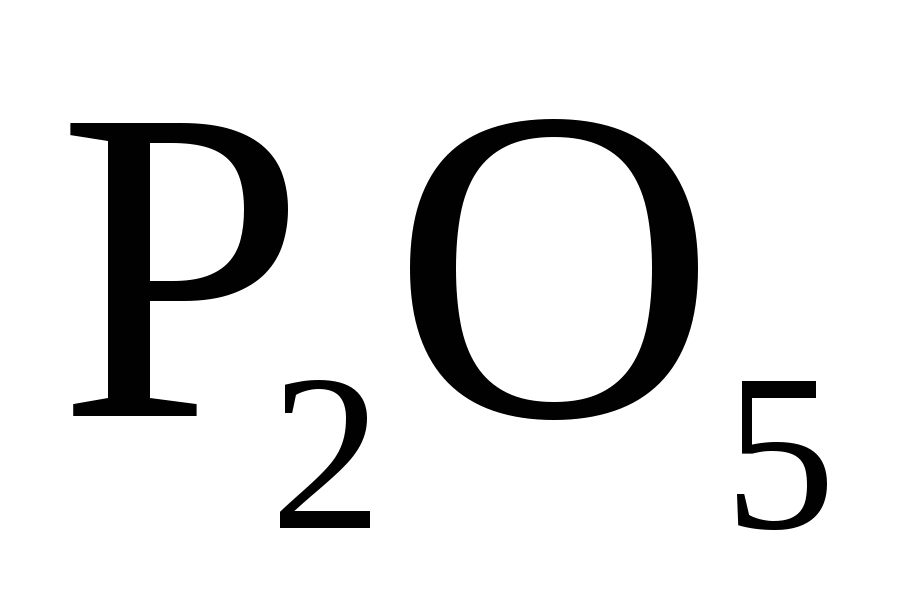
Гравиметрическая форма 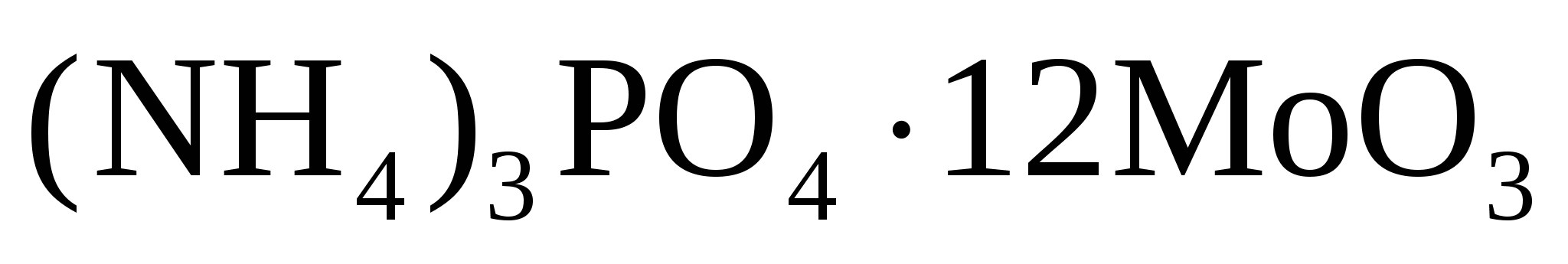
Рассчитаем фактор пересчета
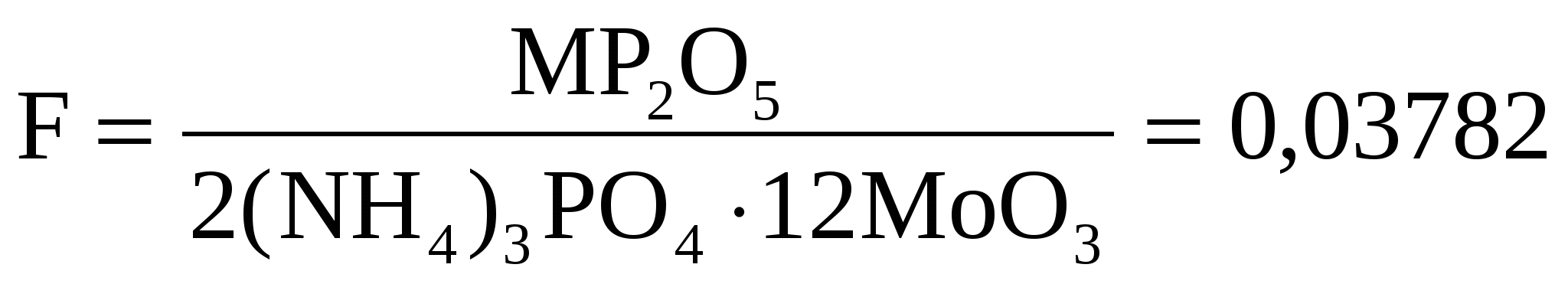
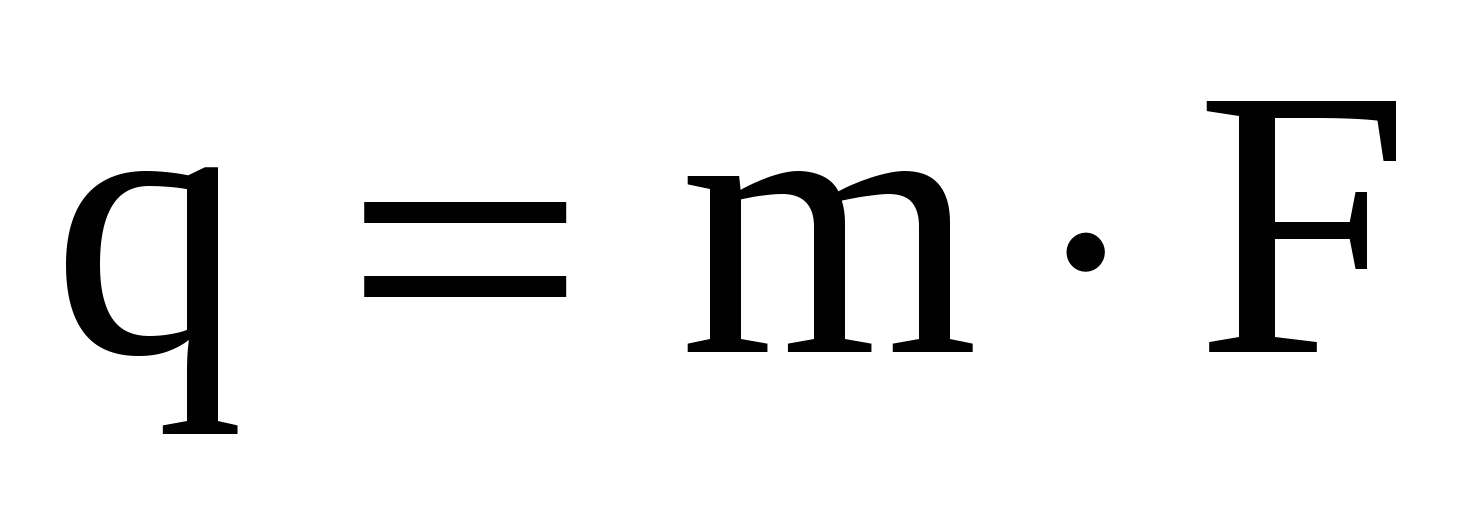
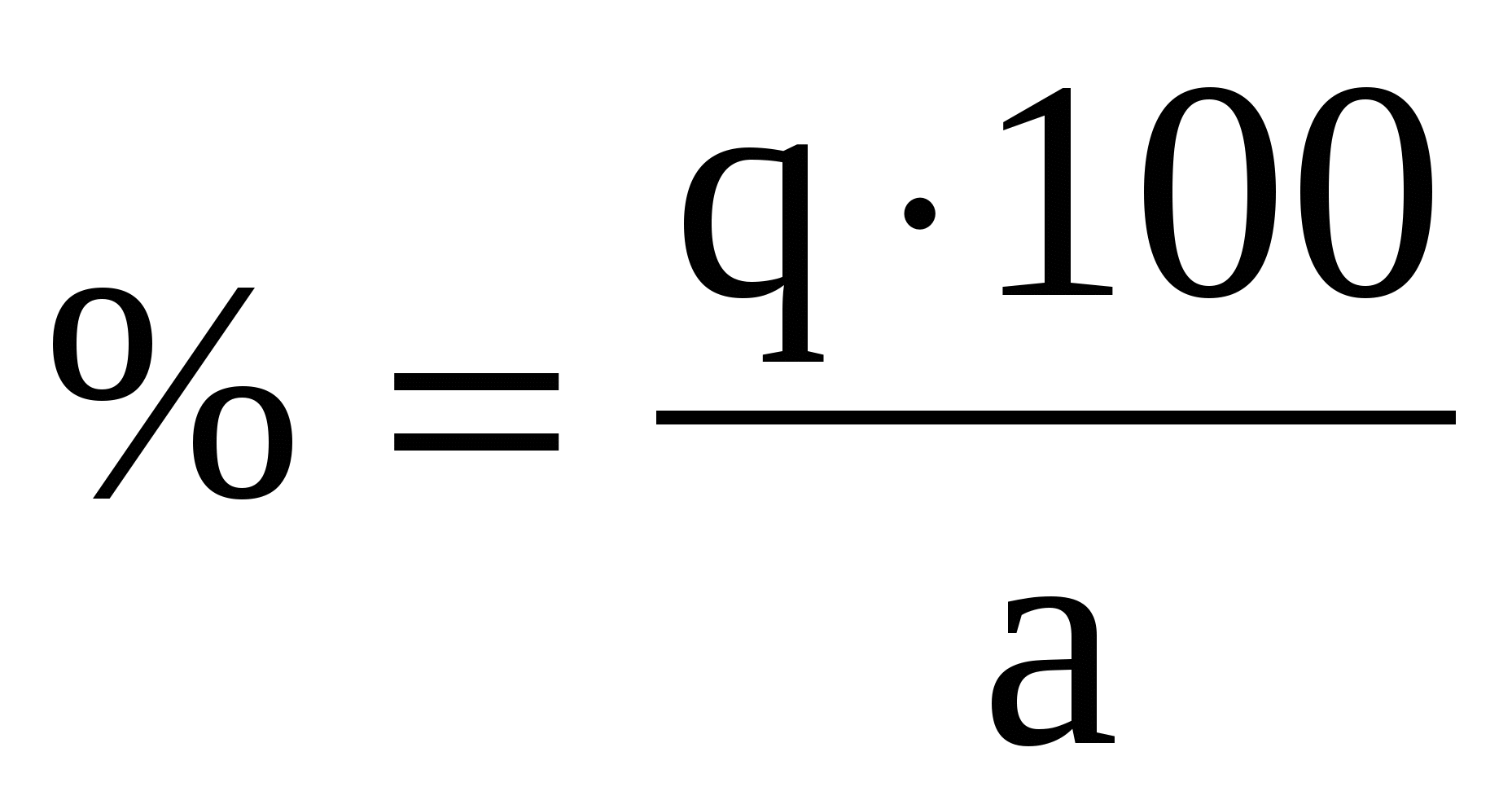
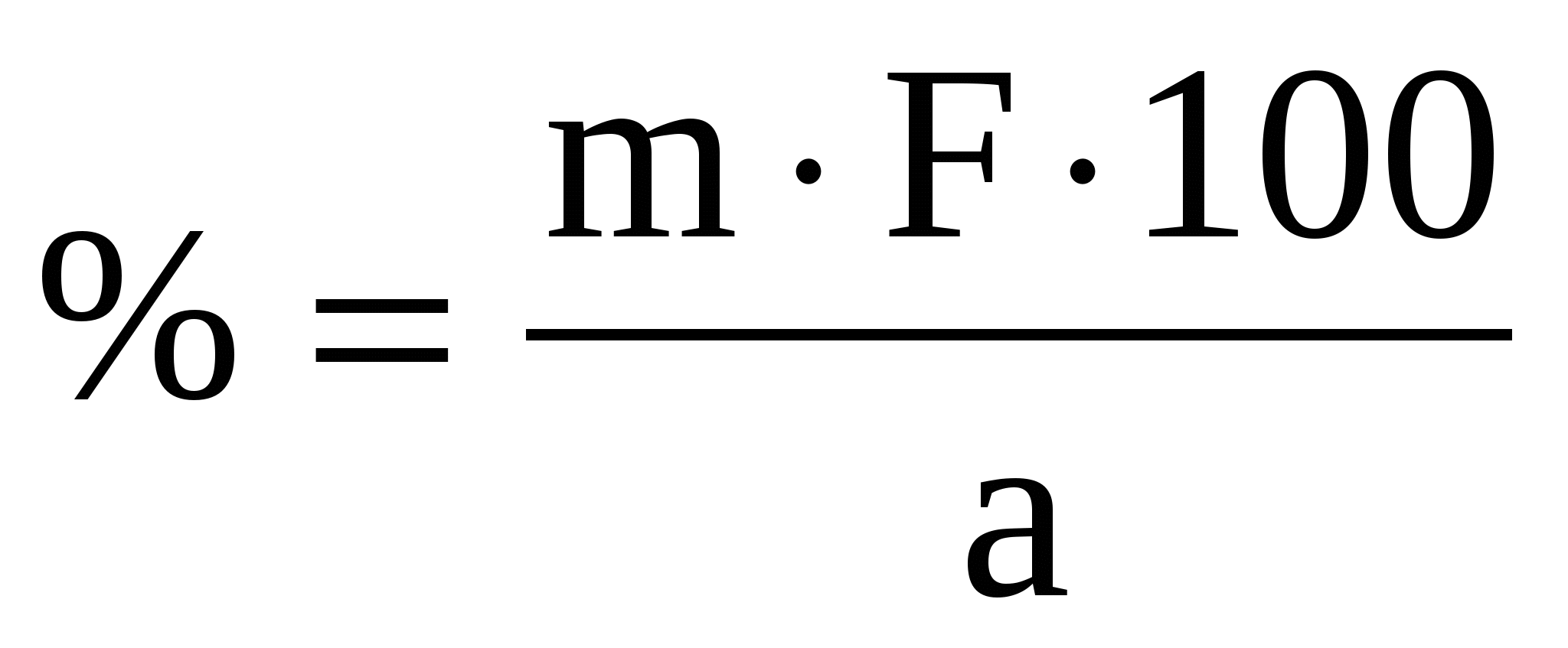
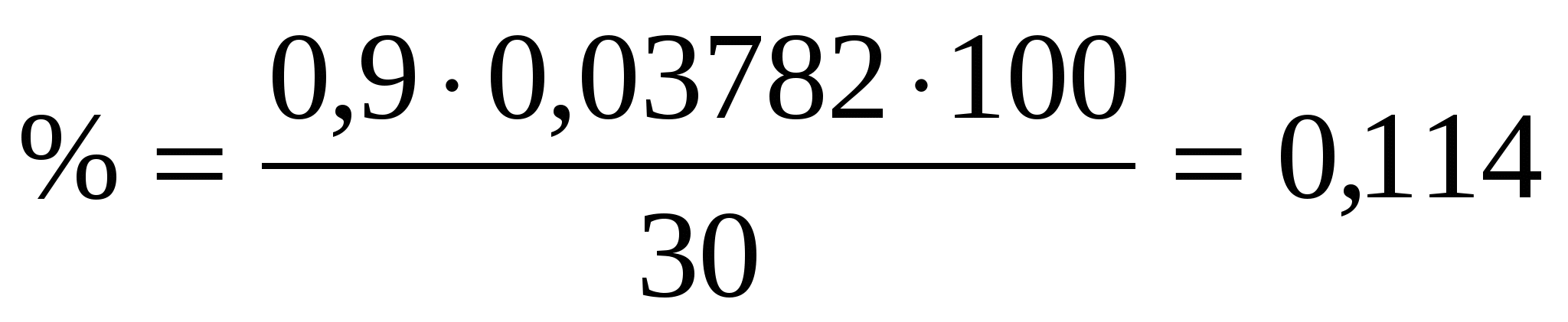
Пример 6
Из навески каменного угля массой 2,6248 г. после соответствующей обработки получили 0,3248 г. BaSO4 . Вычислить массовую долю (%) серы в угле. Пересчитать массовую долю серы на сухое вещество, если содержание влаги составило 2,58%.
Решение
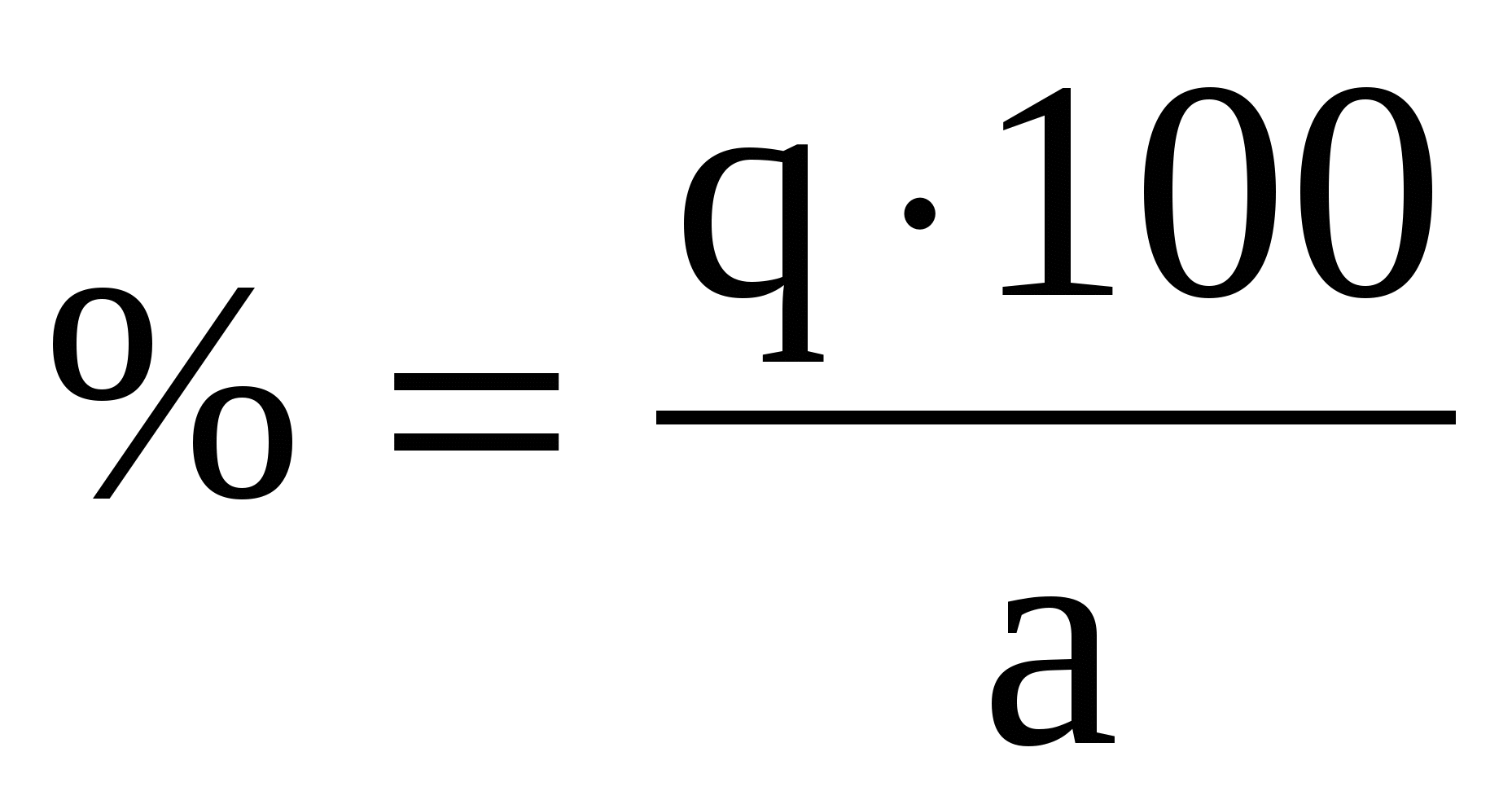
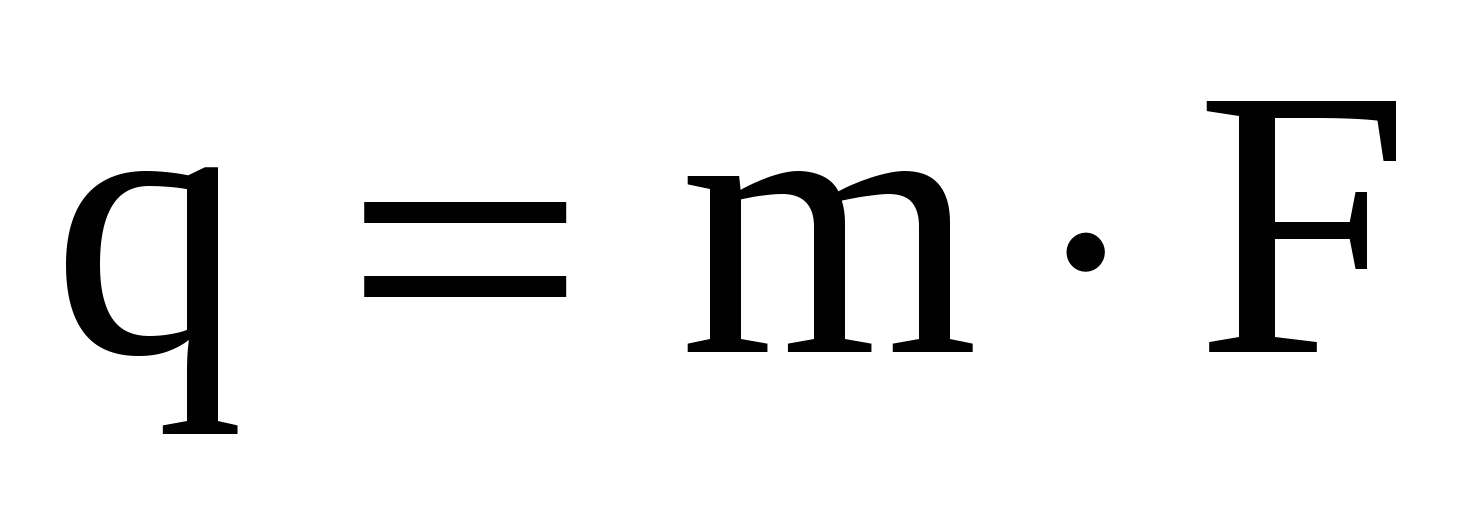
Считаем
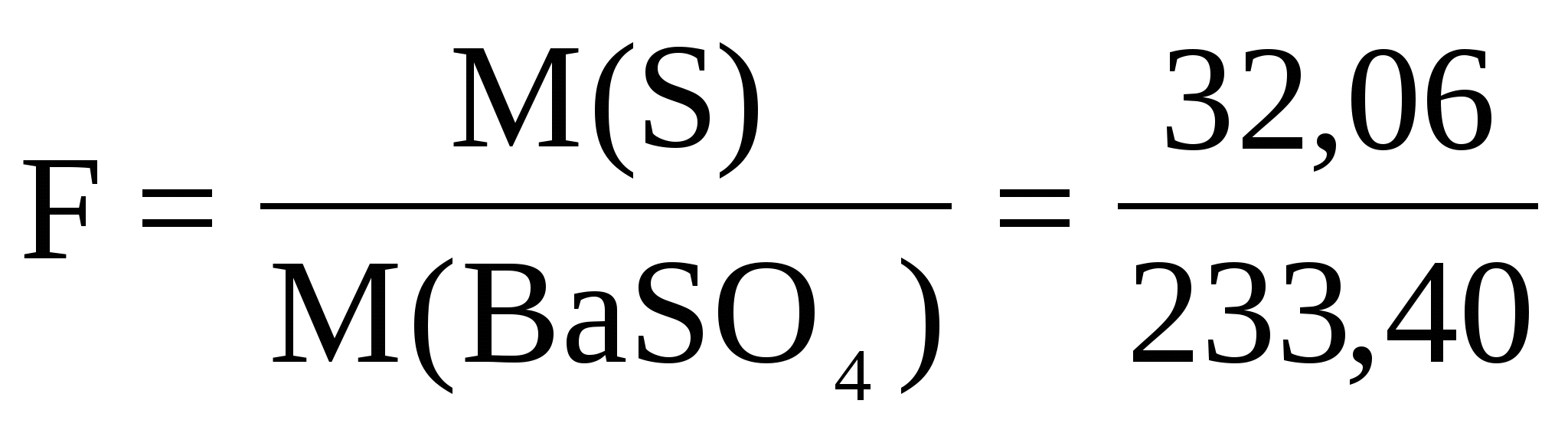
Тогда
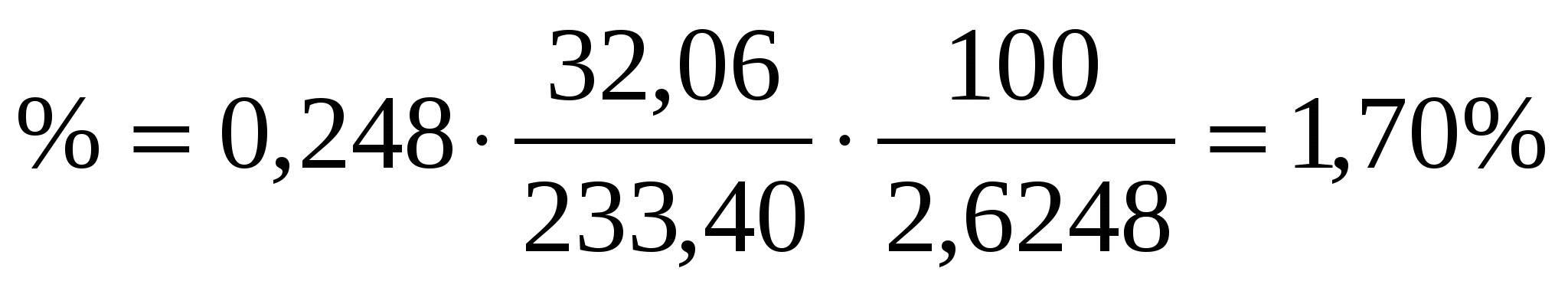
Массовая доля (%) серы в сухом веществе
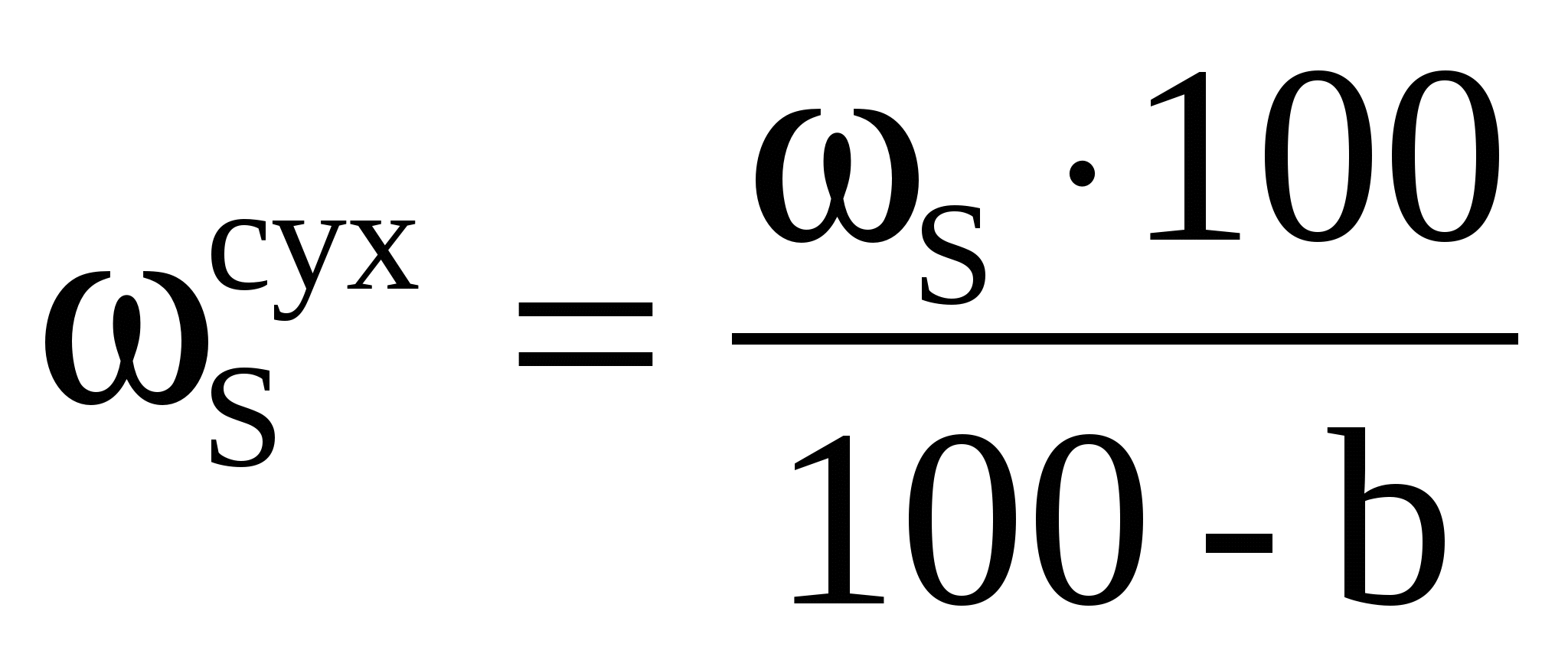 , ,
где b – содержание влаги в %.
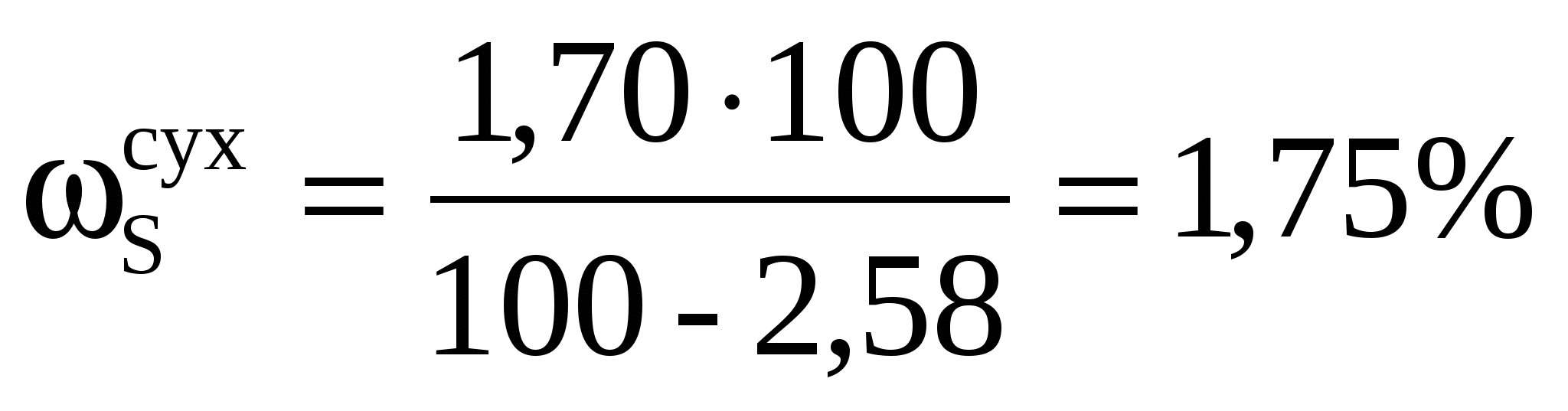
Пример 7
Какой объем раствора карбоната натрия (массовая доля 17,7% ρ=1,19г/см3) требуется для осаждения 0,2 г. кальция при полуторакратном избытке осадителя?
Решение
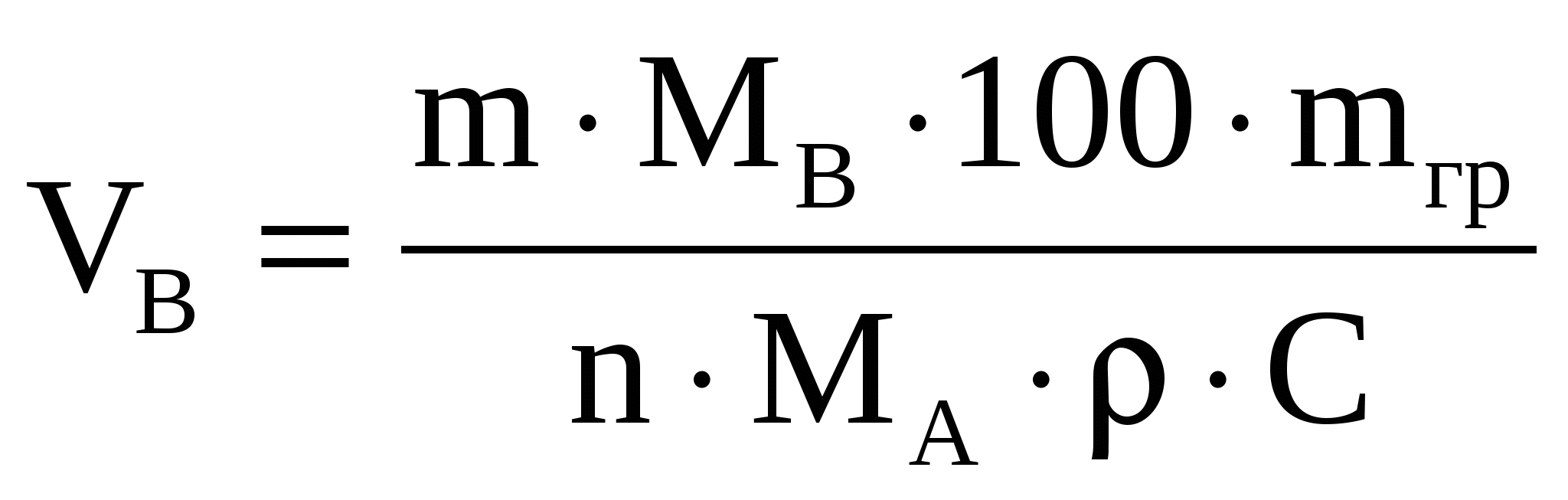
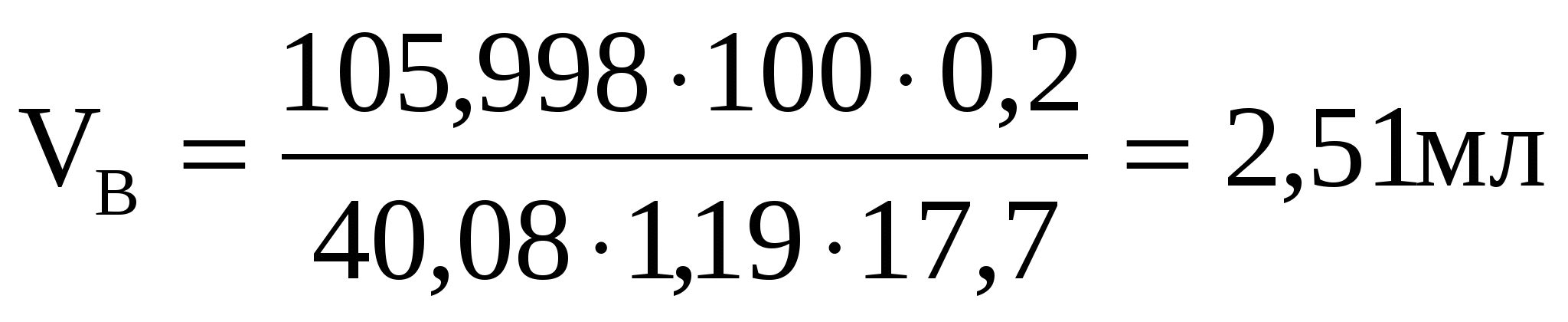 , ,
где 105,988 - молекулярный вес 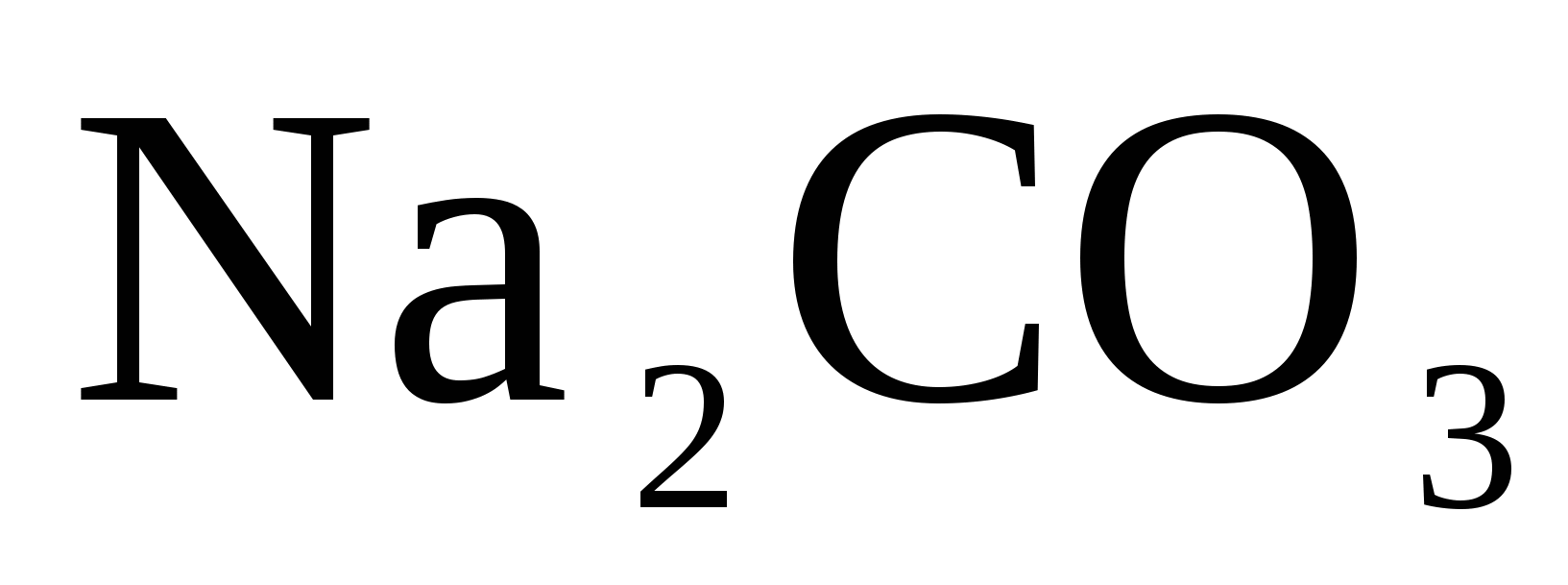 ; ;
40,08 - молекулярный вес кальция.
Пример 8
Какой объем 4% (по массе) раствора оксихинолина C9H7NO , плотностью 1 г/см3. Необходим для осаждения Al3+ из раствора, содержащего 100 мг 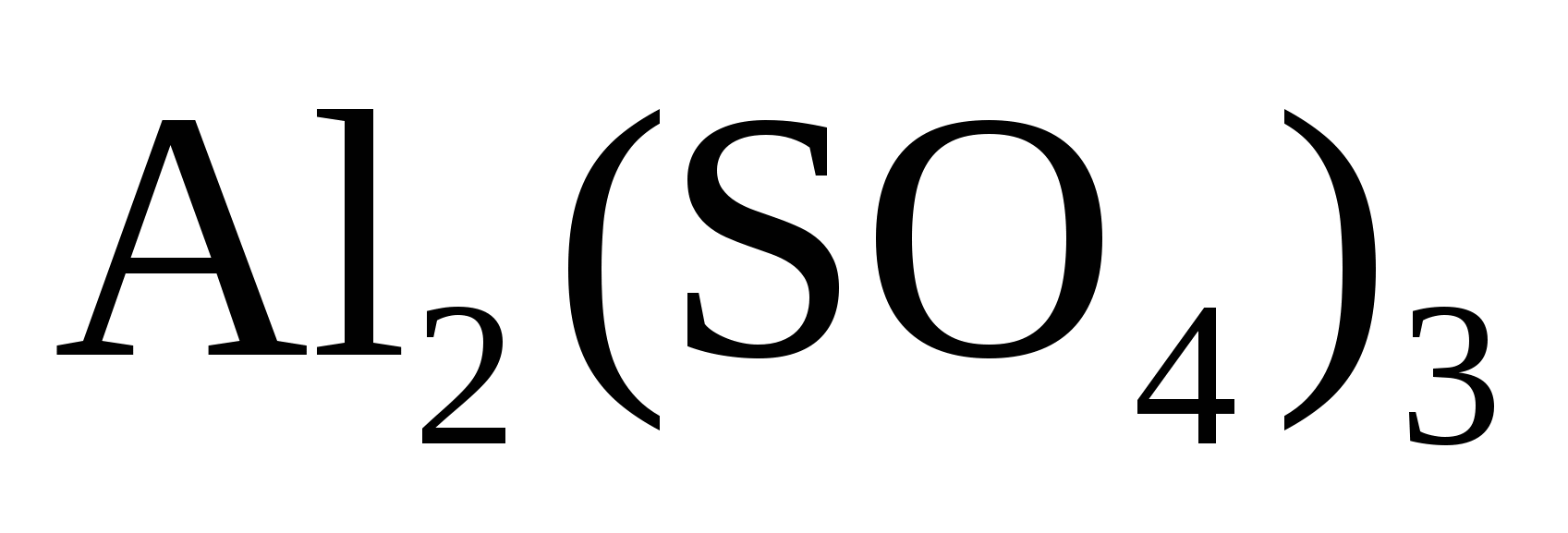 (достаточен избыток осадителя в 10 %) (достаточен избыток осадителя в 10 %)
Решение
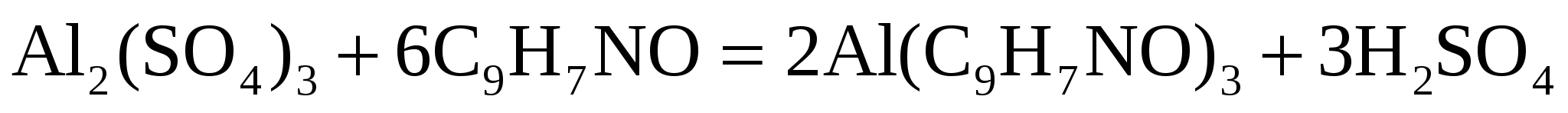
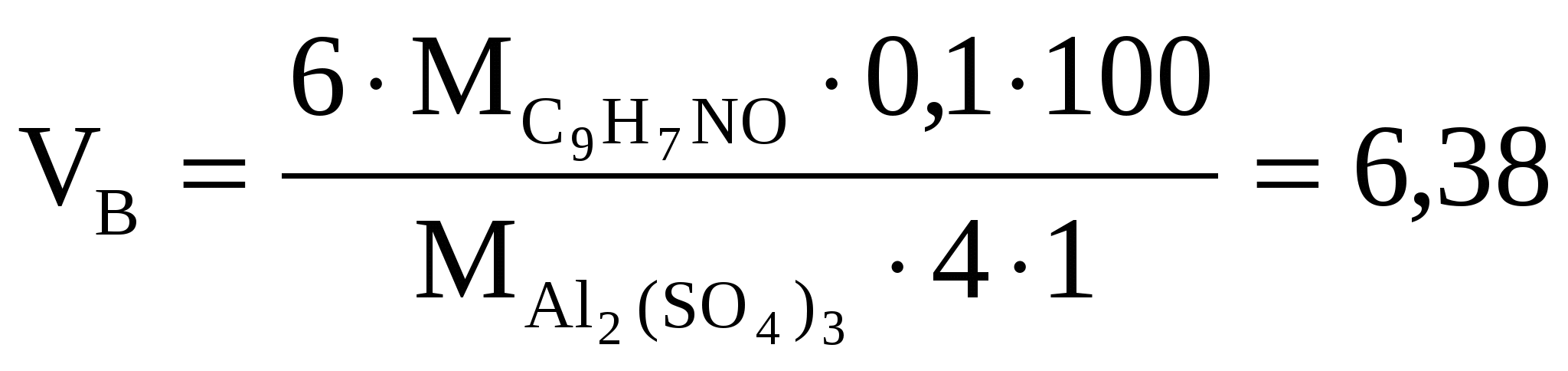 мл мл
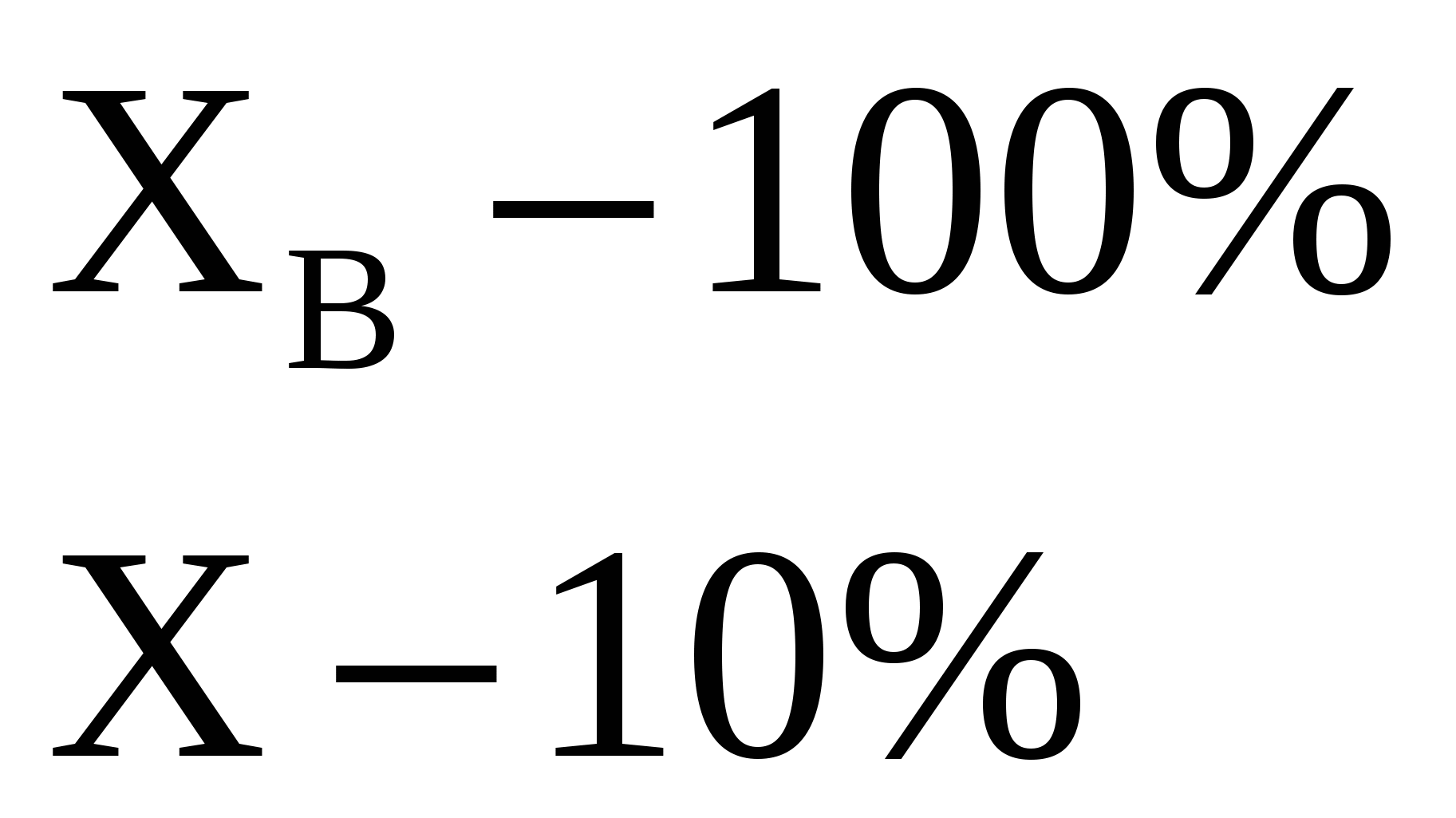 X=0,638 X=0,638
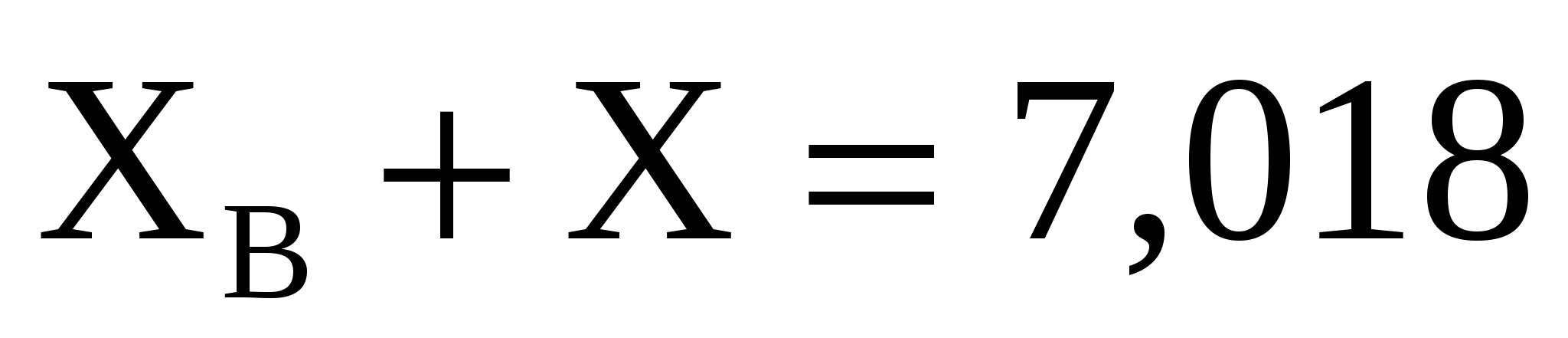 мл мл
Пример 9
При определении оксидов щелочных металлов из образца силикатной породы массой 1,2505 г выделили смесь NaCl и КCl массой 0,1500 г. После многократной обработки этой смеси серной кислотой получили сульфаты Na2SO4 и К2SO4 массой 0,1800 г. Вычислить массовые доли (%) Na2O и К2O в силикатной породе.
Решение
ωх – массовая доля Na2O в образце
ωу – массовая доля К2O
I уравнение
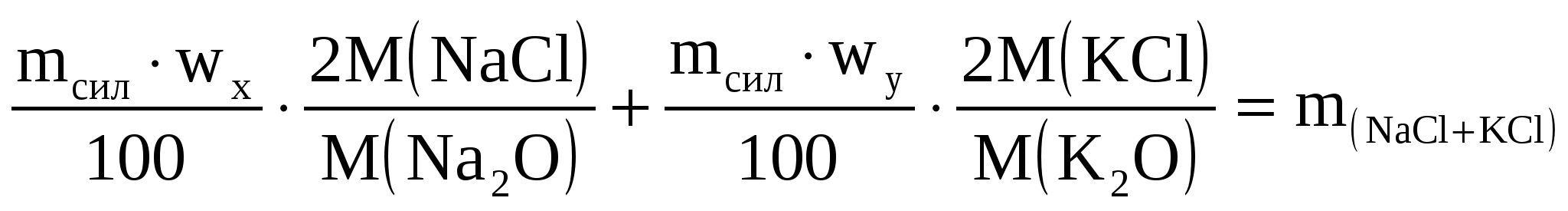
II уравнение
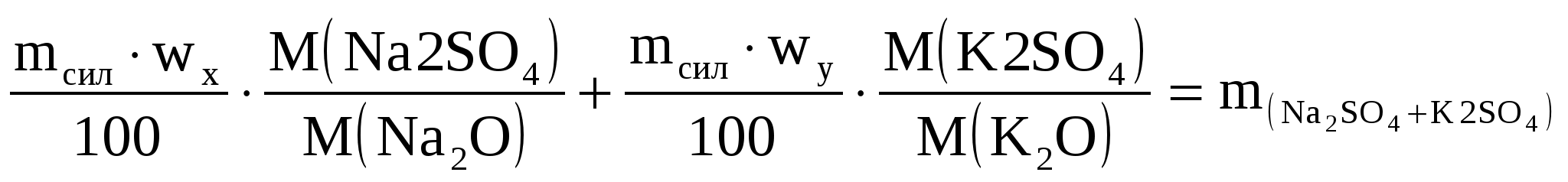
Подставляем числовые значения
в I уравнение
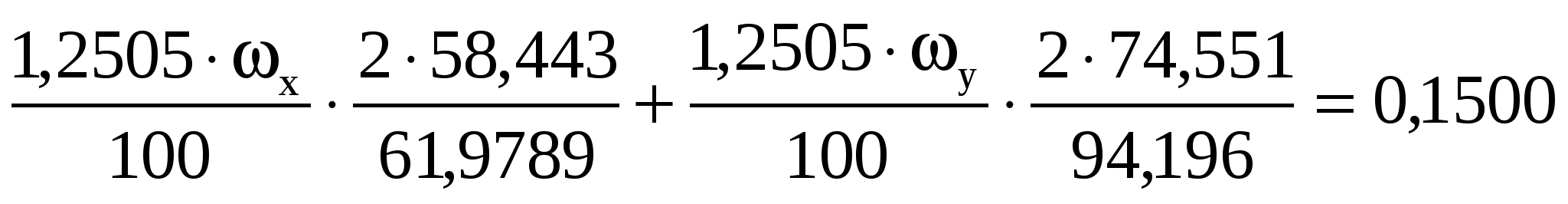
во II уравнение
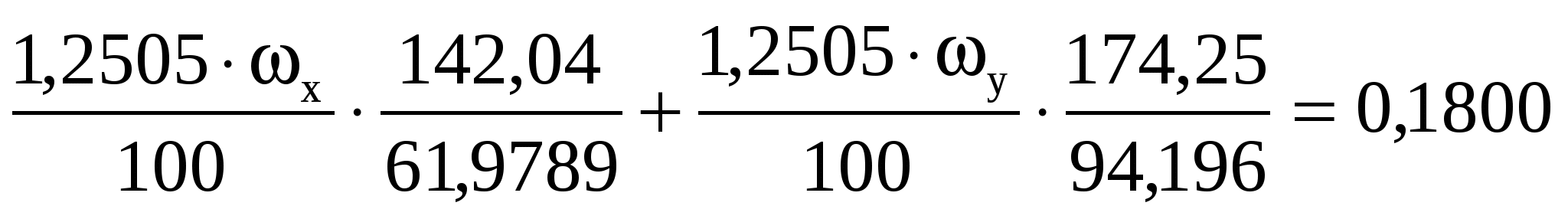
Решаем систему уравнений и находим
ω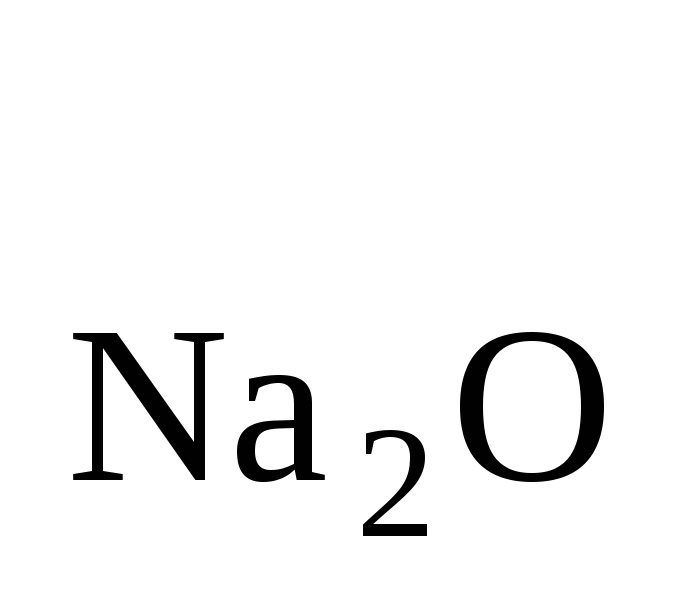 = ωх = 4,28 % = ωх = 4,28 %
ω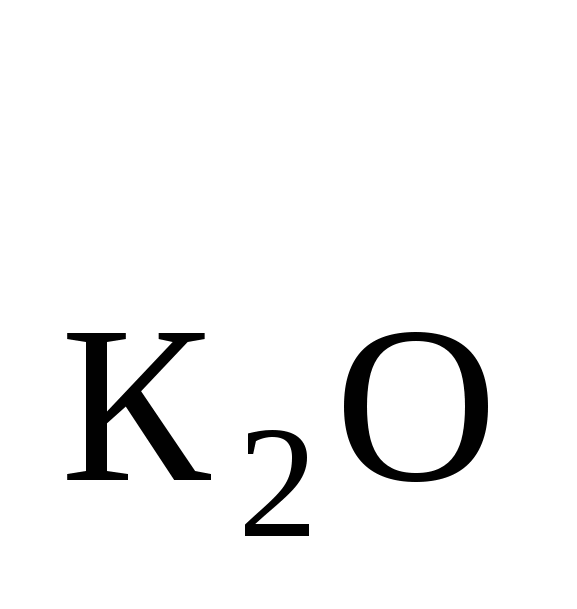 = ωу = 2,48 % = ωу = 2,48 %
Пример 10
Образец содержит 2% К2SO4 и 5% КNO3. Рассчитать массу навески образца, необходимую для получения 0,3 г KClO4.
Решение
Содержание в виде доли 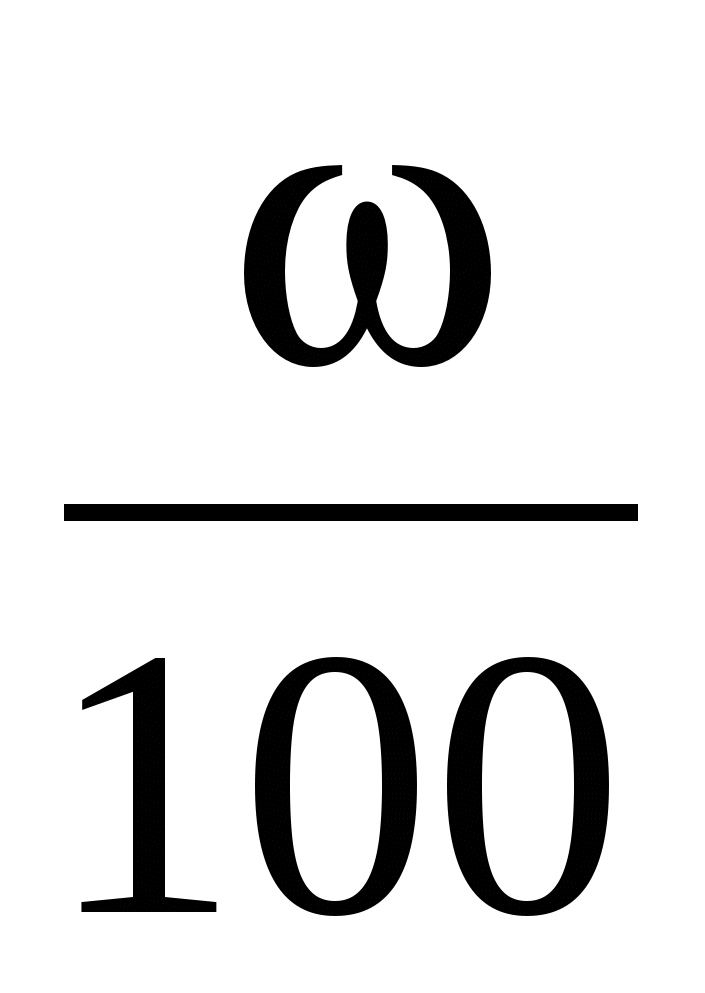
К2SO4 = 0,02 КNO3 = 0,05
Масса навески mобр.
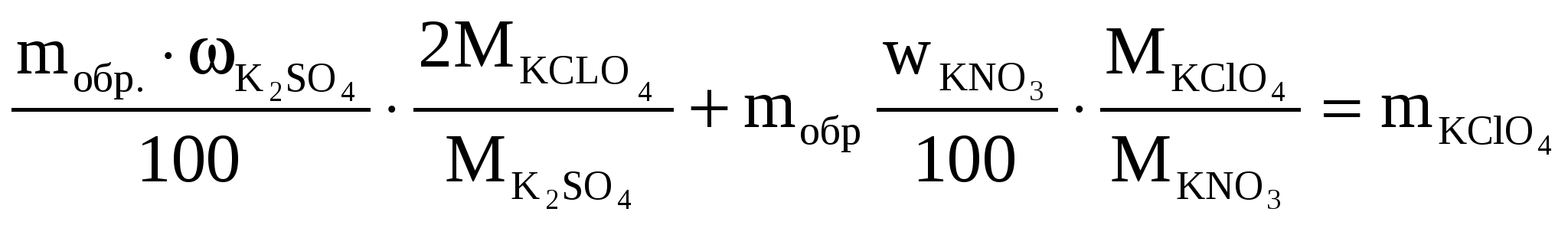
Подставим числовые значения, получаем
mобр =ассчитатРасчитать
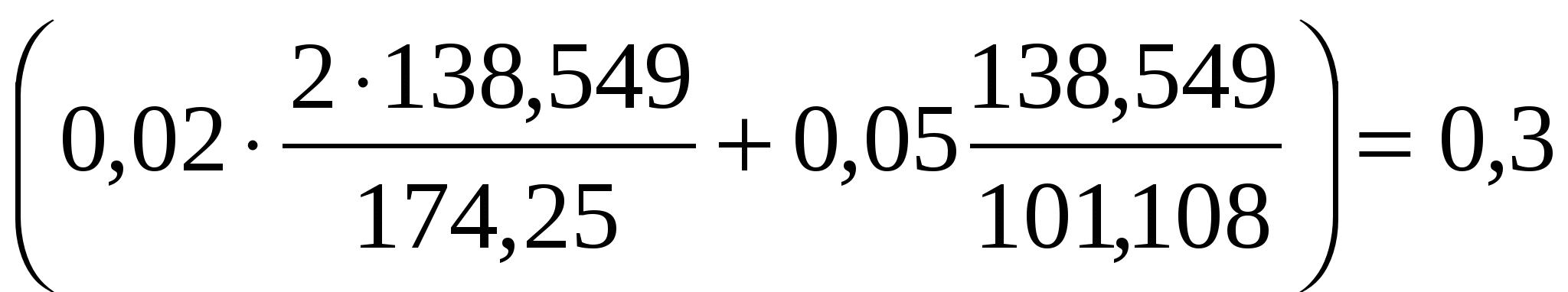
Отсюда mобр = 2,992 = 3,0 г
Пример 11
Навеску инсектицида массой 0,2795 г, содержащую линдан С6Н6Сl6 (M = 290,8 г/моль) и ДДТ С14Н9Сl5 (М = 354,5 г/моль), сожгли в токе кислорода до СО2, Н2О и HCl.
Из поглотительного раствора получили осадок AgCl массой 0,7161 г. Вычислить массовые доли (%) линдана и ДДТ в препарате.
Решение
Обозначим mx – масса линдана,
(mинсект - mx) – масса ДДТ
Составляем расчетное уравнение
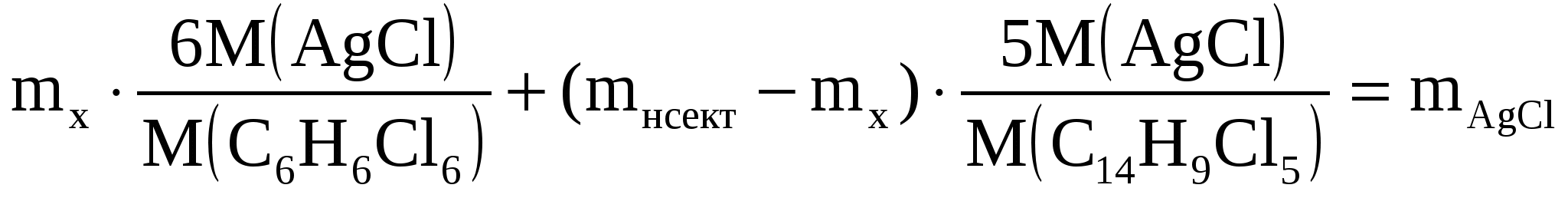
Подставляем числовые значения
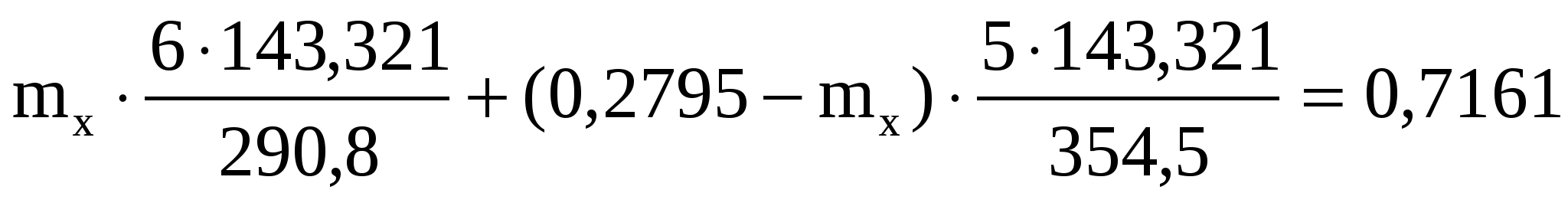
Решая уравнение, находим
mx = 0.1615 г
И далее
ω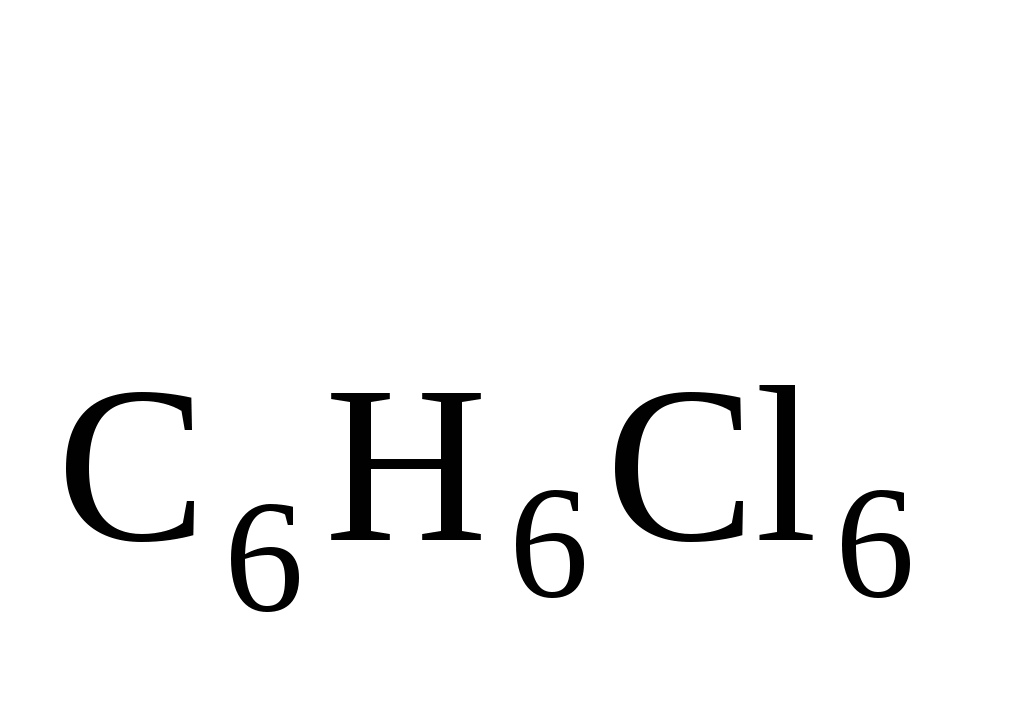 = =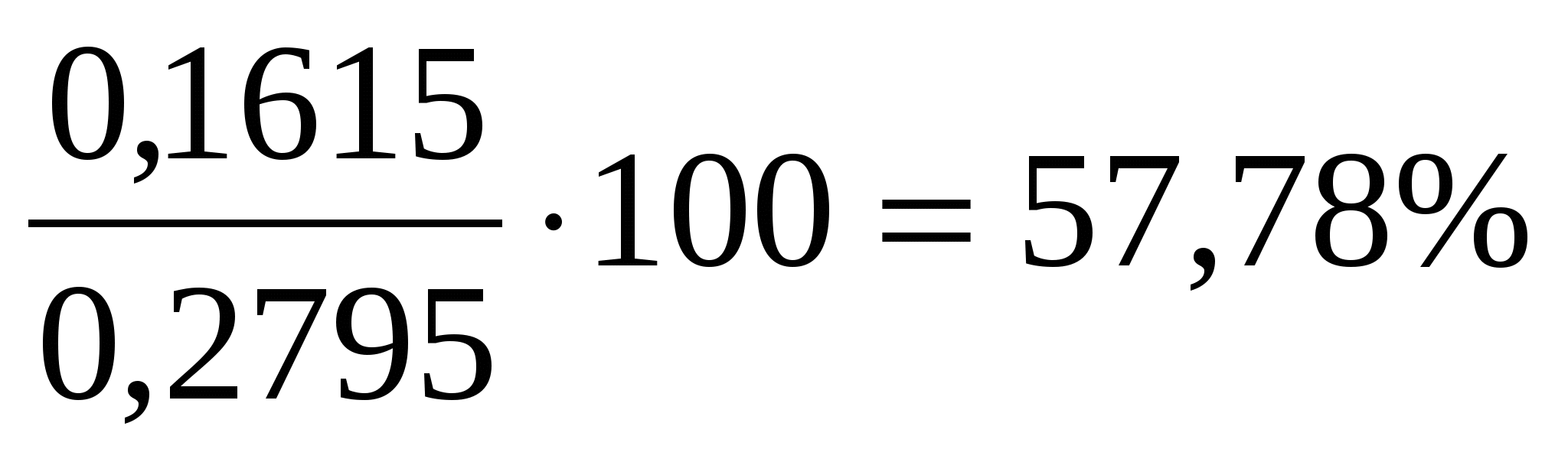
ω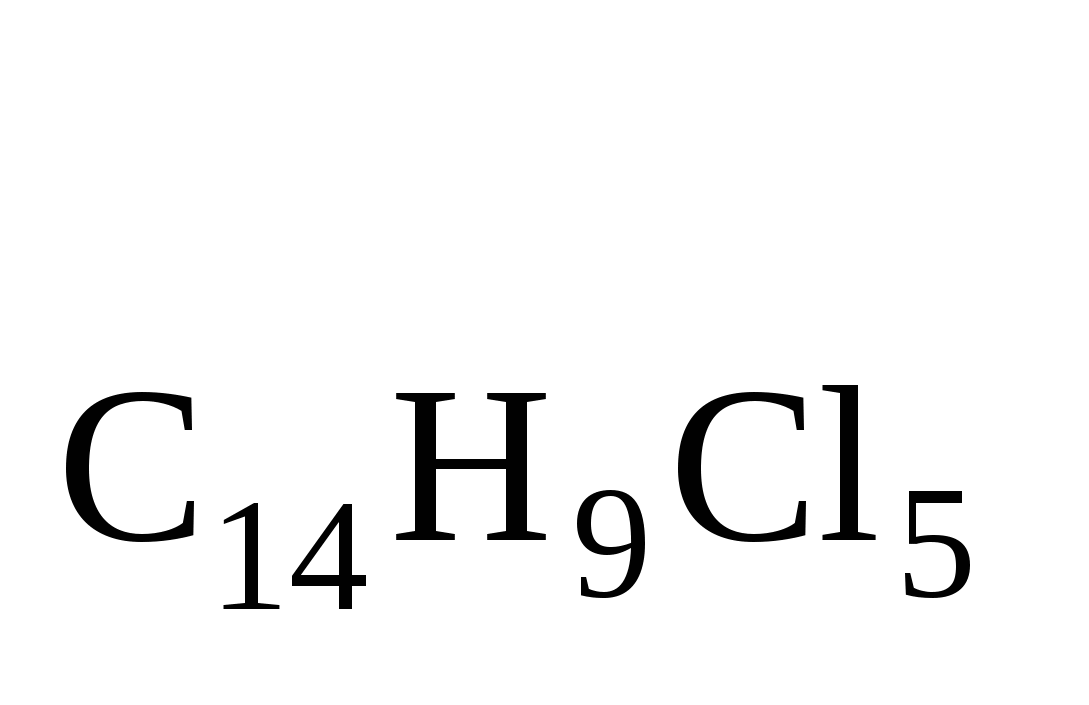 = =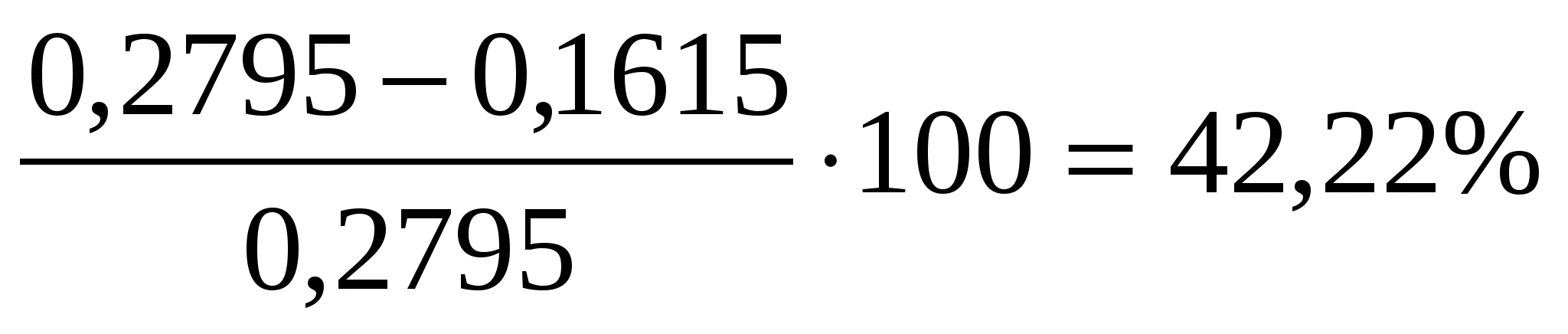
Пример 12
Вычислить эмпирическую формулу фосфорита, если в результате анализа получили содержание: 54,58% СаО; 1,86% F; 3,44% Cl; 41,61% P2O5.
Решение
Находим молярное соотношение (%) компонентов
СаО : F : Cl : P2O5 = 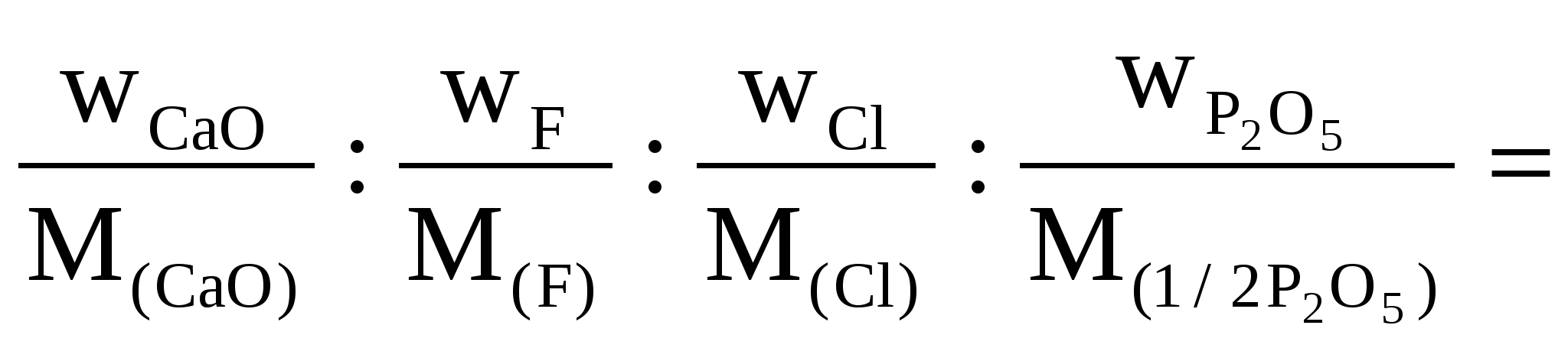
=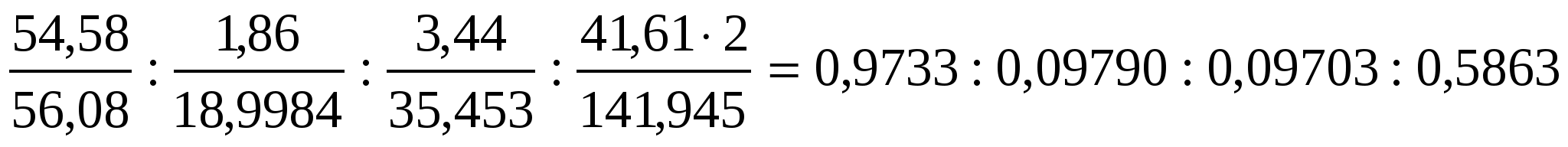
Наименьшее число 0,09703 принимаем за единицу и выражаем полученное соотношение целыми числами, учитывая, что n (Ca) = n(CaO)
n(PO4)3- = n(1/2 P2O5) :Ca : F : Cl : PO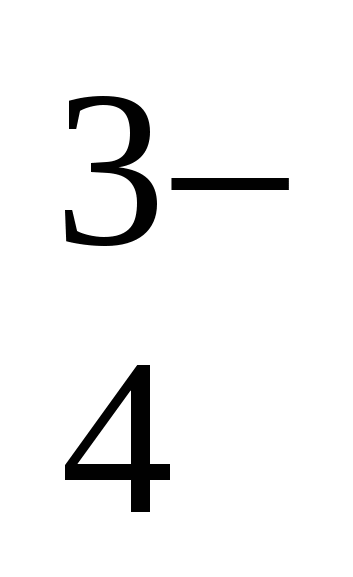 = 10 : 1 : 1 : 6 = 10 : 1 : 1 : 6
Эмпирическая формула фосфорита
Са10(РО4)6 ClF или 3Са3(РО4)2 · Са · Cl · F
Задачи для самостоятельного решения
А.Вычислить фактор пересчета
Определяемое вещество Гравиметрическая форма
Na2S203 BaSO4
Ba BaSO4
Al Al2O3
Na2O NaCl
CaCО3 CaSO4
CaO CaCO3
Ca3(PО4)2 CaO
FeO Fe2O3
FeSO4 Fe2O3
H3PO4 Mg2P2O7
Pb3O4 PbSO4
Fe3O4 Fe2O3
N (NH)2PtCl6
CuO CuSCN
K2O K2PtCl6
Ag2O AgCl
MoO3 (NH4)3PO4·12MoO3
P2O5 (NH4)3PO4·12MoO3
K K2SO4
MgO Mg2P2O7
K K2PtCl6
Mg Mg2P2O7
SiF4 SiO2·12MoO3
Ответы: 1.0,3388; 2. 0,5885; 3.0,5294; 4. 0,7352; 5. 0,7352; 6. 0,5604; 7. 1,8439; 8. 0,8998; 9. 1,9023; 10. 0,8804; 11. 0,7536; 12. 0,9666; 13. 0,0631; 14. 0,6539; 15. 0,1938; 16. 0,8085; 17. 0,9206; 18. 0,0378;19. 0,4488; 20. 0,3622; 21. 0,1609; 22. 0,2185; 23. 0,0582;
Б. Расчет содержания определяемого вещества и навески
Какую навеску латуни, содержащей 5% олова, нужно взять для определения его в виде диоксида? Ответ: 1,6 г.
Сколько процентов MgSO4*7H2O содержит проба технического сульфата магния; если из его навески 0,4085 г. получено 0,1800 г. Mg2P2O7?Ответ: 97,54%.
Какой должна быть навеска чугуна с массовой долей серы 2%, если для ее гравиметрического определения в виде сульфата бария, чтобы получить можно было при анализе 0,5 г. осадка? Ответ: 3,435 г.
Вычислить массовую долю меди в образце руды, если из 0,4320 г. пробы получено 0,1985 г. Cu(SCN)2. Ответ:23,89%.
При гравиметрическом определении свинца из 2,000 г. сплава получено 0,6048 г. PbSO4. Вычислить массовую долю свинца в сплаве. Ответ: 20,69%.
Какую навеску FeSO4∙7H2O нужно взять для определения в нем железа в виде окиси железа, если максимальный вес весовой формы 0,1 г.? Ответ: 0,3888 г.
Какую навеску соли, содержащей по массе 85% Al2(SO4)3·18H2O надо взять, чтобы получить в качестве гравиметрической формы не более 0,15 г Al2O3? Ответ: 1,15г.
Рассчитать массовую долю карбоната магния в известняке, если навеска его 0,9866г., а в результате анализа получено 0,4105 г. Mg2P2O7.Ответ: 31,48%.
Рассчитайте массу навески известняка для определения кальция в виде его оксалата, если гравиметрической формой служили: а) оксид кальция; б) сульфат кальция; Масса гравиметрической формы 0,1 г. Ответ: а) 0,50 г.; б) 0,23 г.
Вычислить массовую долю(%) Fe3O4,если из навески руды массой 0,50000г получили 0,3989г Fe2O3.Ответ: 77,12%.
Вычислить массовую долю(%) FeO в образце технического железного купороса, если из навески массой 0,9200 г в результате анализа получили 0,2545 г Fe2O3. Вычислить массовую долю (%) FeSO4 ·7H2Oв исследуемом образце. Ответ: 24,89%; 96,32%.
Из навески технического сульфида натрия массой 0,3000г после окисления сульфида до сульфата получили 0,8250 г BaSO4. Вычислить массовую долю (%) серы в исследуемом образце и сравнить его с теоретическим. Ответ: 37,79%; 41,08%.
Из навески криолита массой 0,4525г получили 0,0809 г Аl2О3. Вычислить массовую долю (%) Na3 Al F6 в криолите. Ответ: 73,62%.
Навеску удобрения массой 2,634 г растворили в хлороводородной кислоте и разбавили до 250,0 мл. В 50,00 мл этого раствора осадили Mg NH4PO4 и прокалили осадок до Mg2 P2O7, масса которого оказалась равной 0,3062г. Вычислить массовую долю (%)P2O5 во влажном и абсолютно сухом удобрении, если содержание влаги в образце 8,50%. Ответ: 37,07%.;40,51%.
Навеску сильвинита массой 5,000г растворили в мерной колбе вместимостью 500,0 мл. Из 10,00 мл этого раствора получили0,1948 г тетрафенилбората калия KB(C6H5)4. Вычислить массовую долю (%) KCl во влажном и абсолютно сухом сильвините, если содержание влаги в образце 2,50%.Ответ: 40,53%; 41,57%.
Вычислить массовую долю (%) Na2SO4 и NaCl в техническом сульфате натрия, если из навески образца массой 0,3500г было получено 0,5032 г BaSO4 и 0,0131 г AgCl. Пересчитать массовую долю (%) Na2SO4 и NaCl на абсолютно сухое вещество, если влажность продукта 10,98%. Ответ: 87,50%; 1,53%.
При определении фосфора навеску органического соединения массой 0,4000г озолили и золу растворили в колбе вместимостью 200,0 мл. Из 20,00 мл полученного раствора осадили (NH4)3PO4 ·12MoO3.Масса высушенного осадка составила 0,1982гю Вычислить массовую долю (%) Р в анализируемом веществе. Ответ: 8,17%.
Для определения салициловой кислоты навеску фармацевтического препарата массой 0,2102 г перевели в раствор Na2CO3, добавили иод и осадили тетраиодфениленхинон (C6H2I2O)2.Масса полученного осадка составила 0,5175г. Вычислить массовую долю (%) салициловой кислоты С6Н4(ОН)СООН в препарате. Ответ: 98,93%.
Пробу глазной мази массой 1,5318 г. , содержащей хлоромицетин (С11Н12 O2 N2Cl2), нагрели в запаянной ампуле с металлическим натрием. После соответствующей подготовки пробы осадили хлорид- ионы в виде AgCl. Масса гравиметрической формы равна 0,01918 г.Рассчитайте массовую долю (%) хлоромицетина в пробе. Ответ: 1,20%.
Из навески стали массой 1,000г получили осадок SiO2 и WO3 общей массой 0,1021г. После обработки осадка НF и удаления SiO2 масса остатка WO3 составила 0,0712г. Вычислить массовые доли (%) Si иW в стали Ответ: 1,44%; 5,65%.
Вычислитьэмпирическую формулу минерала, содержащегоCu, Fe, S,еслив результате анализа из навески образца массой 0,3500 г было получено 0,1392г СuO; 0,1397 г Fе2О3; 0,8169 г ВаSО4.Ответ: CuFeS2
Вычислить формулу оксида железа, из которого состоит руда, если в результате анализа получили массовую долю Fe2O3 103,45%. Избыток 3,45% обусловлен тем, что исследуемая руда имеет другой состав. Ответ: Fe3O4.
Из навески оксида меди массой 0,1200г получили осадок оксихинолината меди Cu(C9H6ON)2 массой 0,5901 г. Вычислить эмпирическую формулу оксида меди. Ответ: Cu2O
В образце лунного грунта обнаружен минерал, содержащий 16,2% Са, 22,5% Fe, 22,6% Si, 38,7% О.Вычислить эмпирическую формулу этого минерала. Ответ: Ca Fe Si2 O6
Вычислить число молекул воды(х) в молекулах кристаллогидратов солей, указанных в таблице, если из навески кристаллогидрата массой m1 (г)получили m2 (г)гравиметрической формы
Вариант
|
Соль
|
m1(г)
|
Гравиметрическая форма
|
m2 (г)
|
1
2
3
4
5
6
7
8
9
10
|
BaCl2 ·xH2O
MgSO4 ·xH2O
Al2(SO4)3 ·H2O
CoSO4 ·x H2O
Cr2(SO4)3 ·xH2O
NH4Fe(SO4)2·xH2O
MnSO4 ·xH2O
CaCl2 ·xH2O
Na2SO4 ·xH2O
Ni(NO3)2 ·xH2O
|
0,3245
0,5520
0,7000
0,4800
0,8500
0,5020
0,3240
1,0000
0,4000
0,3000
|
BaSO4
Mg2P2O7
Al2O3
BaSO4
Cr2O3
Fe2O3
BaSO4
CaO
BaSO4
Ni(C4H7O2N2)2
|
0,3100
0,2492
0,1070
0,3985
0,1803
0,0831
0,3137
0,2560
0,3262
0,2980
|
Ответы: 1,2; 2,7;3,18;4,7;5,18;6,12;7,5;8,6;9,8;10,6
В. Расчет количества осадителя
Вычислить объем раствора серной кислоты с массовой долей 4% необходимый для осаждения бария из навески 0,3025 г. BaCl2· H2O.Ответ: 3,04 см3.
Рассчитать обьем осадителя в виде 0,05М раствора Na2HPO4 для осаждения магния в виде MgNH4PO4 из 100 см3 0,02М раствора MgCl2 с использованием осадителя до 120%.Ответ: 48 см3.
Какой объем раствора карбоната натрия (массовая доля 17,7%, ρ=1,19) требуется дл осаждения 0,2 г. кальция при полуторакратном избытке осадителя? Ответ: 3,77 см3.
Сколько мл. 1,2%-го раствора диметилглиоксима C6H8N2O2 (ρ=1) требуется для осаждения Ni2+ из раствора, содержащего 150 мг. NiCl2 (избыток осадителя 1,5%)? Ответ: 23,5 мл.
Сколько нужно раствора аммиака с массовой долей 2% для осаждения алюминия из раствора, в котором растворено 0,9556 г. алюмокалиевых квасцов? Ответ: 0,6 см3.
Сколько граммов раствора серной кислоты с массовой долей 5% для осаждения свинца из навески 0,5865 г. сплава с массовой долей свинца 12%? Ответ: 0,664 г.
Вычислить объем серной кислоты с массовой долей 10% для осаждения свинца из раствора, полученного растворением навески сплава 0,6856 г. с массовой долей свинца 15%.Ответ: 0,5 см3.
Вычислить обьем раствора Na2HPO4 с массовой долей 4% для осаждения магния в виде MgNHPO4 из раствора, содержащего 0,5228 г. MgSO4 · 7H2O.Ответ: 7,54 см3.
Пробу массой 0,5625 г. , содержащей 10,0% BaO, растворили в кислоте. Сколько граммов диэтилсульфата (C2H5) SO4, учитывая 30% -ный избыток, нужно взять для гомогенного осаждения бария в виде BaSO4.Ответ: 0,0734 г.
Пробу глазной мази массой 1,5318 г. , содержащей хлоромицетин (С11Н12·O2 N2Cl2), нагрели в запаянной ампуле с металлическим натрием. После соответствующей подготовки пробы осадили хлорид- ионы в виде AgCl. Масса гравиметрической формы равна 0,01918 г.Рассчитайте массовую долю (%) хлоромицетина в пробе. Ответ: 1,20%.
Вычислить объем раствора нитрата серебра с массовой долей 3,4% для осаждения хлорида из 200 см3раствора раствора NaCl с молярной концентрацией 0,01. Ответ: 10 см3.
Какой объем серной кислоты плотностью1,1 г/см3 требуется для осаждения бария из раствора 0,4880 г BaCl2 ∙ 2H2O.Ответ: 1,2см3.
Сколько нужно раствора аммиака с массовой долей 4% для осаждения железа из навески 0,6076 г железоаммонийных квасцов? Ответ: 1,6 см3.
Вычислить объем раствора оксалата аммония с массовой долей 2,5% для осаждения кальция из 200 см3 раствора с молярной концентрацией CaCl2 0,05 М, чтобы при осаждении был создан избыток осадителя в 20%. Ответ: 60, 15см3.
Вычислить объем раствора нитрата серебра с массовой долей 2% для осаждения брома из 100см3 0,01 М КВr. Ответ: 8,5 см3.
|
 Скачать 0.79 Mb.
Скачать 0.79 Mb.
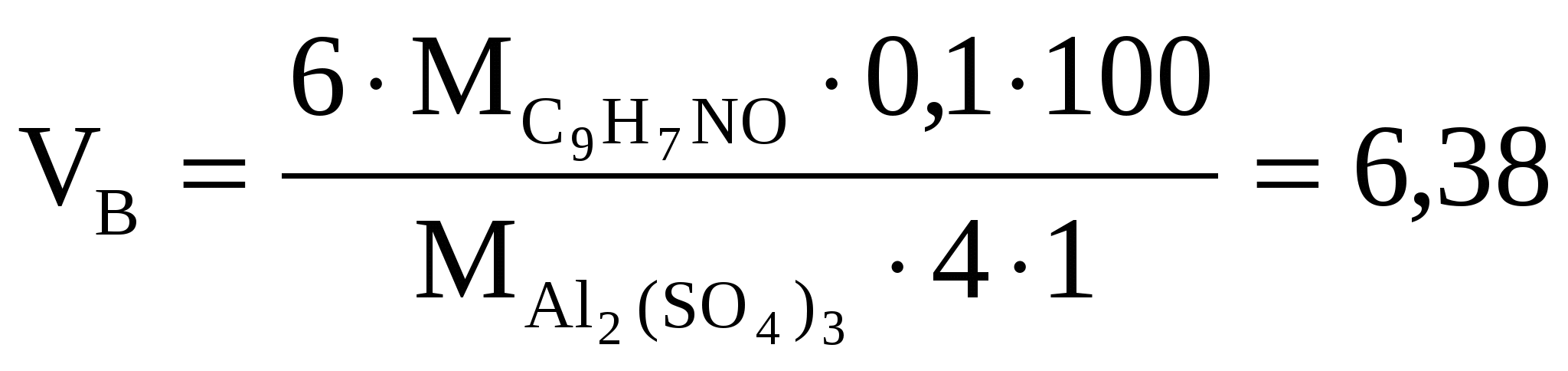 мл
мл