Пример 2
Навеску хлорида аммония обработали избытком щелочи. Выделившийся аммиак поглотил 50 мл 0,5120М HCl и раствор разбавили до 250 мл. На титрование 50 мл полученного раствора израсходовали 23,73 мл 0,05М КОН (К = 0,9740). Вычислить массу NH3, которая содержалась в хлориде аммония.
Решение
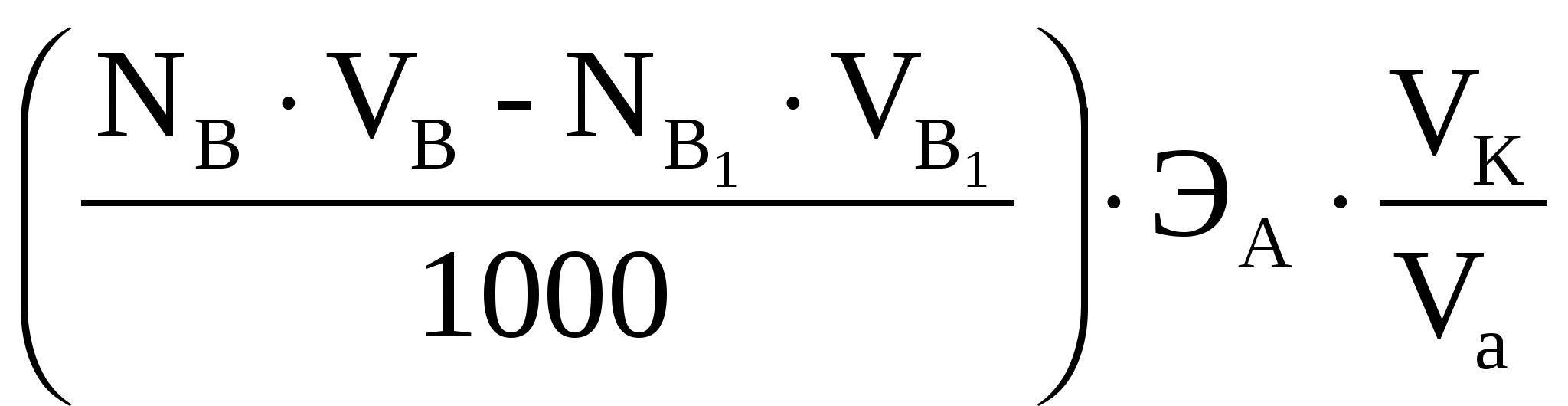
Итак, количество HCl в исходном растворе кислоты составляе
n = = 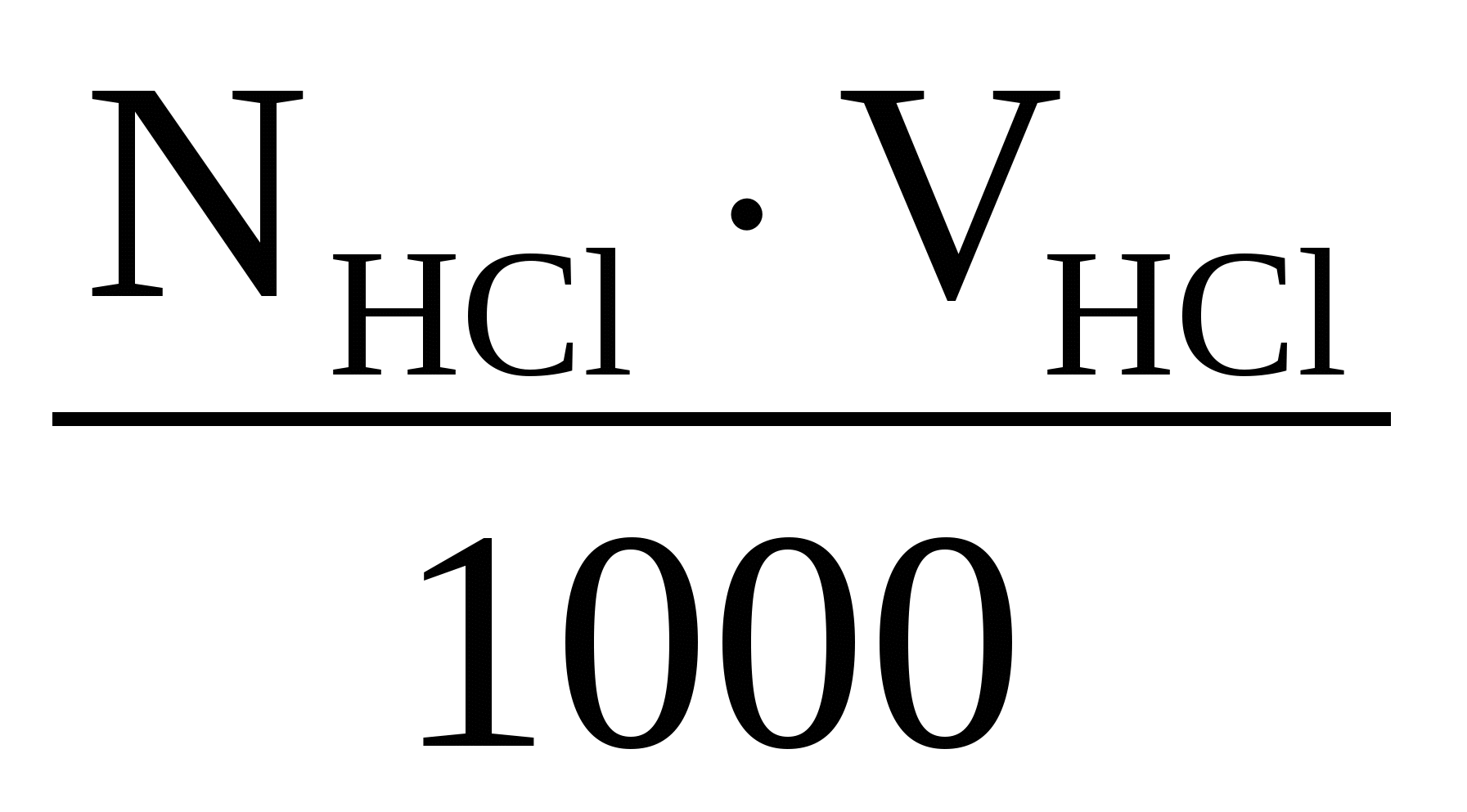
С учетом разбавления до 250 мл
n = = 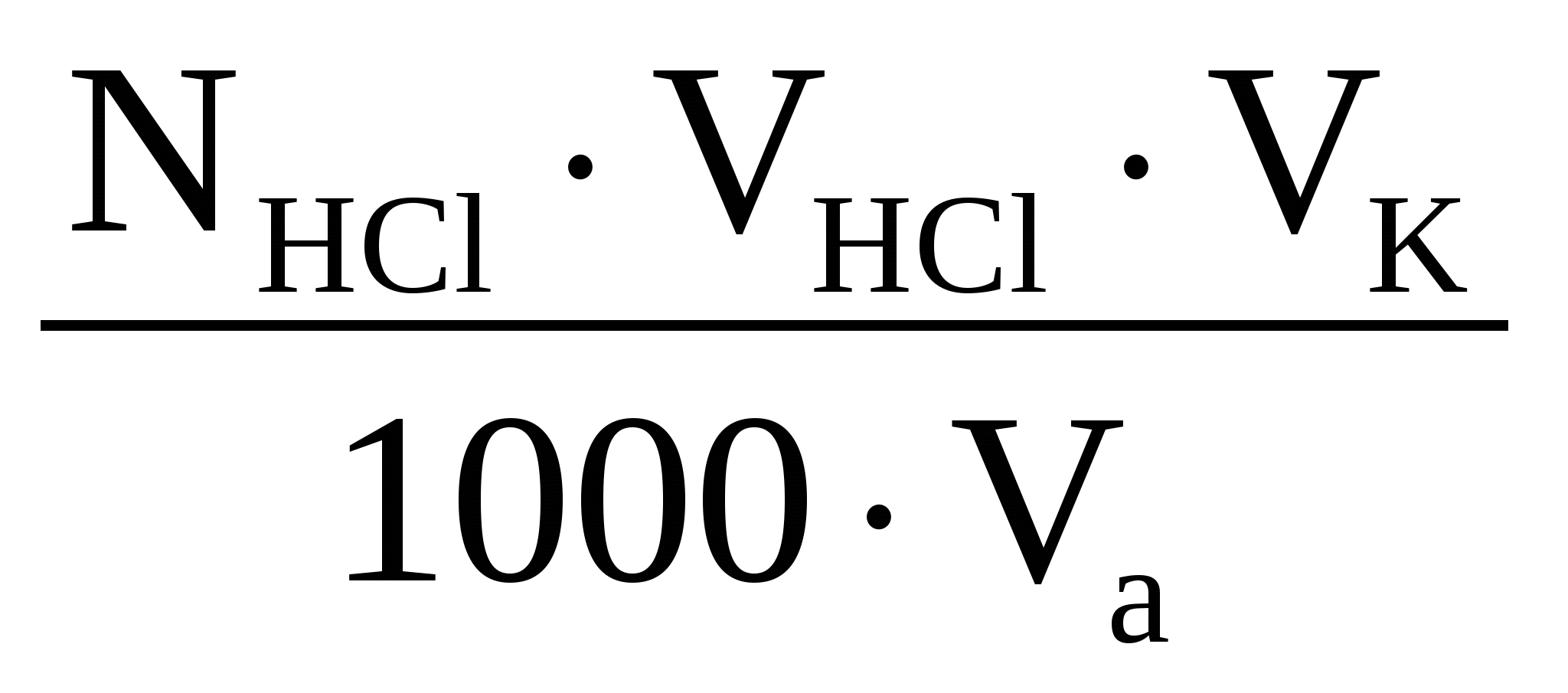
Количество КОН, пошедшего на титрование HCl, взятого в избытке
n = = 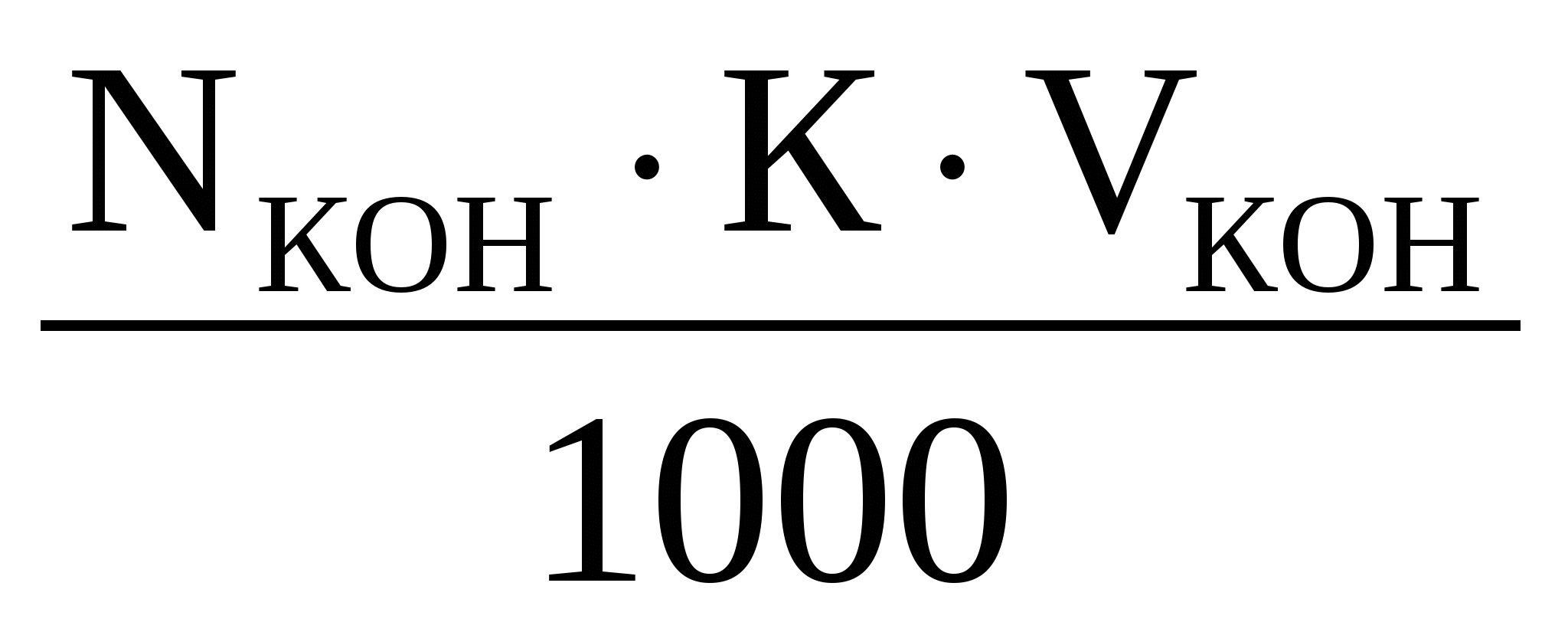
Количество аммиака считаем: n = n = n – n – n
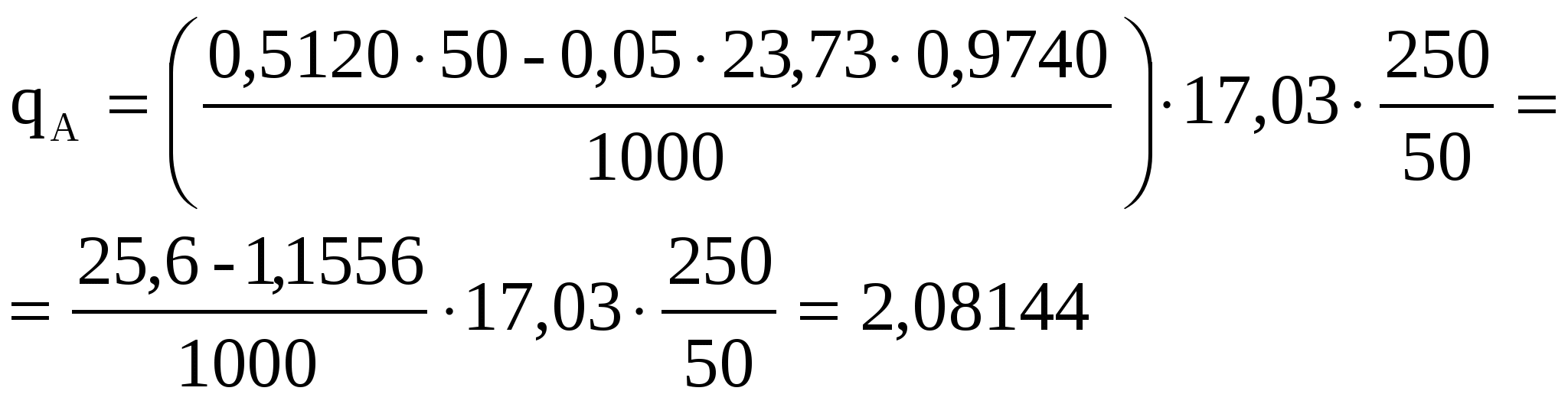
Пример 3
Чему должен быть равен титр раствора К2Сr2О7, чтобы 1 мл его, израсходованный на титрование FeCl2, полученного из навески руды 0,2 г соответствовал точно 0,5% железа.
Решение
6Fe2++ Сr2О72- +14H+ → 6Fe3++ 2Сr3+ +7H2O
% = 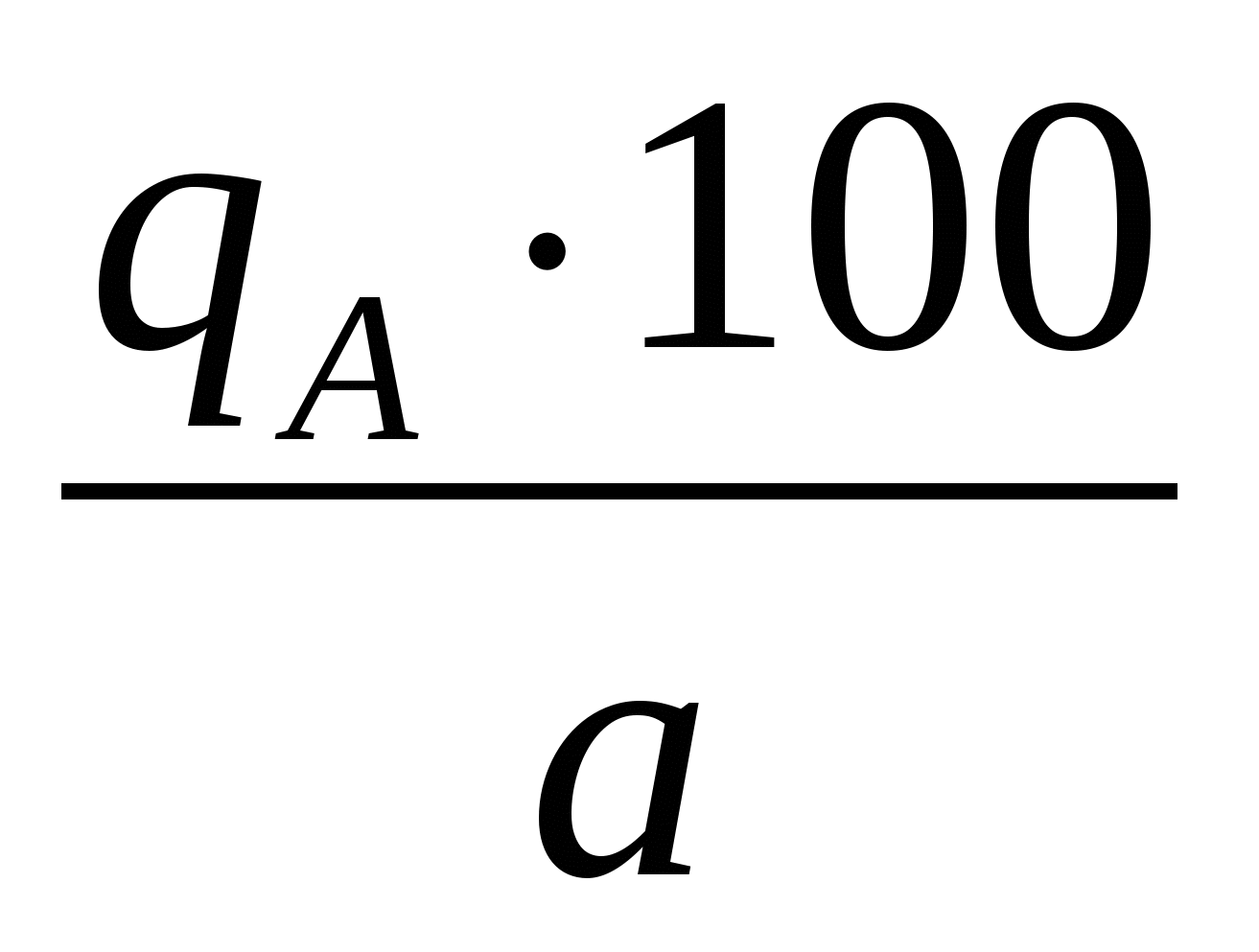
q = 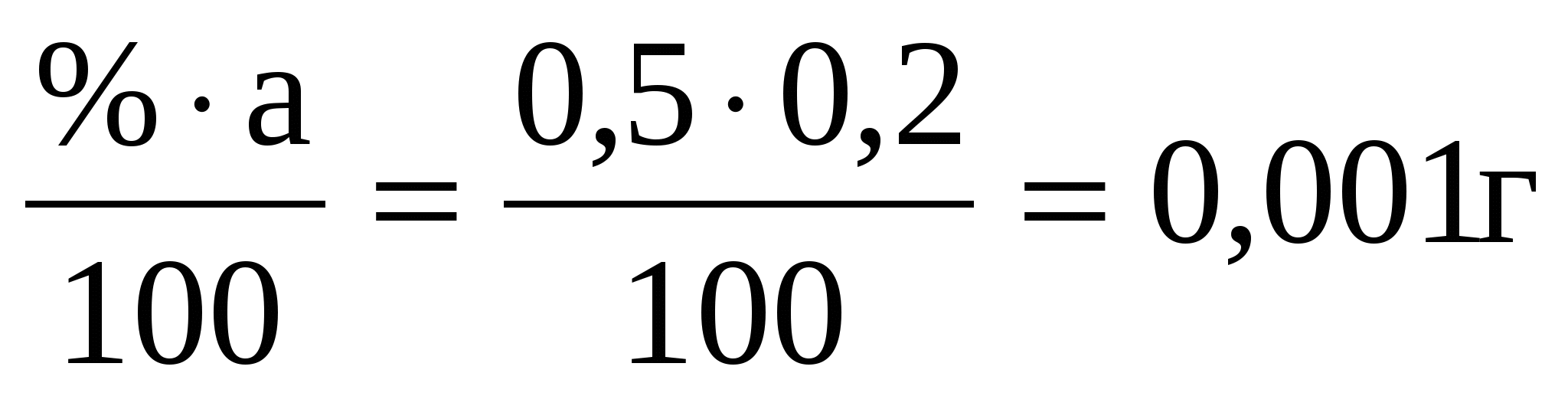
1 мл К2Сr2О7 титрует 0,001 г Fe, т.е. это
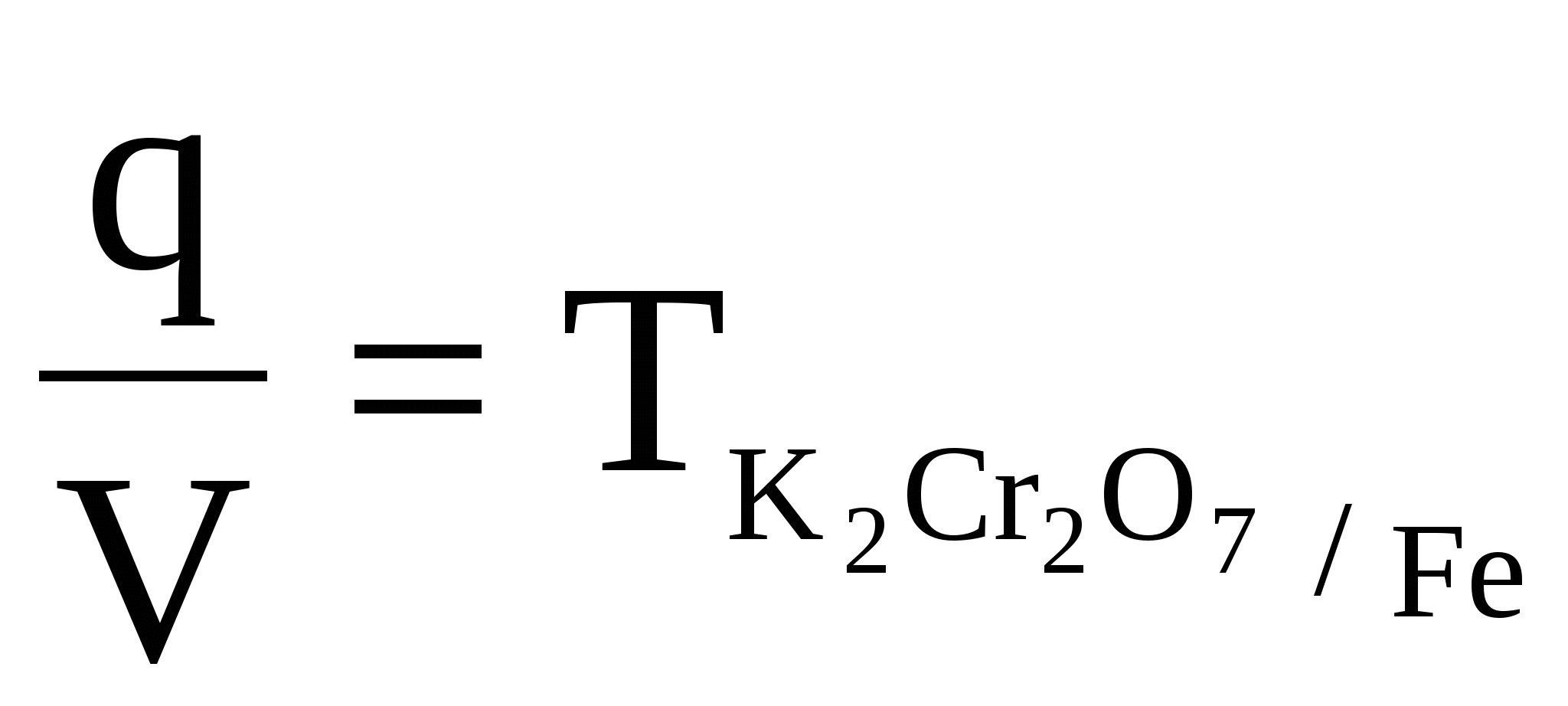
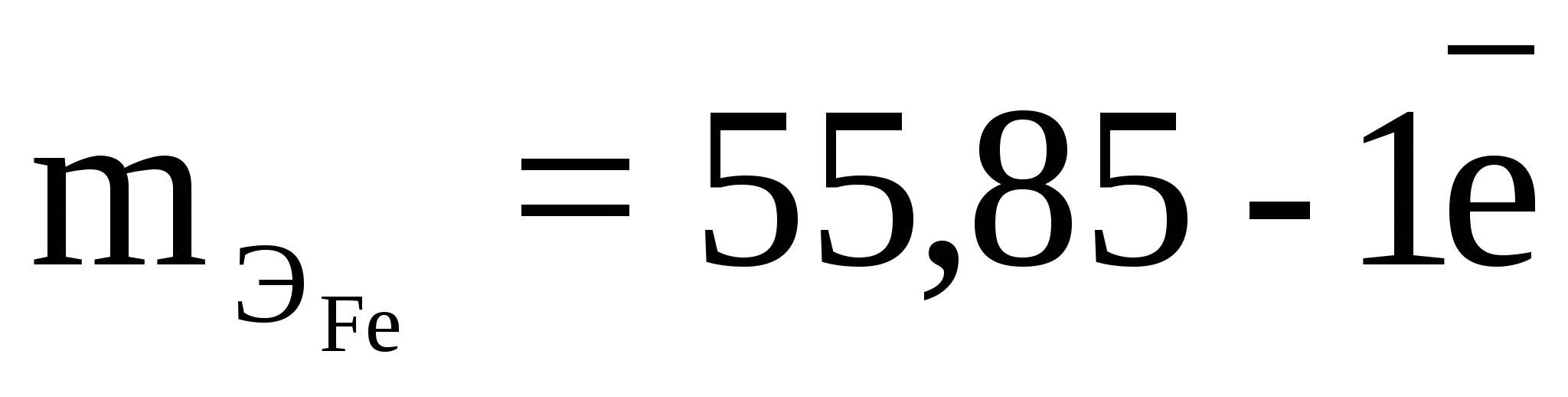
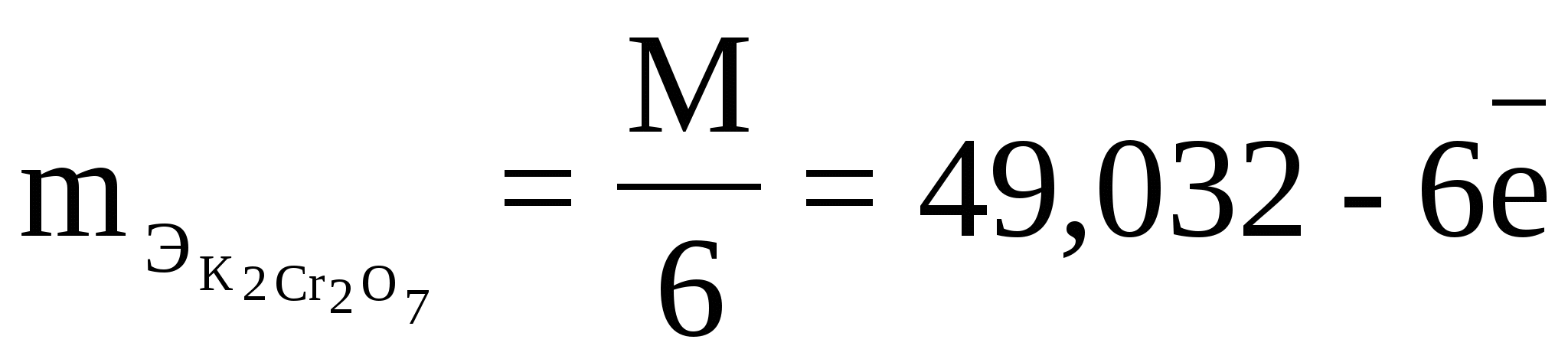 - два атома Cr по 3 - два атома Cr по 3
ТВ/А=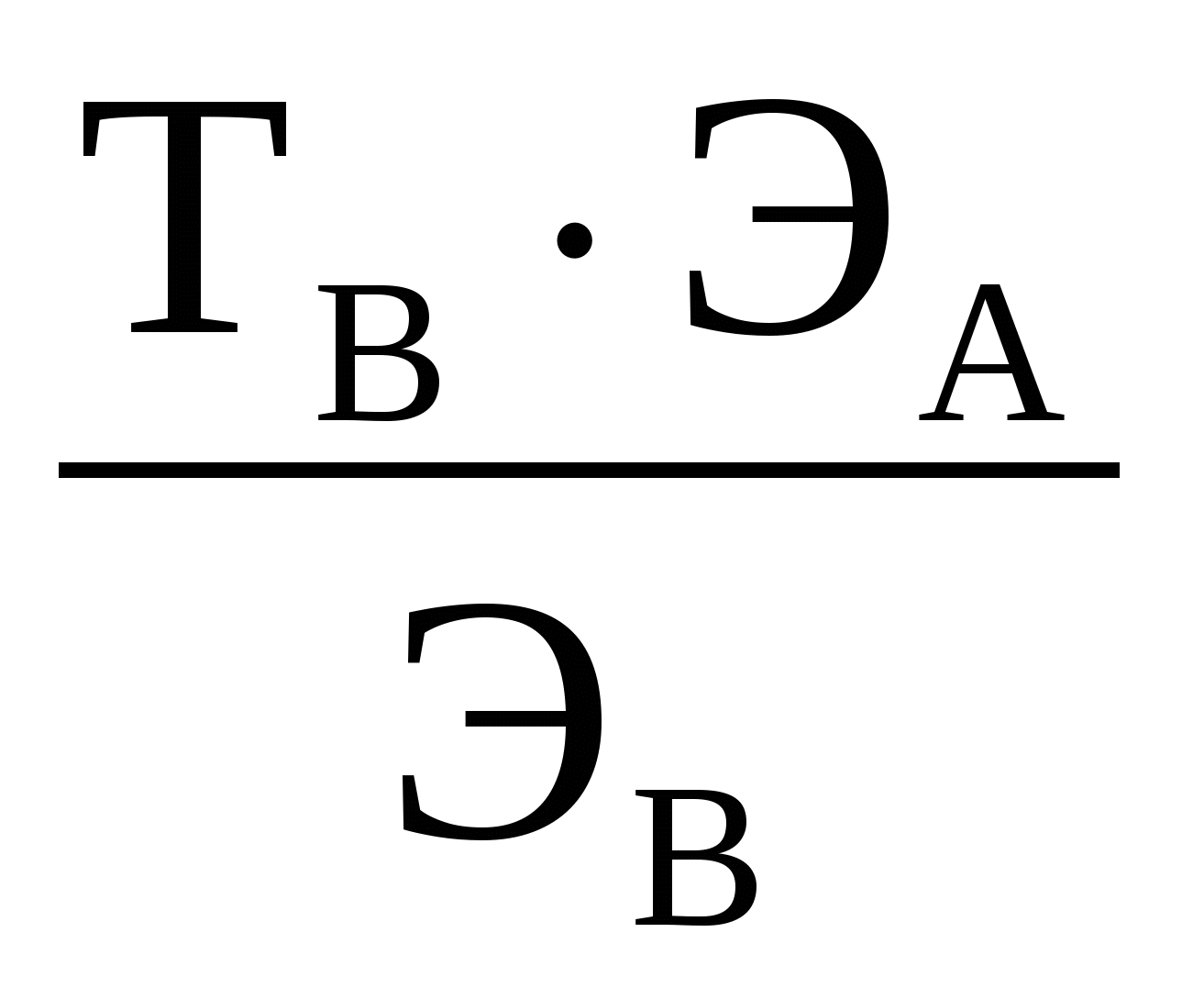
ТВ=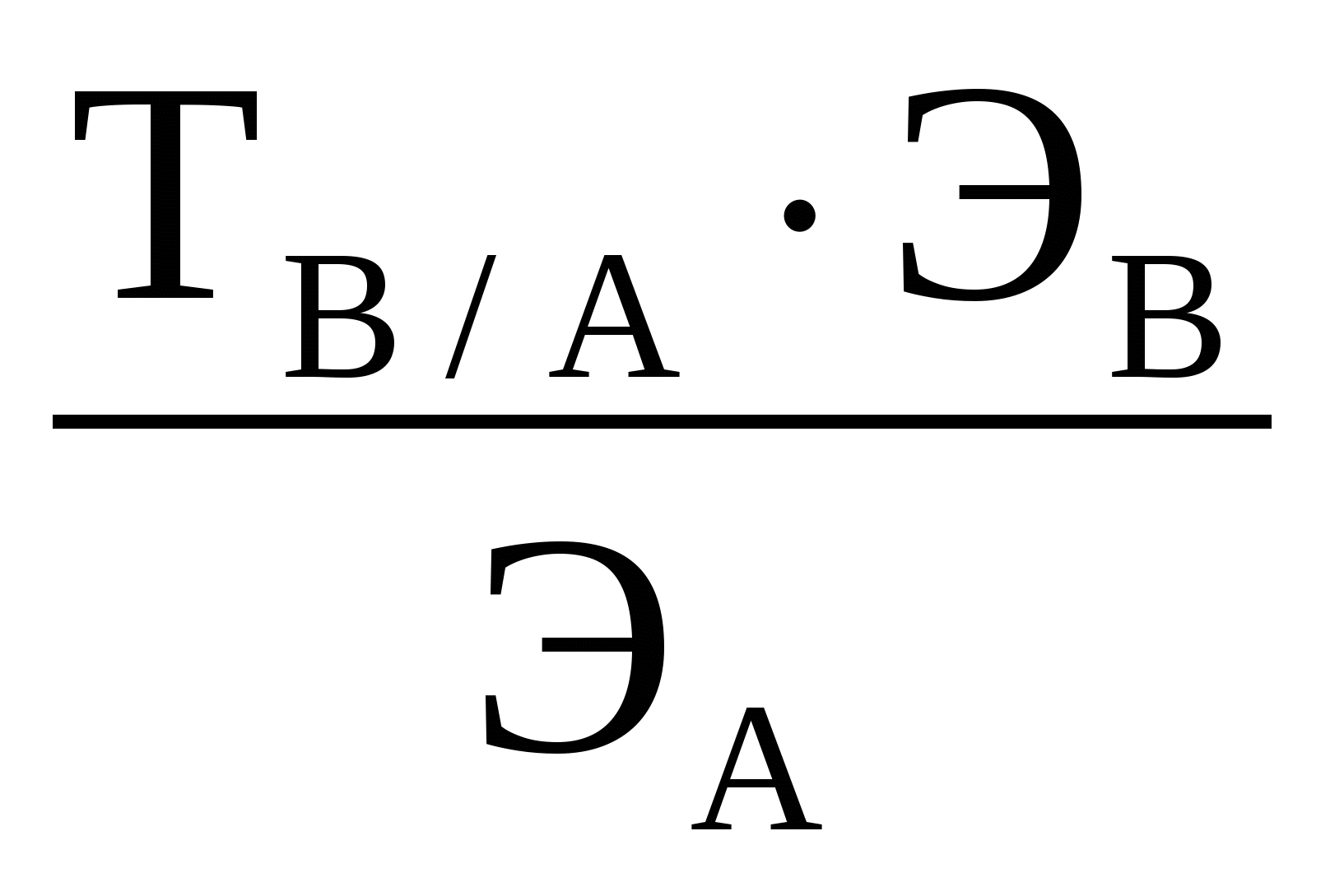
Подставляем числовые значения
ТВ=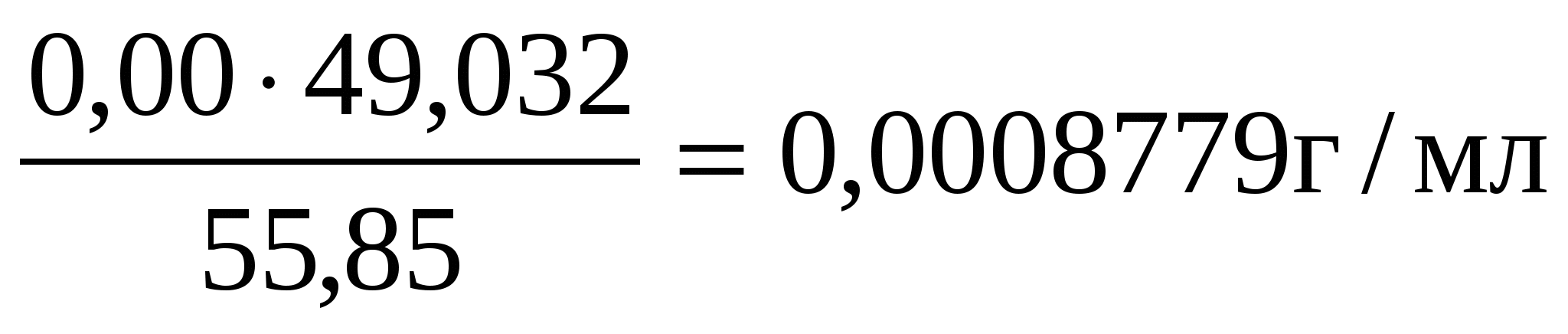
Пример 4
Для определения свободного Р2О5 в суперфосфате, содержащуюся в водном растворе его Н3РО4 титруют NaOH, причем образуется NaH2PO4. Чему равен Т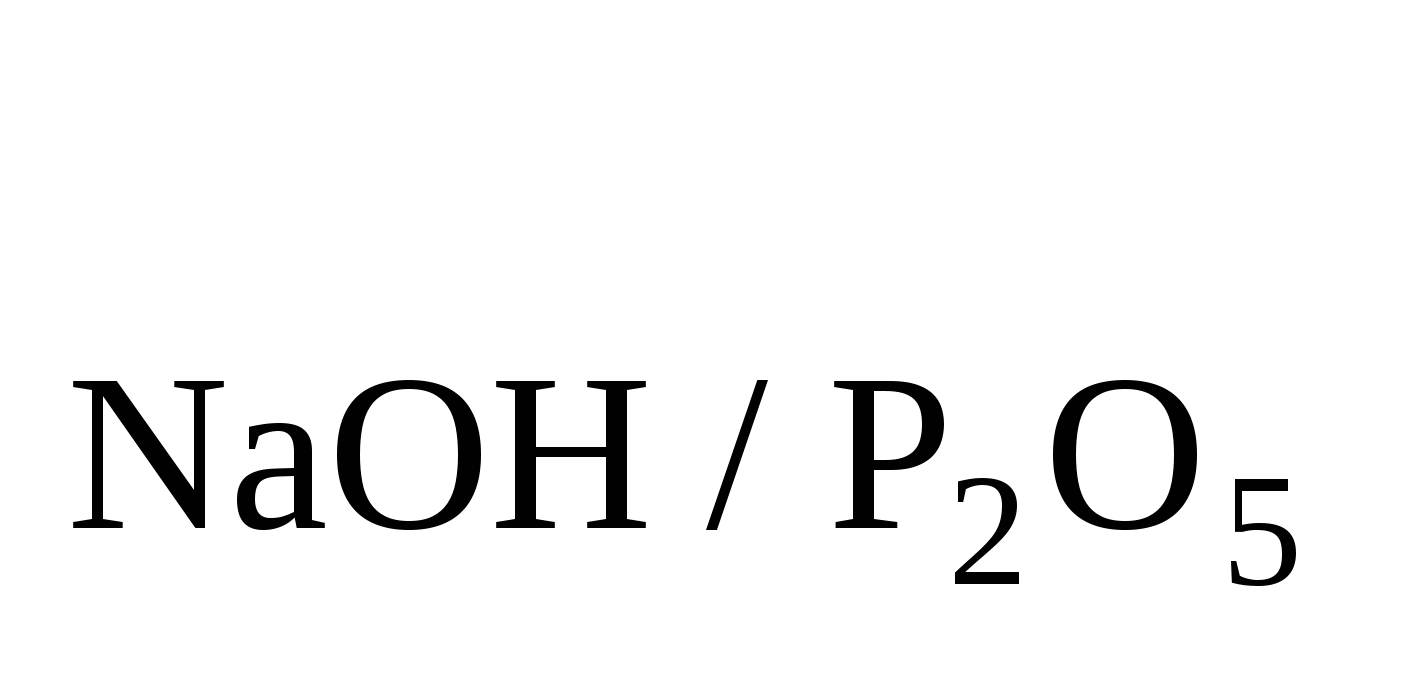 , если на 0,1035г Н2С2О4 расходуется 25,15 мл данного раствора NaOH? , если на 0,1035г Н2С2О4 расходуется 25,15 мл данного раствора NaOH?
Решение
Н3РО4 + NaOH = NaH2РO4+НОН
2Н3РО4 =Р2О5 + 3Н2О
fэкв (Р2О5)=1/2
Р2О5 + 3Н2О = 2Н3РО4
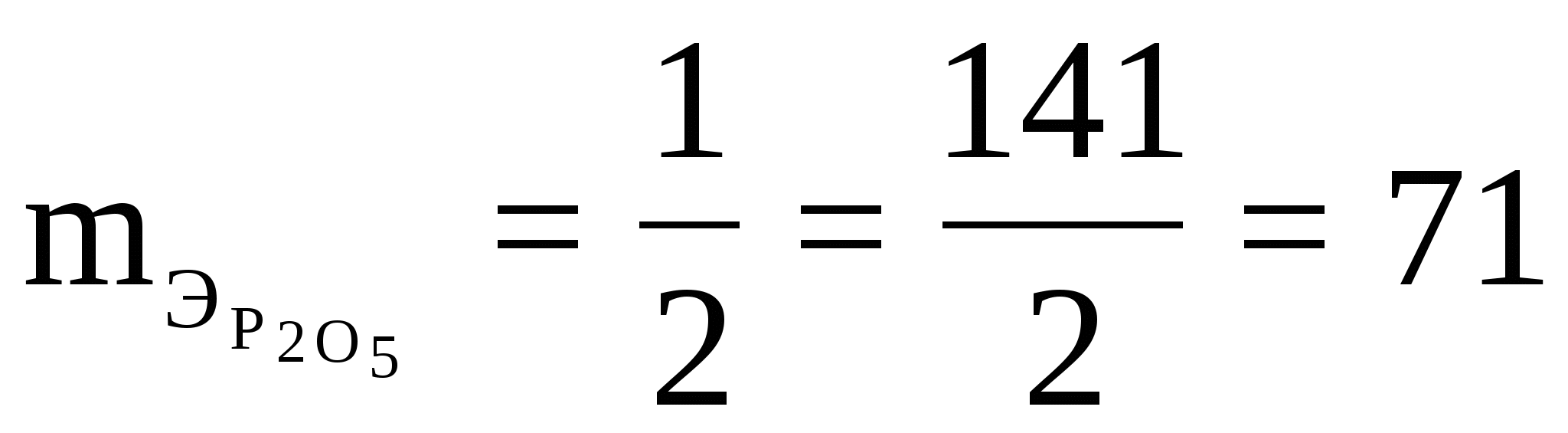
25,15 мл NaOH титруют 0,1035г Н2С2О4
1 мл NaOH титрует x г Н2С2О4
х = 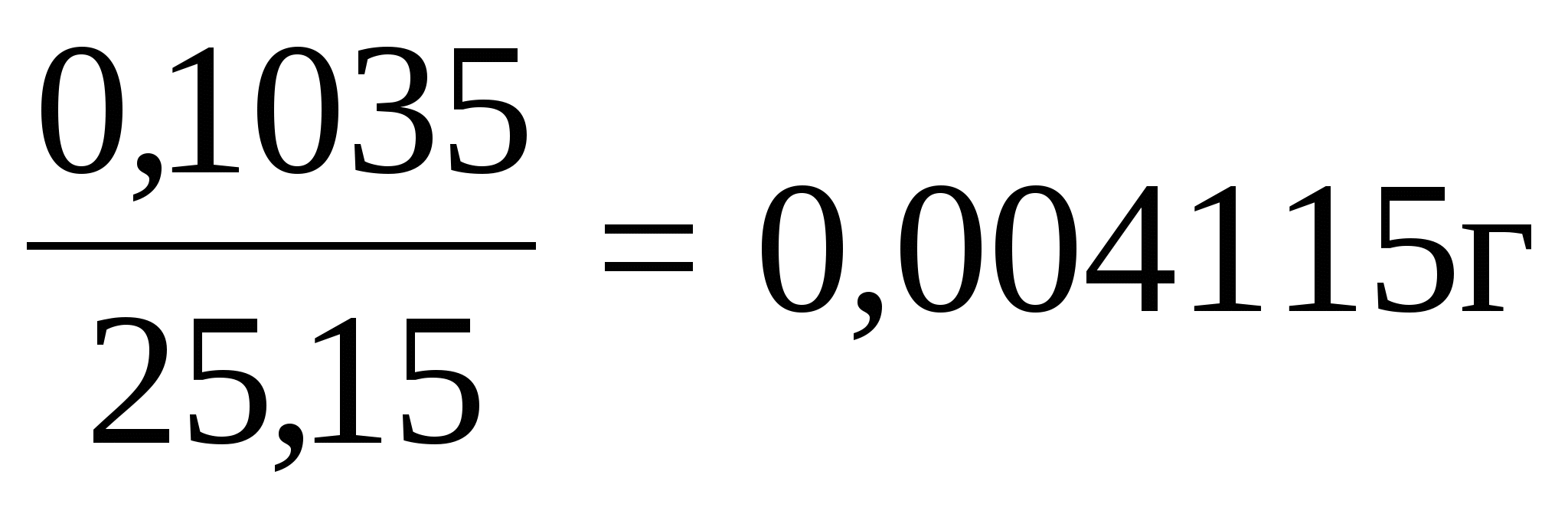
Это Т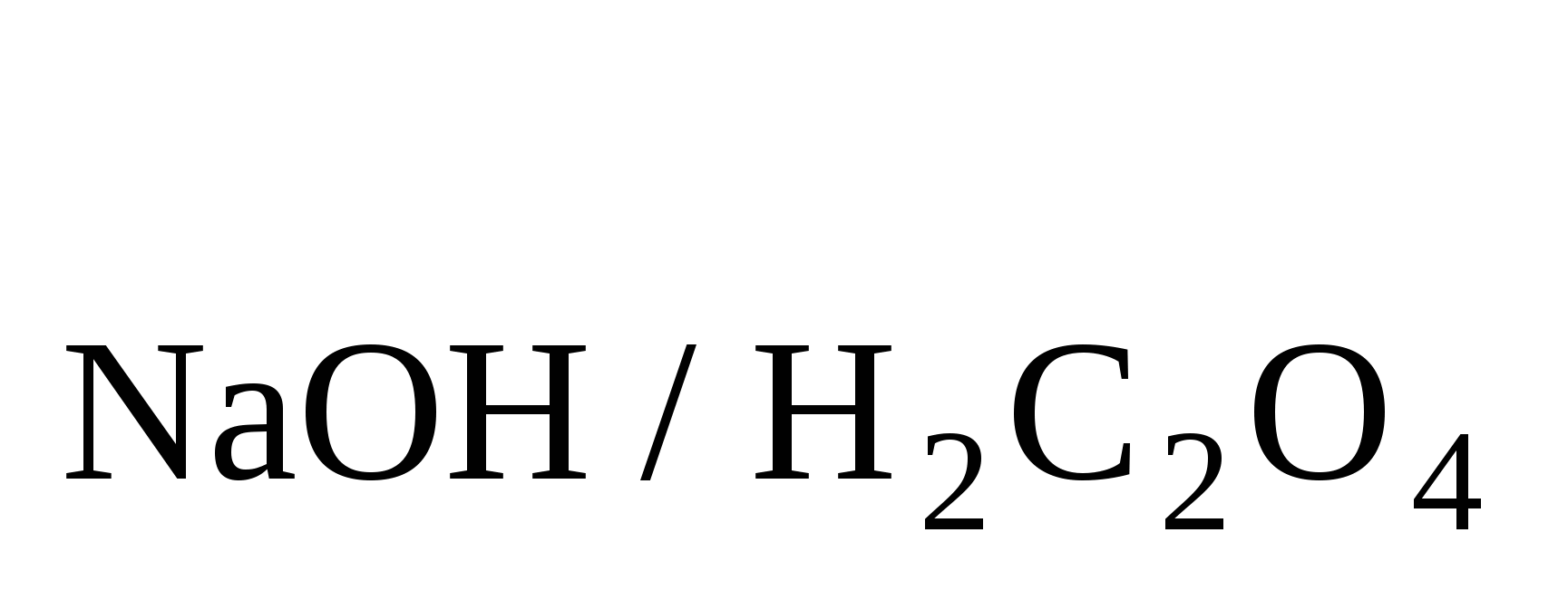 (ТВ/А) (ТВ/А)
ТВ/А=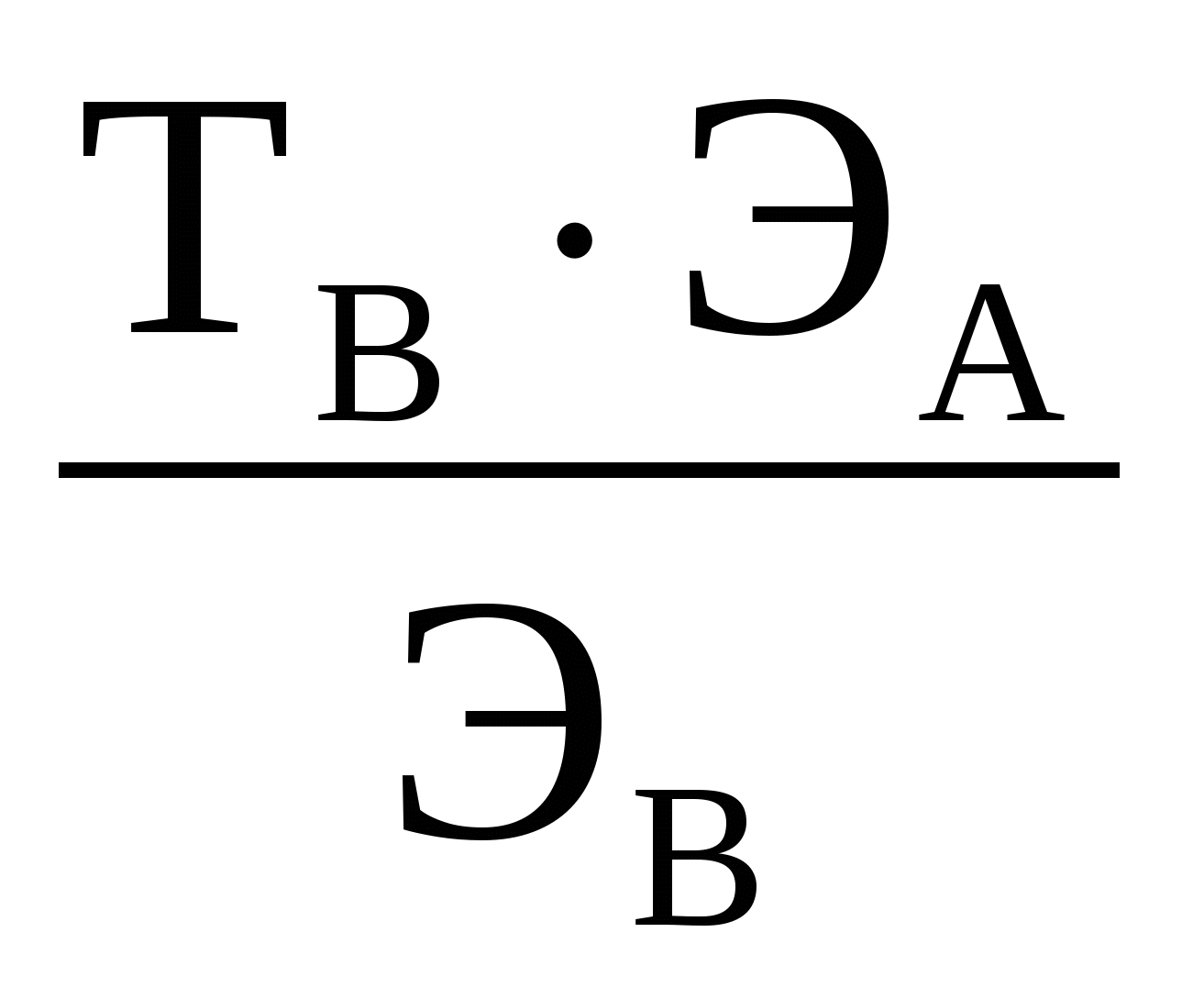
ТВ=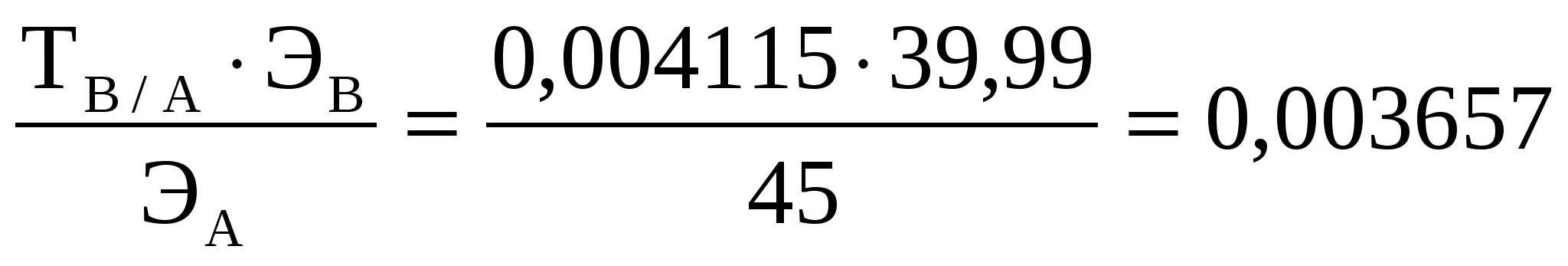 - это Т - это Т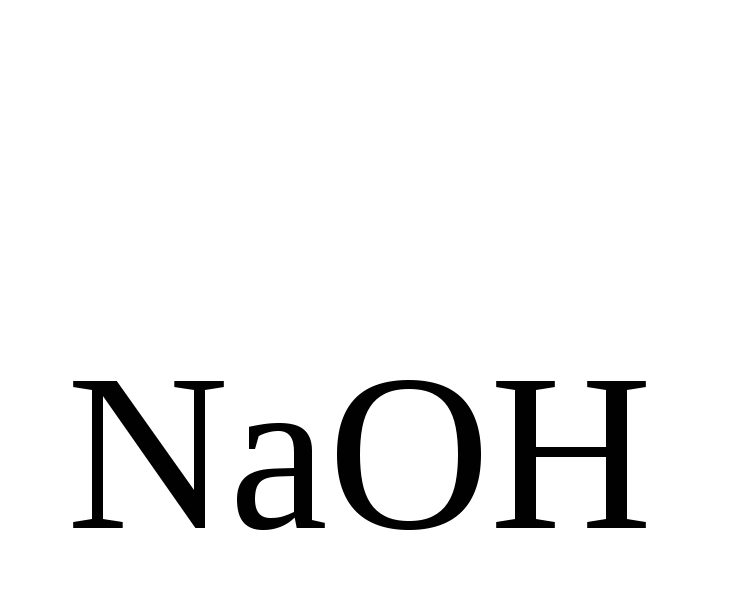
Т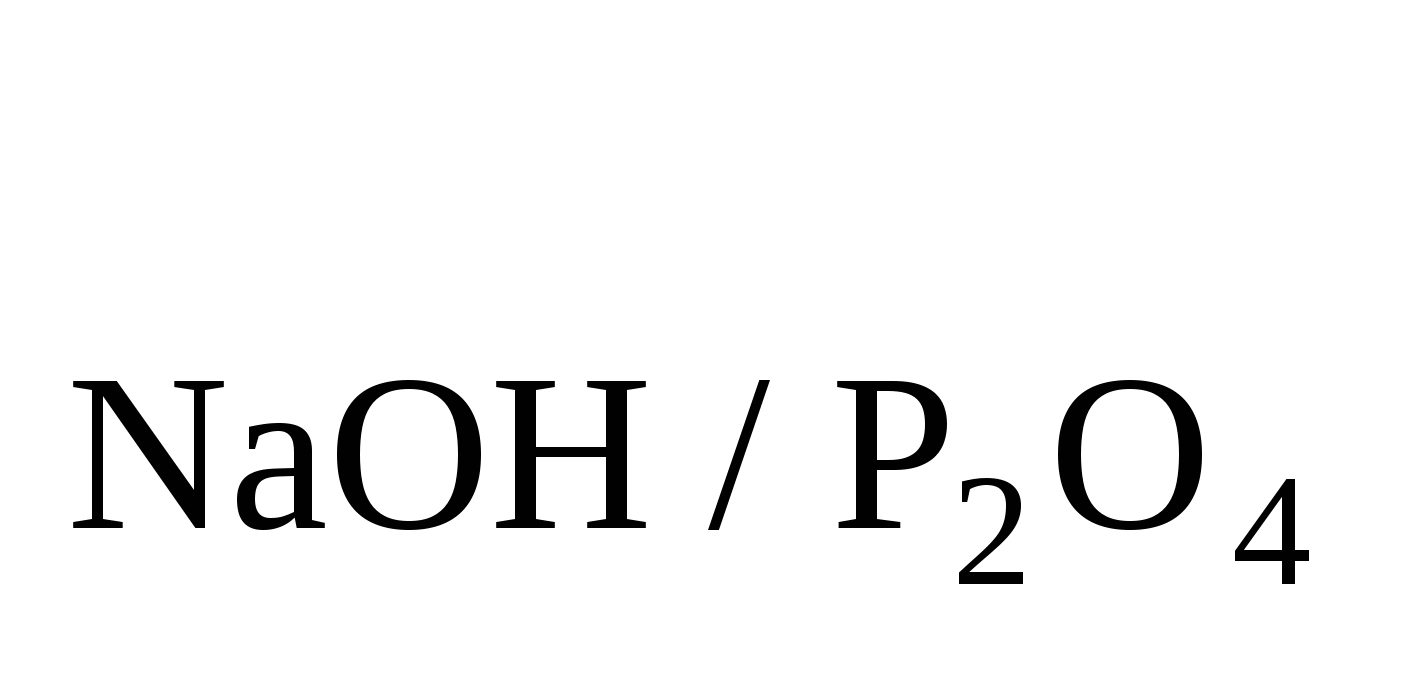 = =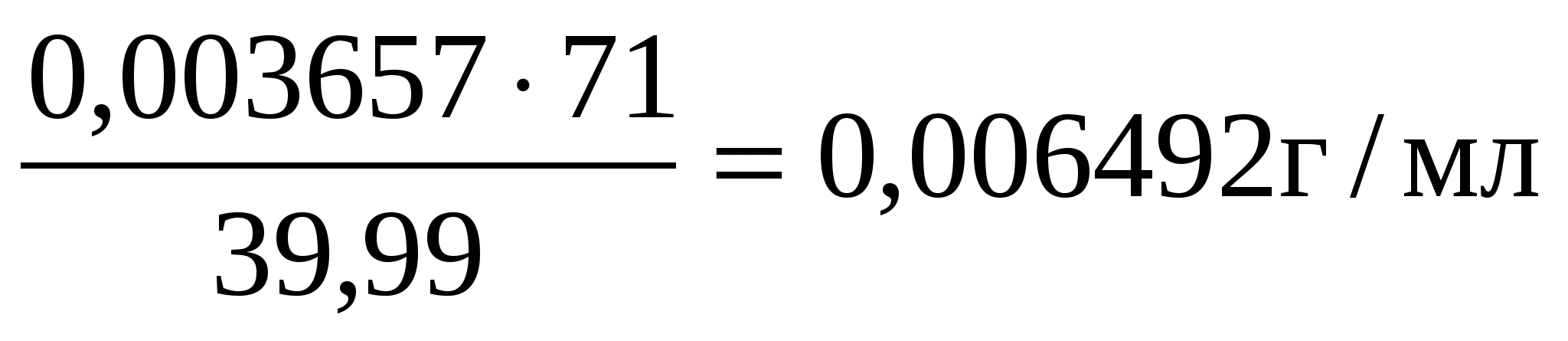
Пример 5
На титрование с фф навески массой 0,4478 г, состоящей из Na2CO3, NaHCO3 и NaCl потребовалось 18,80 мл 0,1998М раствора НCl. При титровании с мо на ту же навеску израсходовали 40,00 мл раствора кислоты. Вычислить массовую долю (%) Na2CO3 и NaHCO3 в смеси.(фф- фенолфталеин, мо- метилоранж)
Решение
При титровании смеси с фф протекает реакция
Na2CO3 + НCl = NaCl + NaHCO3
в присутствии мо
Na2CO3 + 2НCl = 2NaCl + H2О + CO2
NaHCO3 + НCl = NaCl + H2О + CO2
Следовательно, при титровании смеси в присутствии фф с раствором хлороводородной кислоты взаимодействует только один компонент смеси Na2CO3 и количество его легко определить по формуле (18)
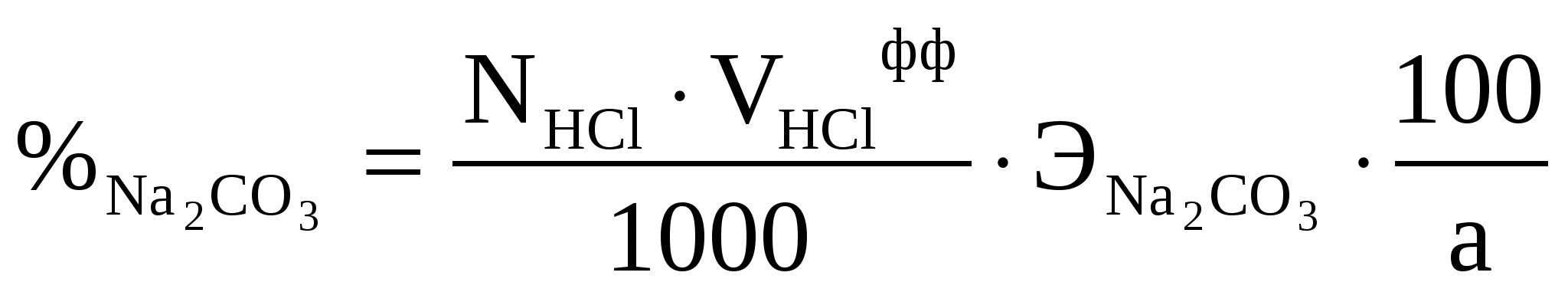
Тогда
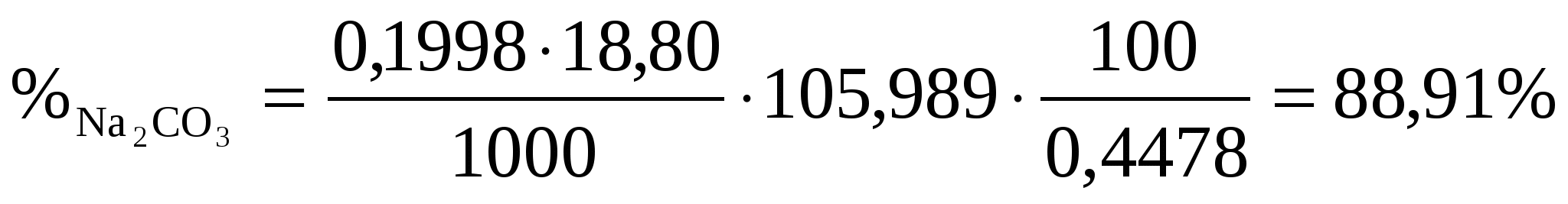
Как следует из приведенных реакций, объем раствора НCl, затраченный на титрование гидрокарбоната натрия, в присутствии мо можно представить так
VHCl MO = 2VHCl фф
Отсюда
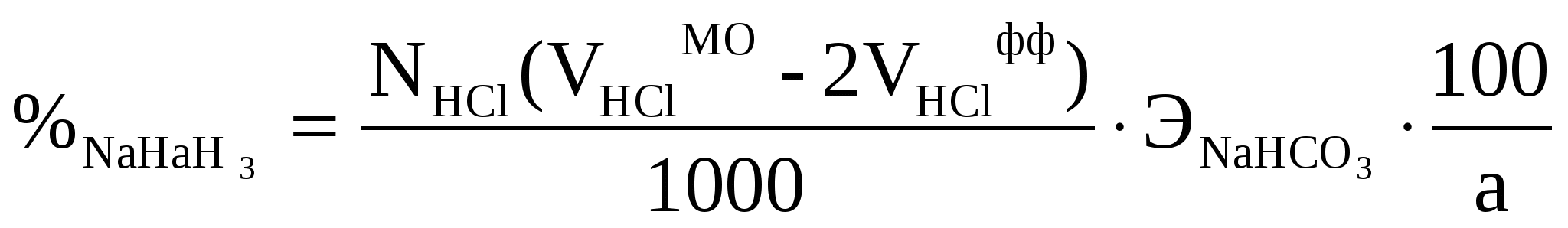
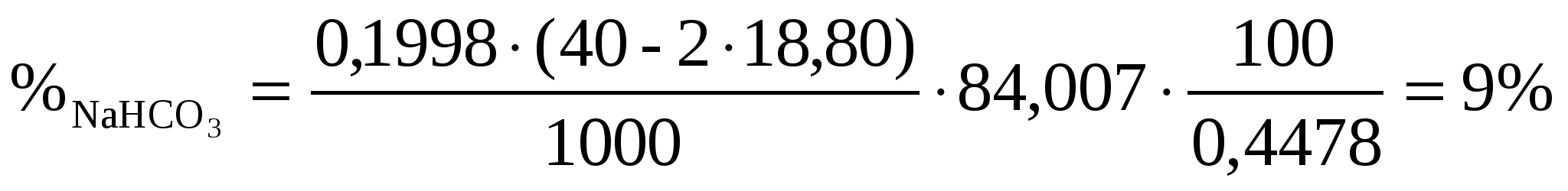
Пример 6
Для определения содержания формальдегида в пестициде навеску препарата массой 3,017 г обработали 50,00 мл 1 М раствора NaOH (K=0,9022) в присутствии пероксида водорода. При нагревании произошла реакция
НСОН + ОН- + Н2О2 = НСОО- + 2Н2О
При охлаждении избыток щелочи оттитровали 20,12 мл раствора НCl с ТНCl = 0,03798. Вычислить массовую долю (%) формальдегида в препарате пестицида.
Решение
Сущность обратного титрования отражает формула
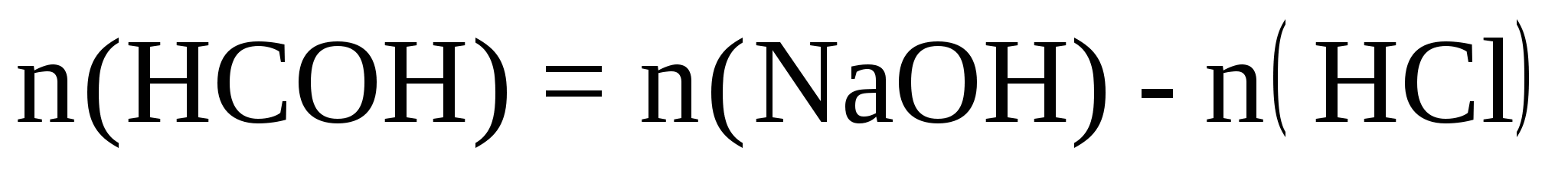
С учетом условий задачи выражаем число молей реагирующих веществ
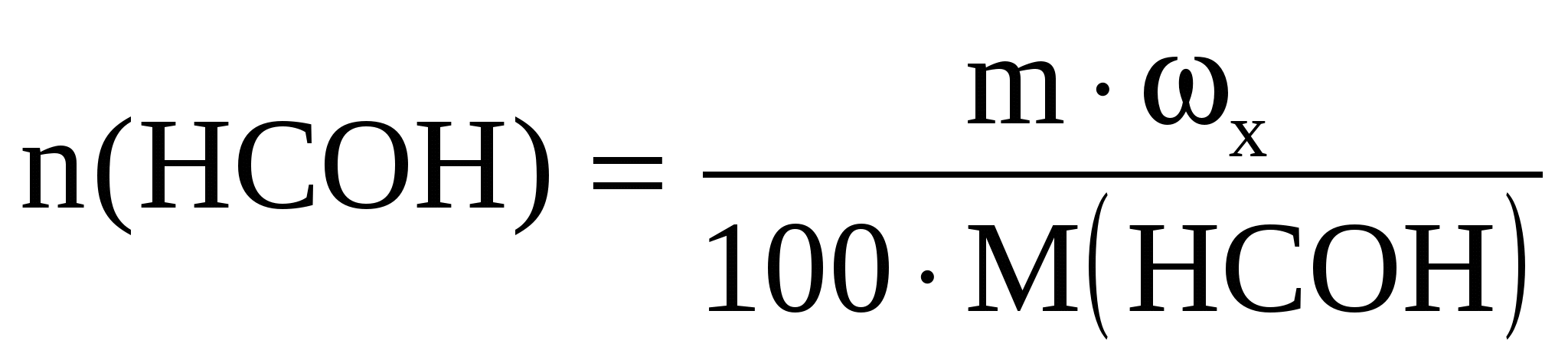

n(HCl)=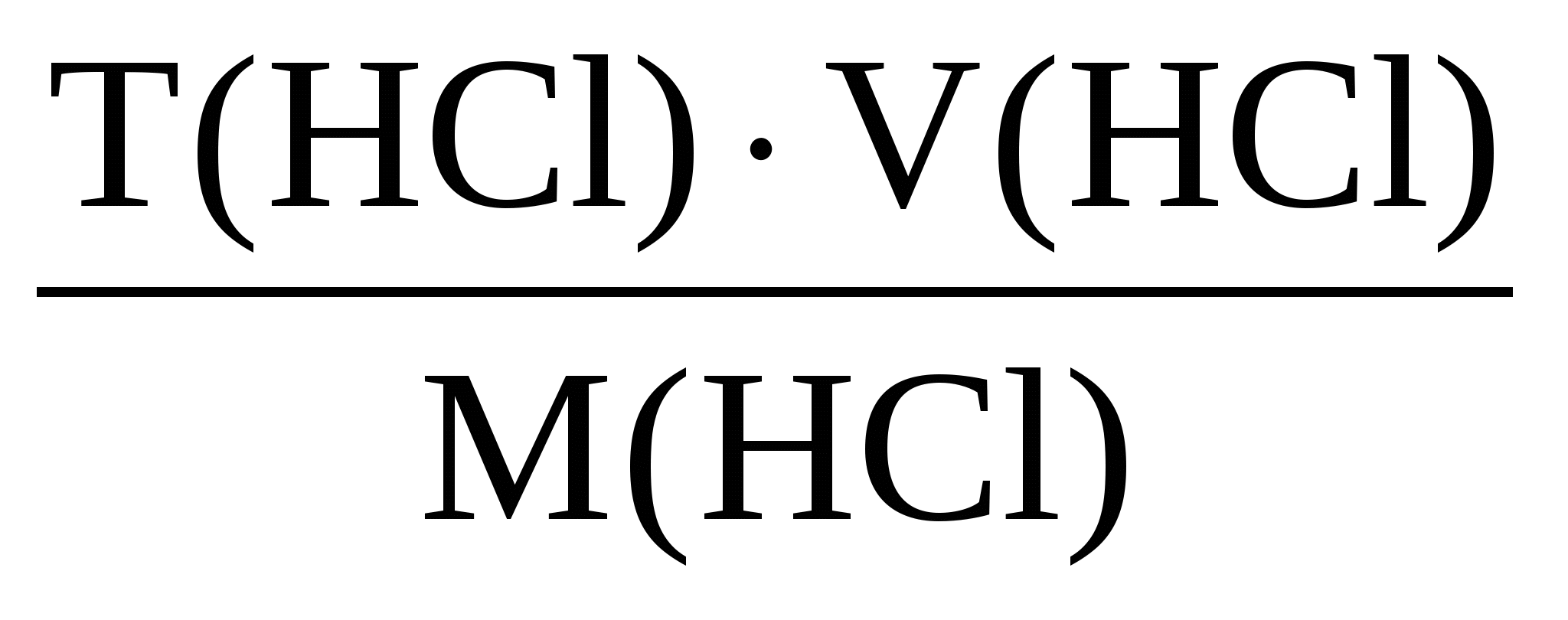
Составляем расчетное уравнение
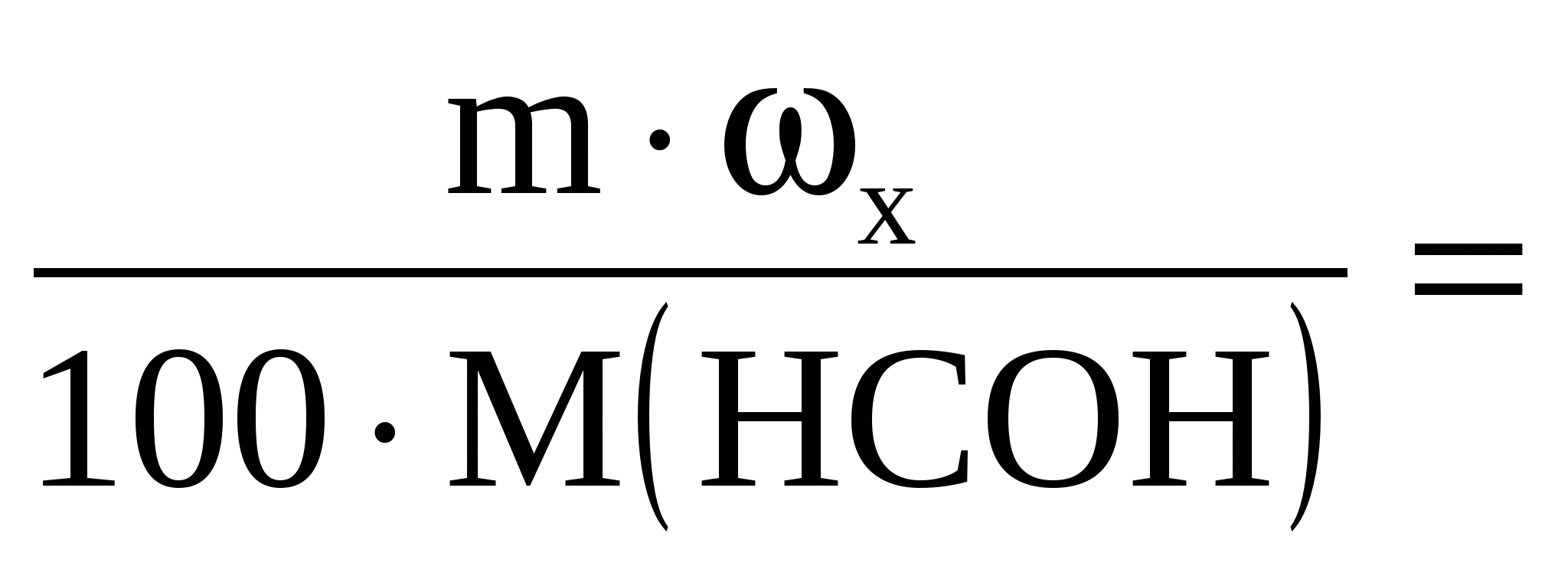 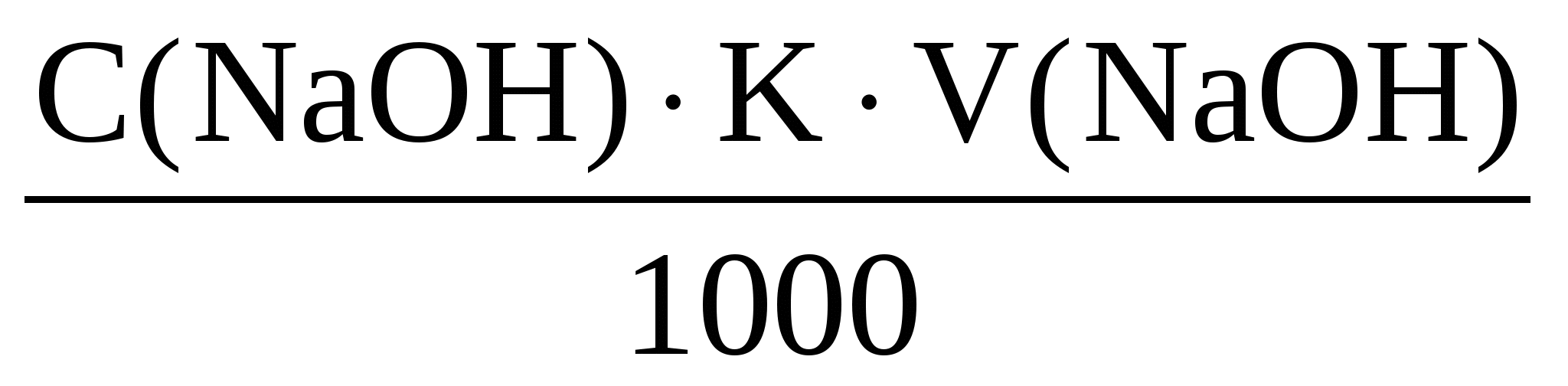 - -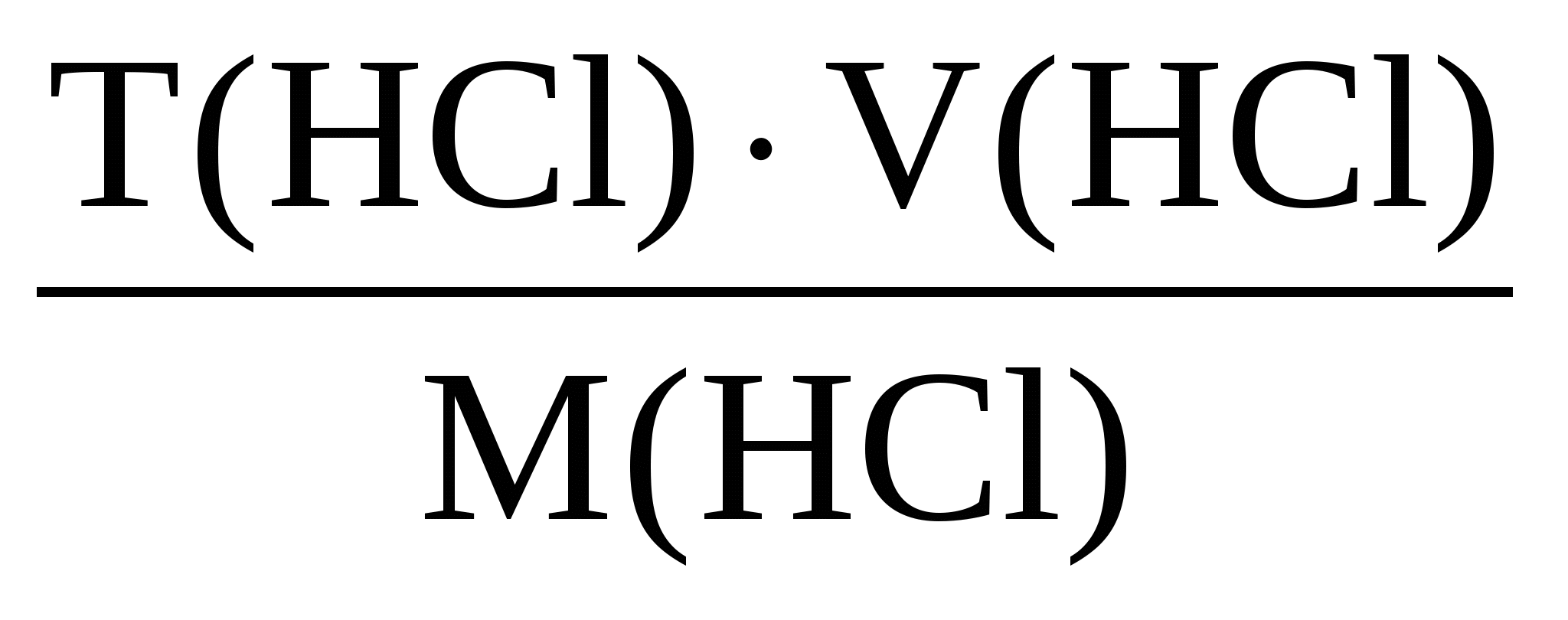
Подставив числовые выражения, получаем
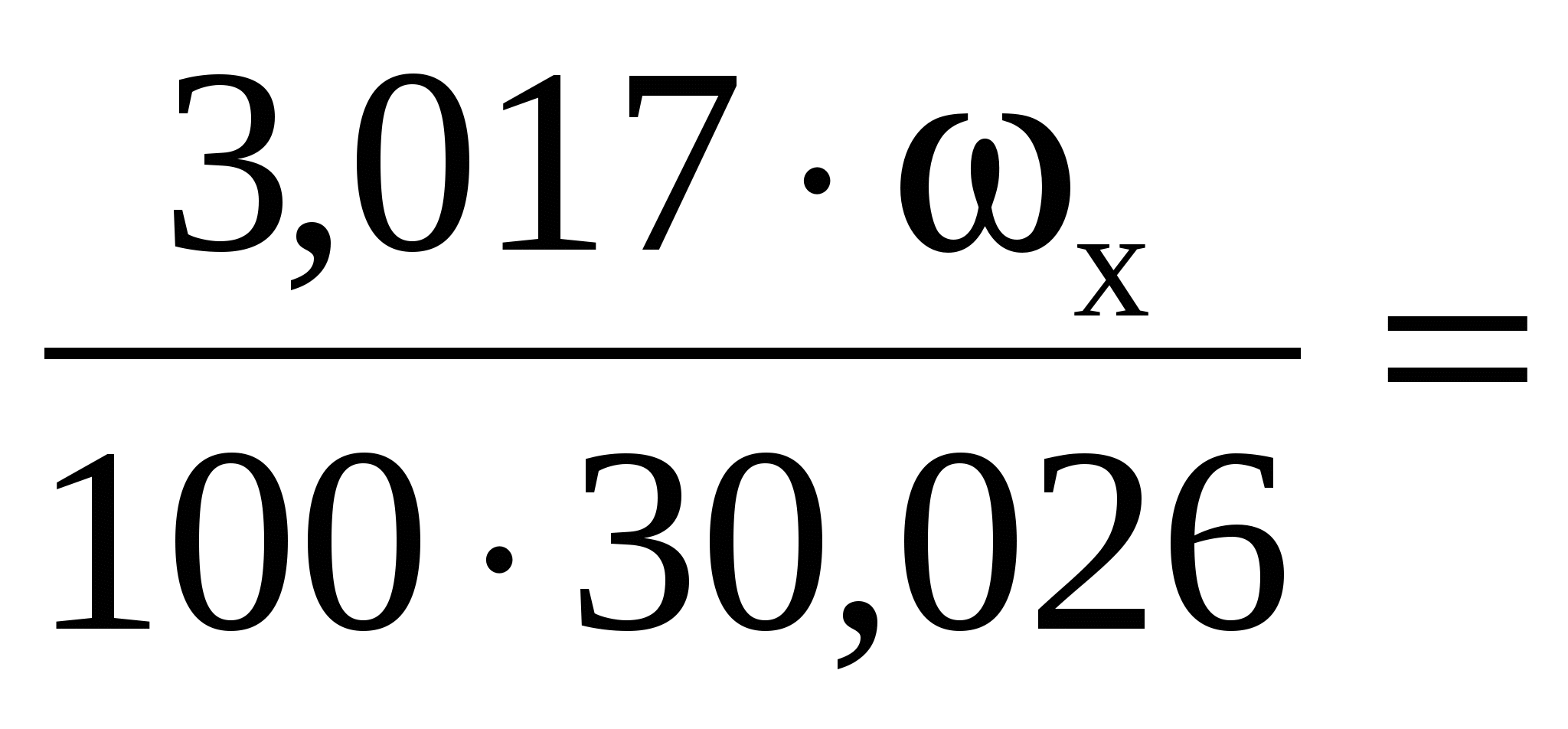 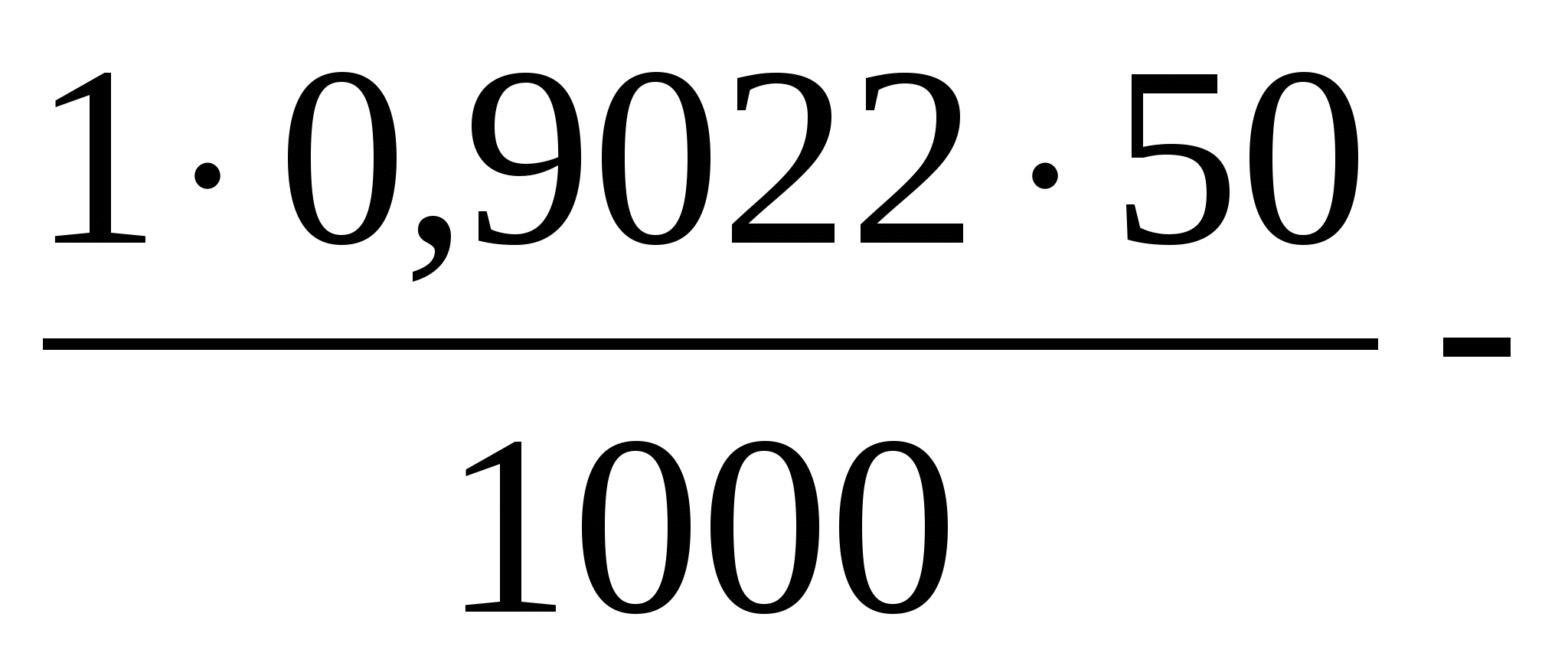 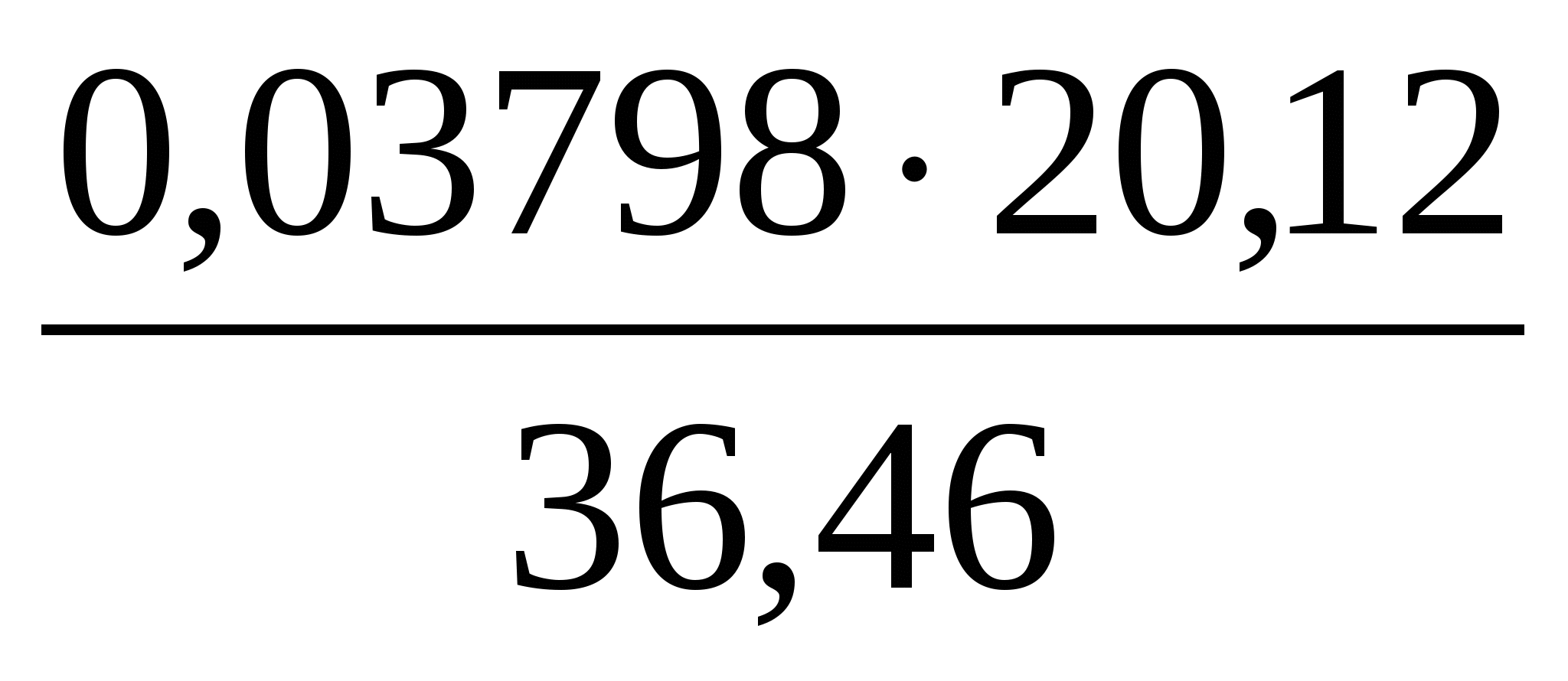
ωx = 20,86 %
Иногда в ходе анализа целесообразно осуществить двойное и даже тройное замещение. Например, в случае тройного замещения можно схематично написать реакции в следующем виде
Даны вещества А,В, С, D. S – заместитель
ZAA + ZBB + ….→ Z1S1 +….
Z1S1 + ZCC + ….→ Z2S2 +….
Z2S2 + ZDD + ….→ Z3S3 +….
Третий заместитель S3 титруют титрантом Т
Z3S3 + ZTT + … → ZPP+…
Массу и массовую долю (%) определяемого вещества в таком случае вычисляют по формулам
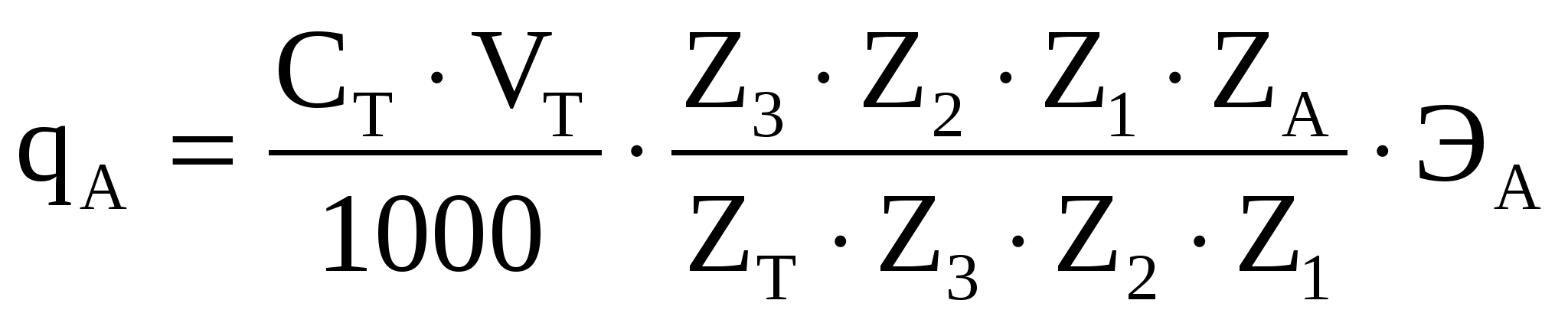
%сод = 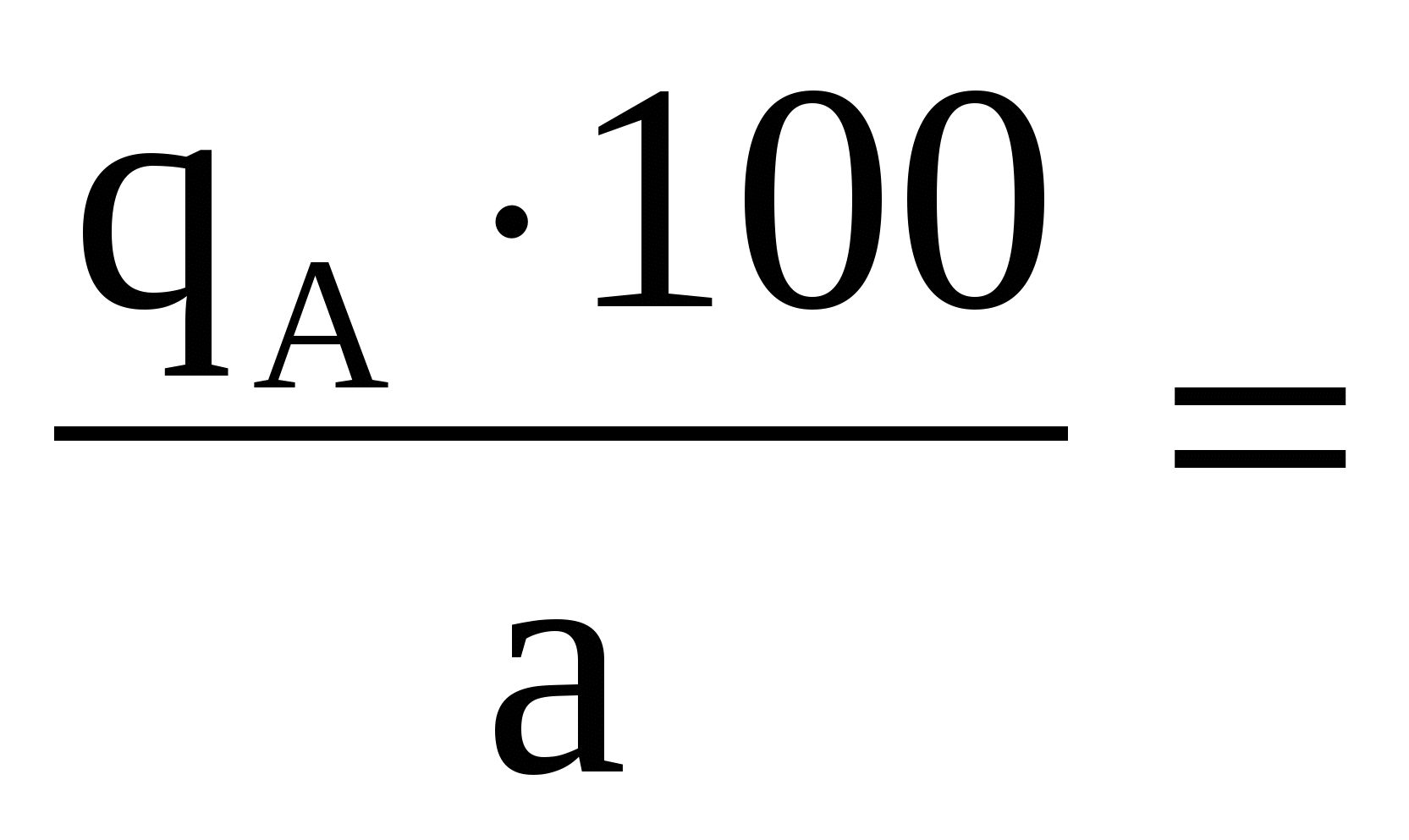 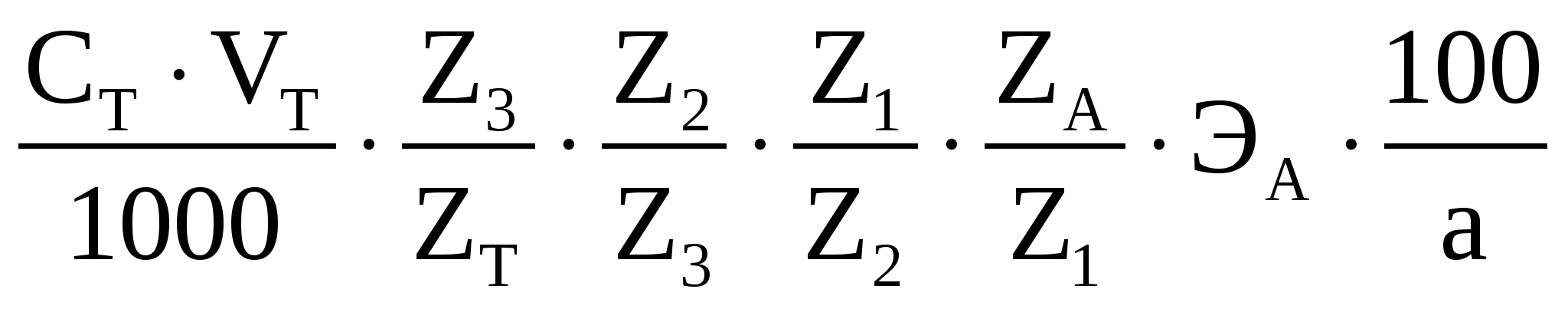
Пример 7
Навеску сплава, содержащего свинец, массой 0,3526г растворили в азотной кислоте. Свинец осаждают в виде хромата, осадок отфильтровывают, отмывают от избытка хромата и растворяют в соляной кислоте. В растворе хромат-ионы определяют иодометрически. На титрованиие выделившегося иода израсходовано 25,85 мл 0,0500 М раствора Na2S2O3. Рассчитать массовую долю свинца в сплаве (Мол. масса (Pb) 207,19)
Решение
Уравнение реакций можно представить в следующем виде
Pb2+ + CrO PbCrO4 (ZA=Z1=1) PbCrO4 (ZA=Z1=1)
2 PbCrO4 + 2H3O+↔ 2 Pb2++ Cr2O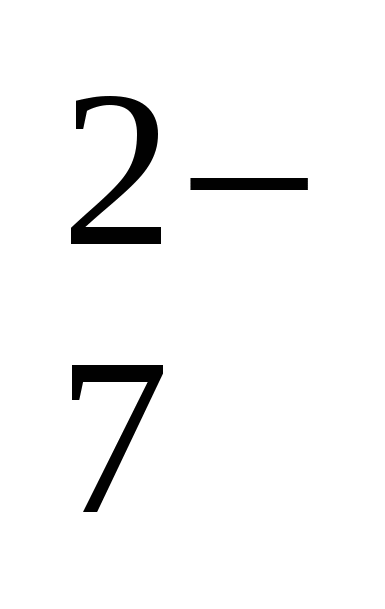 +3H2O (Z1=2; Z2=1) +3H2O (Z1=2; Z2=1)
Cr2O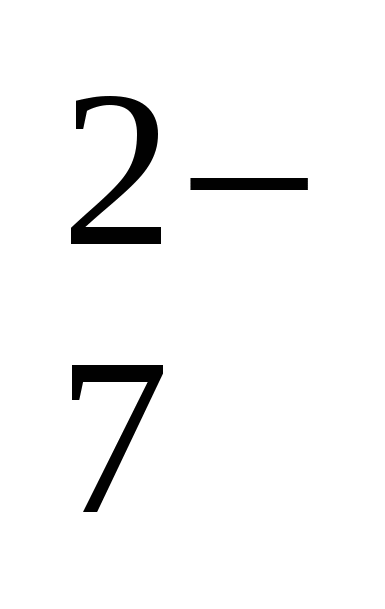 +6J-+14 H3O+↔3J2+2Cr3+ +21H2O (Z2=1; Z3=3) +6J-+14 H3O+↔3J2+2Cr3+ +21H2O (Z2=1; Z3=3)
J2 +2S2O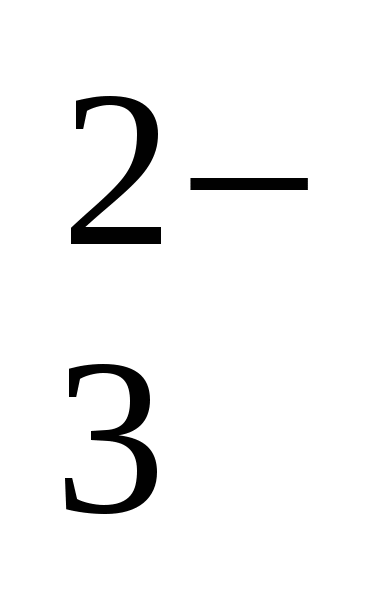 ↔2J-+S4 O ↔2J-+S4 O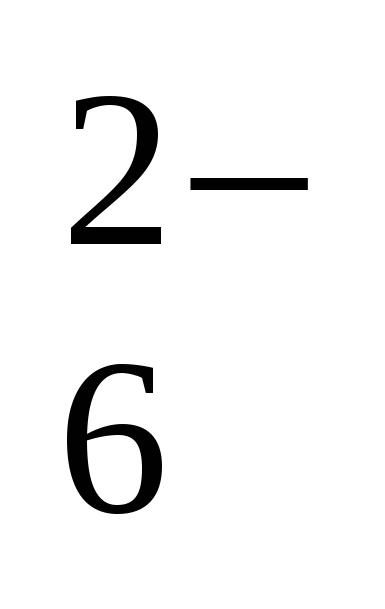 (Z3=1; ZT=2) (Z3=1; ZT=2)
Массовую долю свинца вычисляют по формуле
ωPb,% = 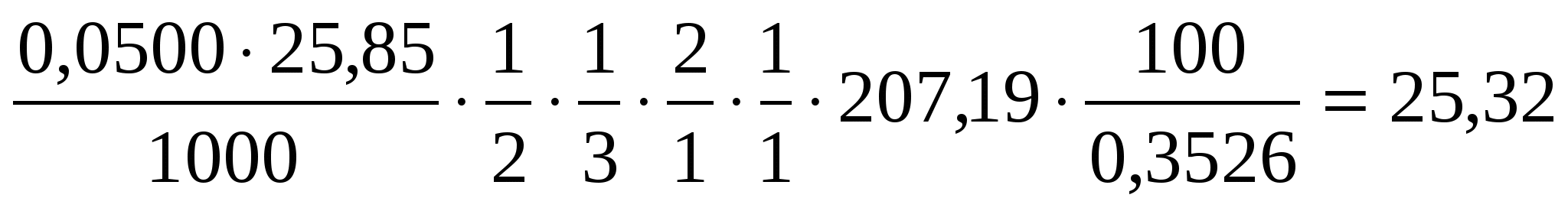
Задачи для самостоятельного решения
В 250,0 мл. раствора NaOH содержится 10,00 г этого вещества. Чему равен титр этого раствора? Ответ:0,040000 г/мл
Чему равна нормальность растворов, содержащих в 1 л: а) 4,0106 г HCl; б) 4,8059 г H2SO4 ? Ответ: а) 0,1100 н.; б) 0,09797н.
Найти нормальность раствора HCl , если титр его равен 0,003592 г/мл. Ответ: 0,0965 н.
Чему равен титр 0,1205 н. раствора H2SO4? Ответ: 0,005909г/мл
Сколько граммов КОН содержится в 200 мл 0,0900 н. раствора его? Ответ:1,032 г.
Чему равны нормальность и титр HNO3, если на титрование 20,00 мл его израсходовано 15 мл 0,1200 н. раствора NaOH? Ответ:0,09 н.; 0,005671 г/мл
Сколько граммов H2SO4 содержится в 5 л раствора, если на титрование25,00 мл этого раствора израсходовано 22,50 мл 0,0950 н. раствора КОН? Ответ: 20,97 г.
Сколько грамм-эквивалентов: а) в навеске 1,8909 г щавелевой кислоты Н2С2О4·2Н2О х.ч.; б) в 20 мл 0,12 н. раствора NaOH? Ответ: а) 0,030; б) 0,0024
Сколько миллиграмм-эквивалентов содержится : а) в навеске 0,4240 г Na2CO3 х.ч. б) в 50 мл 0,20 н. раствора H2SO4 ? Ответ:а) 8,00; б) 10
Чему равны нормальность и титр растворов КОН, если 26,00 мл его израсходовано на титрование навески 0,1560 г х.ч. (двухосновной) янтарной кислоты? Ответ:0,1016н.; 0,005700 г/мл
Сколько процентов Н2С2О4•2Н2О содержит данный препарат щавелевой кислоты, если на титрование навески 0,1500 г его, растворенной в произвольном объеме воды, израсходовано 25,60 мл 0,0900 н. раствора КОН? Ответ:96,79%
На титрование 0,0340 г AgNO3 израсходовано 20,00 раствора HCl. Найти ТHCl/Ag. Ответ:0,001077 г/мл
Чему равен ТHCl/СаО, если на титрование 0,1144 г СаСО3 идет 27,65 мл раствора соляной кислоты (см. задачу 12). Ответ:0,002189 г/мл
Определить массовую долю (%) индифферентных примесей в Mg SO4 ∙ 7H2O, если после растворения навески массой 0,2000 г магний оттитровали 14,64 мл 0,05500М ЭДТА. Ответ: 0,77%
Сколько процентов железа содержит руда, если при титровании раствора FeCl2, полученного из навески 0,2000 г ее, затрачено 20,00 мл раствора бихромата с титром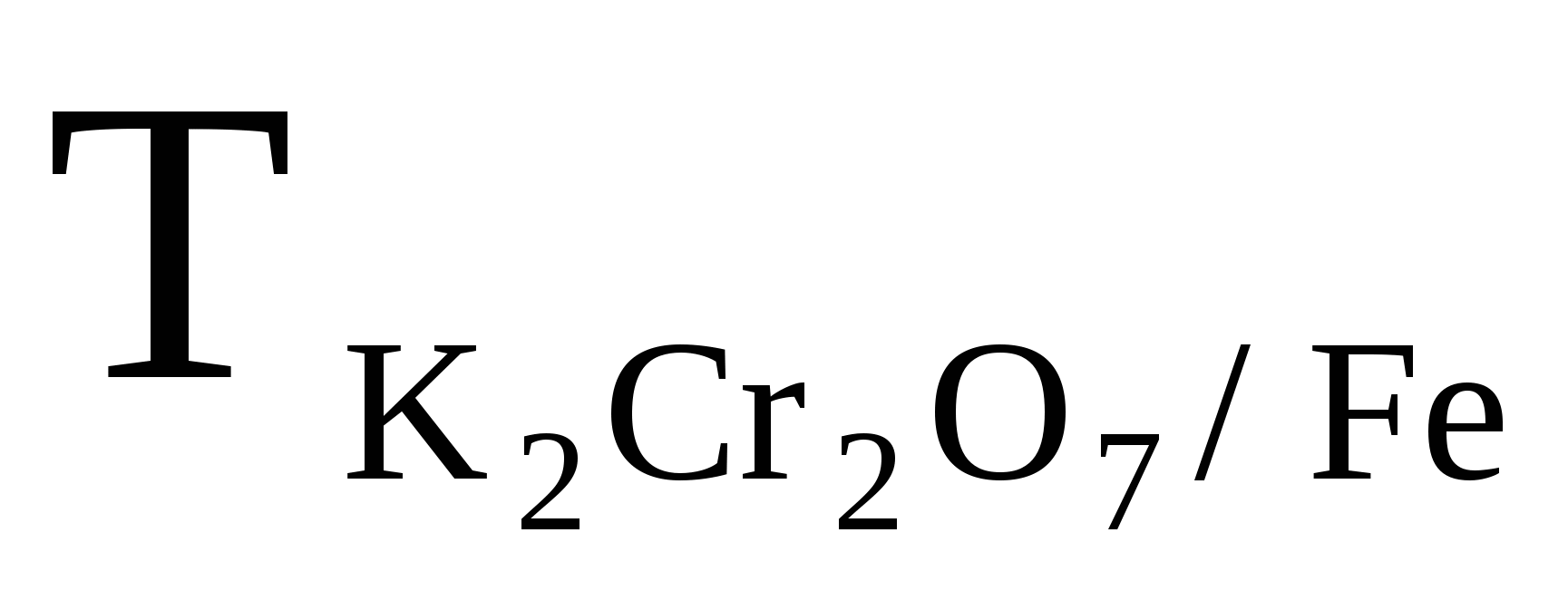 =0,006500 г/мл. Ответ: 65% =0,006500 г/мл. Ответ: 65%
Чему равны титры 0,09000 н. раствора серной кислоты: а) по Ba(OH)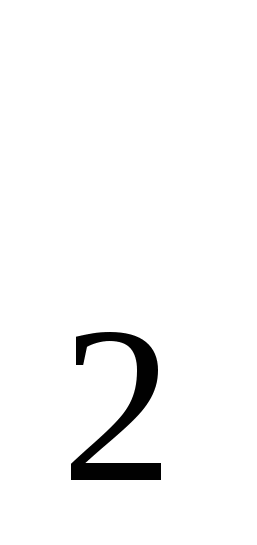 ; б) по NH ; б) по NH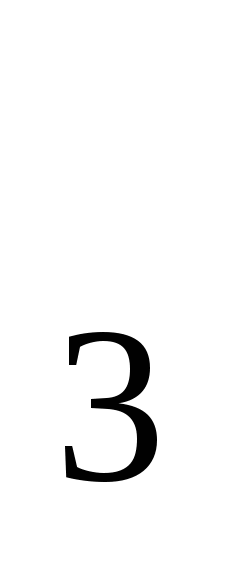 в) по N2? Ответ: а) 0,007712;б) 0,001533; в) 0,001261 в) по N2? Ответ: а) 0,007712;б) 0,001533; в) 0,001261
Какую навеску соды Na2CO3 нужно взять, чтобы на титрование ее требовалось 20-30 мл 0,1 н. раствора H2SO4? Ответ: 0,11-0,16 г.
Сколько мл 0,0200 н. раствора KMnO4 потребуется на титрование 20,00 мл 0,0300 н. раствора FeSO4? Ответ: 30 мл.
Определить массовую долю (%) алюминия в сплаве, если после растворения навески массой 0,6500 г его и удаления мешающих элементов объем раствора довели до 250,0 мл, к 20,00 мл этого раствора добавили Na2 MgЭДТА и оттитровали 15,18 мл 0,05023 М ЭДТА. Ответ: 39,56%
Чему равна нормальность 40%-го раствора CaCl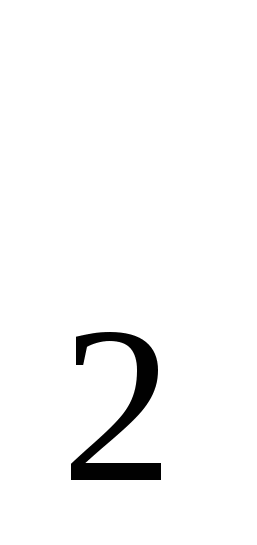 , плотностью 1,396 г/см , плотностью 1,396 г/см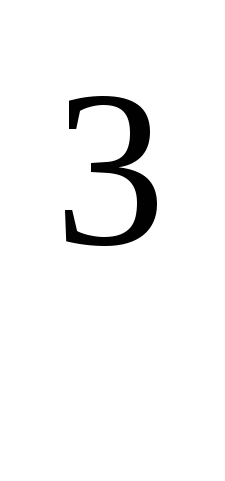 . Ответ:10 Н . Ответ:10 Н
Вычислить молярную концентрацию 10%-го раствора NH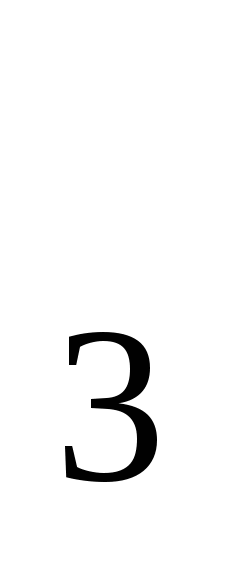 , плотностью 0,958 г/см , плотностью 0,958 г/см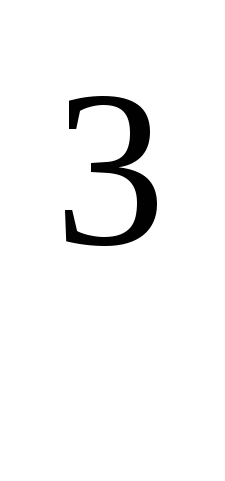 . Ответ: 5,6 М . Ответ: 5,6 М
Сколько миллилитров 2,00н. раствора HNO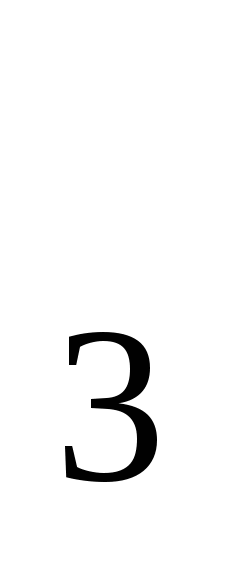 взять для приготовления 3л 0,1000н. раствора? Ответ:150 мл. взять для приготовления 3л 0,1000н. раствора? Ответ:150 мл.
Какому объему 1н. раствора эквивалентны 23,8мл 0,20н. раствора HCl? Ответ:4,8 мл.
Сколько миллилитров 20%-го раствора HCl (плотностью 1,098 г/см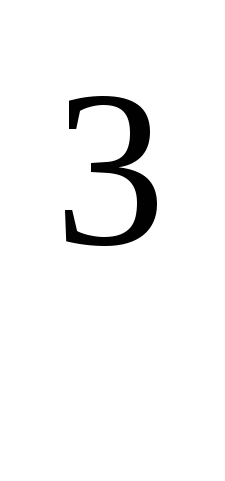 ) нужно взять для приготовления 5л. 0,1 Н раствора? Ответ: 83 мл. ) нужно взять для приготовления 5л. 0,1 Н раствора? Ответ: 83 мл.
Сколько миллилитров 10%-го раствора HCl (плотностью 1,047 г/см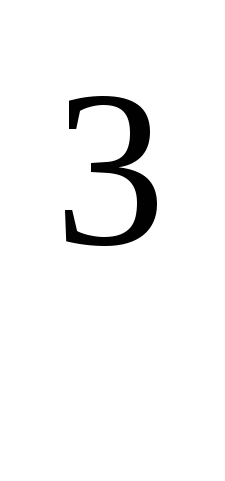 ) нужно прибавить к 50мл. 37,23%-го раствора плотностью 1,19 г/см ) нужно прибавить к 50мл. 37,23%-го раствора плотностью 1,19 г/см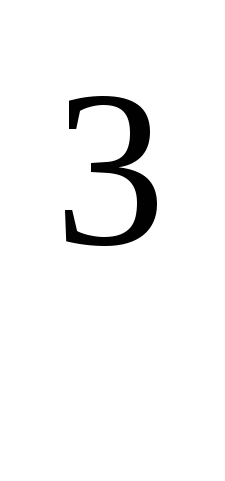 , чтобы получить 25%-ый раствор HCl? Ответ: 46 мл. , чтобы получить 25%-ый раствор HCl? Ответ: 46 мл.
Сколько воды нужно прибавить к 1л HNO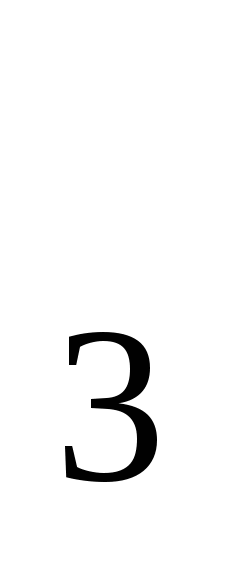 плотностью 1,405 г/см плотностью 1,405 г/см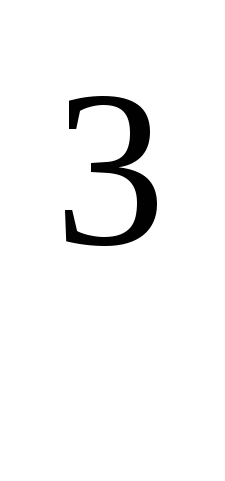 , чтобы получить HNO , чтобы получить HNO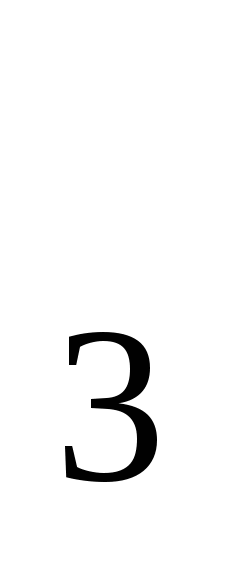 плотностью 1,193 г/см плотностью 1,193 г/см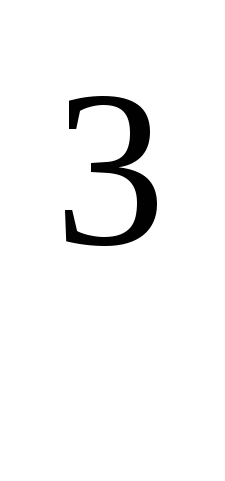 .Ответ: 581мл. .Ответ: 581мл.
Навеску серосодержащего органического вещества массой 0,1512 г сожгли в токе О2, выделившийся SO2 поглотили раствором Н2О2. На титрование образовавшейся H2SO4 израсходовали 21,25 мл 0,1000М раствора NaOH. Рассчитайте массовую долю (%) серы (Мr = 32,06) в исходном веществе. Ответ:22,53 %
Рассчитайте содержание NaCl (мг/мл) в рассоле, еслина титрование 30,00 мл рассола потребовалось15,60 мл 0,1000М раствора AgNO3. Ответ: 3,04 мг/мл.
Навеску железной руды массой 0,2486 г растворили в кислоте, железо восстановили до Fe(II) и затем оттитровали 20,25 мл. Рассчитайте массовую долю (%) железа в руде. Ответ: 21,66%
Какую навеску Na2CO3 нужно взять для установки по ней титра 0,1н. раствора H2SO4 , если располагают мерной колбой емкостью 200мл и титрование будут вести с метиловым оранжевым? Ответ:0,53 г.
Вычислить нормальность и титр раствора H2SO4, если на титрование навески 50,00 мл раствора Na2CO3, полученного растворением навески его 0,5000г в мерной колбе емкостью 200мл, с метиловым оранжевым расходуется 24,00 мл раствора H2SO4. Ответ:0,09826 Н;0,004819 г/мл.
Вычислить нормальность и титр раствора КОН, если на титрование навески 0,1495г. Н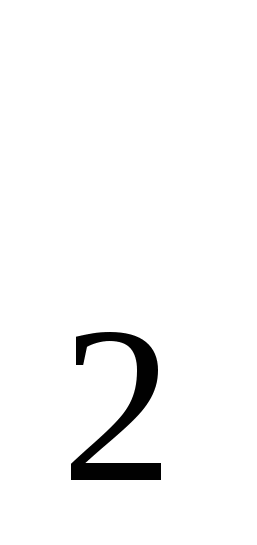 C C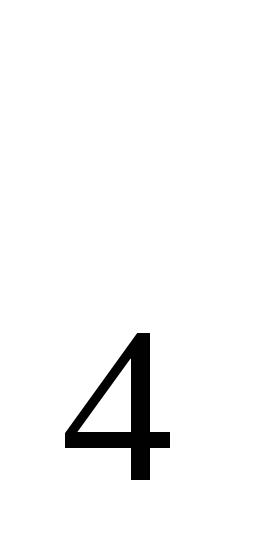 H H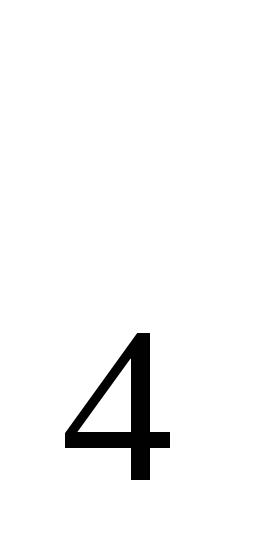 O O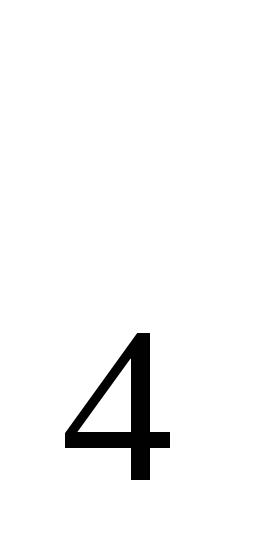 , растворенной в произвольном объеме воды израсходовано 25,20мл. его Ответ:0,1005 Н; 0,005637 г/мл. , растворенной в произвольном объеме воды израсходовано 25,20мл. его Ответ:0,1005 Н; 0,005637 г/мл.
Сколько процентов HNO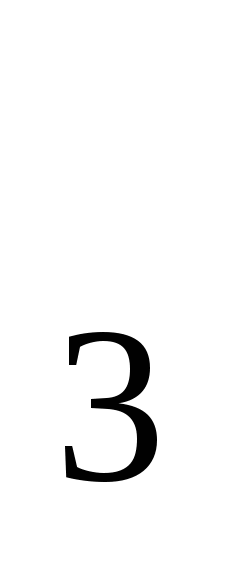 содержит концентрированная азотная кислота, если после растворения 9,7770 г в мерной колбе емкостью 1л на титрование 25,00мл 0,1040н. раствора NaOH израсходовано 25,45мл полученного раствора HNO содержит концентрированная азотная кислота, если после растворения 9,7770 г в мерной колбе емкостью 1л на титрование 25,00мл 0,1040н. раствора NaOH израсходовано 25,45мл полученного раствора HNO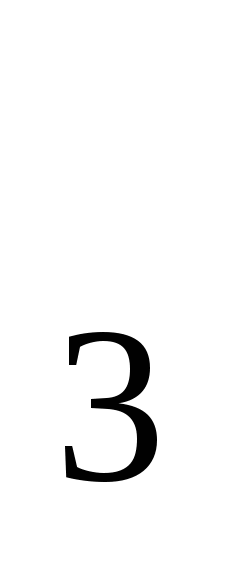 ? Ответ: 68,85%. ? Ответ: 68,85%.
Сколько граммов Н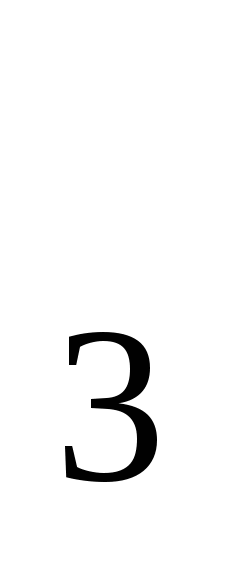 РО РО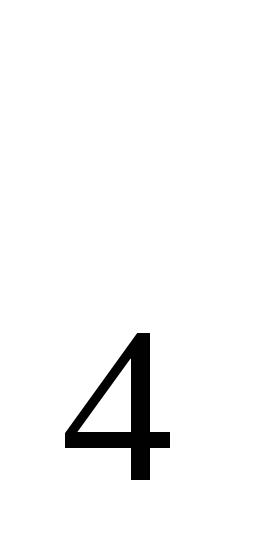 содержится в данном растворе, если на титрование его с фенолфталеином затрачено 25,50мл 0,2000н. раствора NaOH? Ответ: 0,2499 г. содержится в данном растворе, если на титрование его с фенолфталеином затрачено 25,50мл 0,2000н. раствора NaOH? Ответ: 0,2499 г.
Сколько граммов Н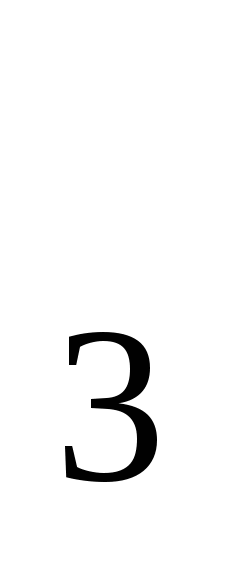 РО РО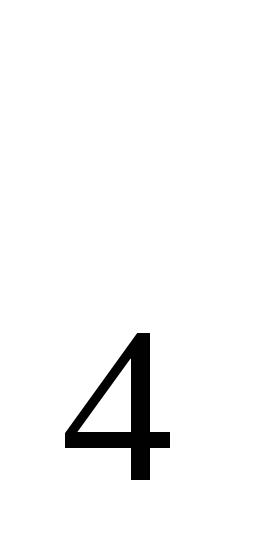 содержится в данном растворе, если на титрование его с метиловым оранжевым израсходовано 25,50мл 0,2000н. раствора NaOH? При решении этой задачи найдите сначала T содержится в данном растворе, если на титрование его с метиловым оранжевым израсходовано 25,50мл 0,2000н. раствора NaOH? При решении этой задачи найдите сначала T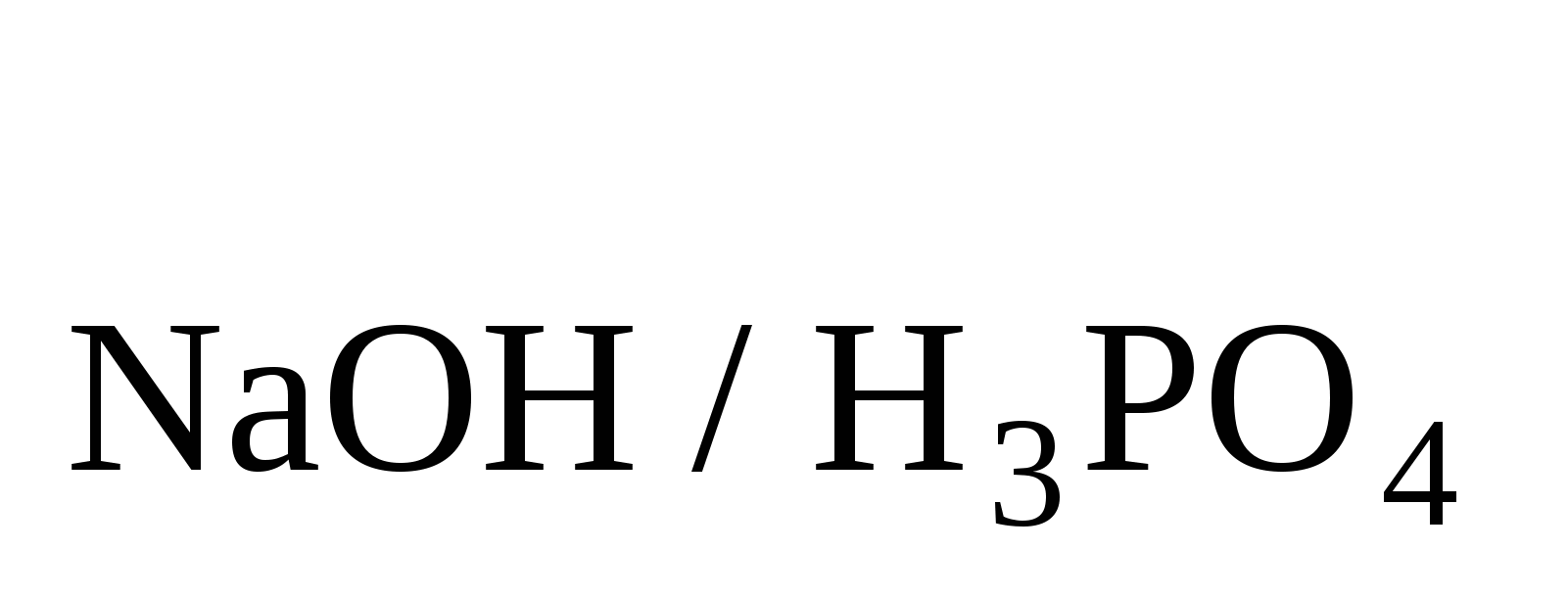 . Ответ: 0,4998 г. . Ответ: 0,4998 г.
Чему равна карбонатная жесткость воды, если на титрование 100мл её израсходовано 5,00мл 0,0900 Н раствора HCl. Ответ: 4,5 мг/экв.
Сколько процентов железа содержится в железной проволоке, если после растворения 0,1400г её в H2SO4 без доступа воздуха на титрование полученного раствора израсходовано 24,85мл 0,1000н. раствора KMnO4. Ответ:99,15%
Сколько процентов железа содержится в руде, если на титрование раствора (полученного при растворении навески руды 0,2500г в HCl) израсходовано 28,00мл 0,09950н. раствора KMnO4? Ответ:62,24%
Сколько граммов Са содержится в 250,0 мл раствора CaCl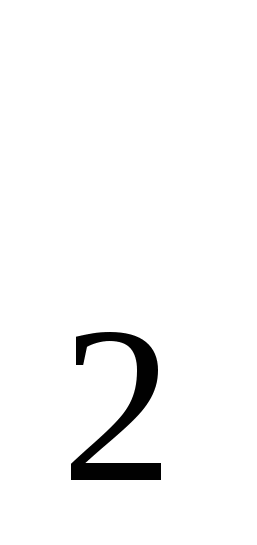 , если после прибавления к 25,00 мл его 40,00мл 0,1000 Н раствора (NH , если после прибавления к 25,00 мл его 40,00мл 0,1000 Н раствора (NH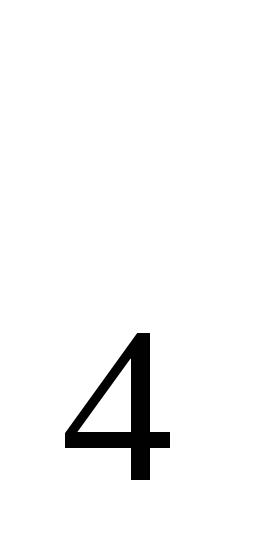 ) )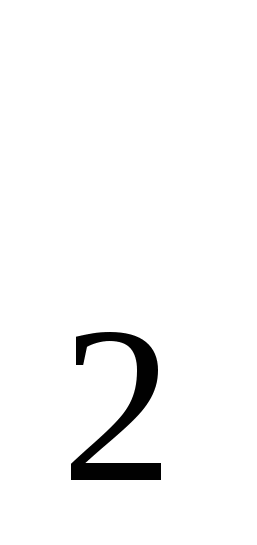 C C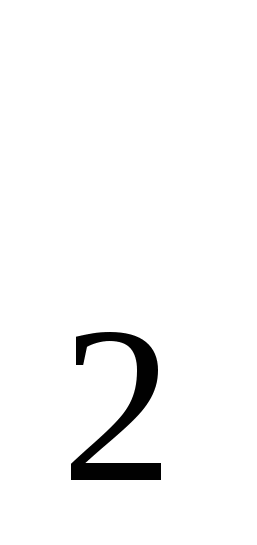 O O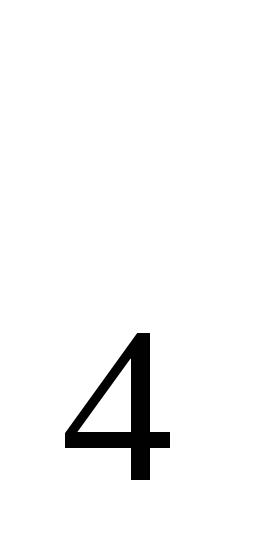 и после отделения образовавшегося осадка CaC и после отделения образовавшегося осадка CaC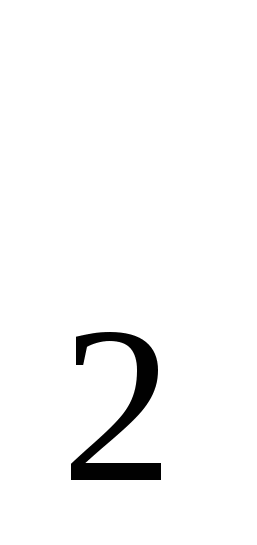 O O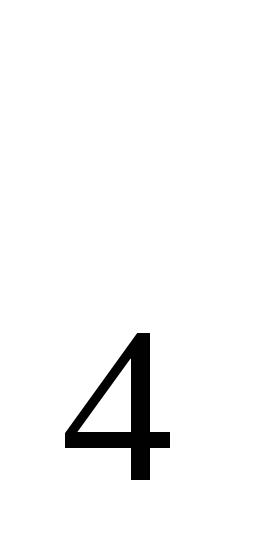 на титрование не вошедшего в реакцию (NH на титрование не вошедшего в реакцию (NH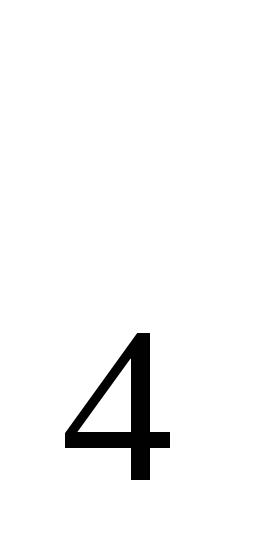 ) )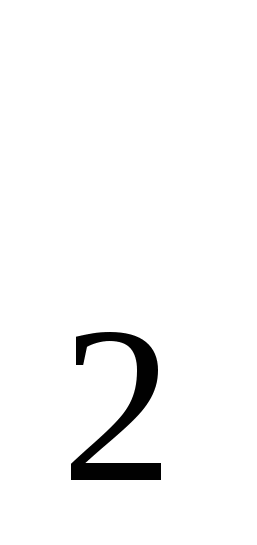 C C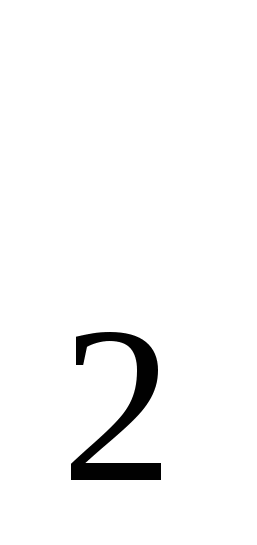 O O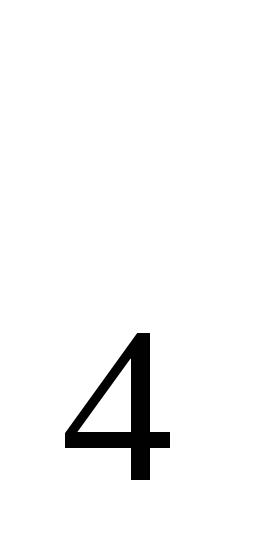 израсходовано 15,00 мл 0,02000 Н раствора KMnO4? Ответ: 0,7415 г. израсходовано 15,00 мл 0,02000 Н раствора KMnO4? Ответ: 0,7415 г.
Вычислить нормальность раствора H2SO4 , титр которого равен 0,02446 Ответ: 0,4988 Н
Вычислить нормальность раствора NaOH, титр которого равен 0,004020. Ответ:0,1005 Н.
Вычислить нормальность раствора, если T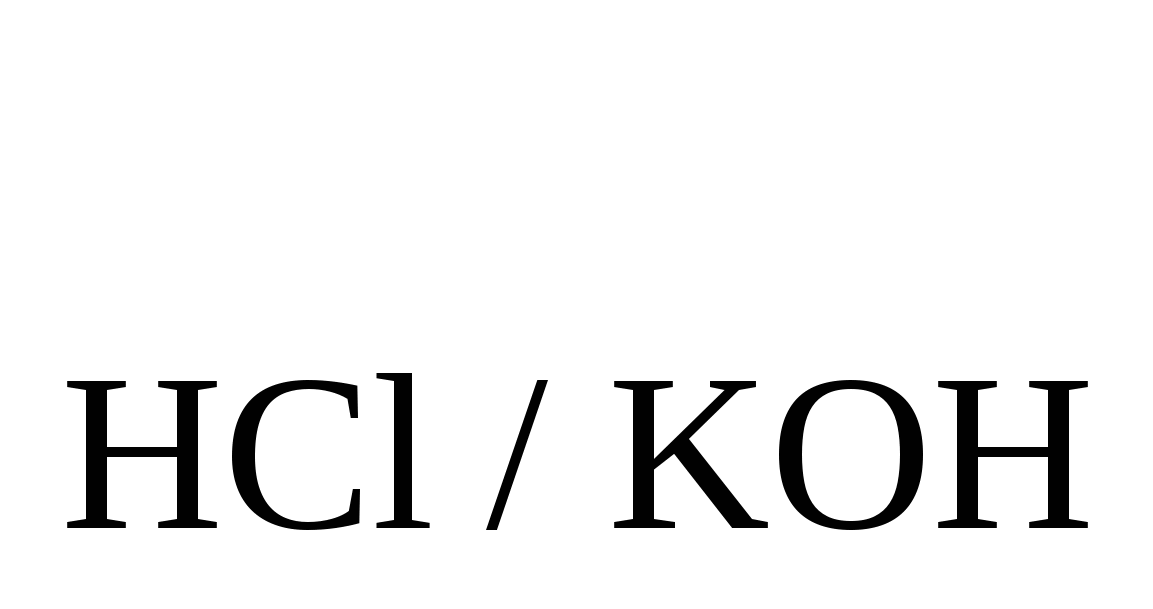 =0,01353. Ответ: 0,2412 Н. =0,01353. Ответ: 0,2412 Н.
Вычислить нормальность раствора, если T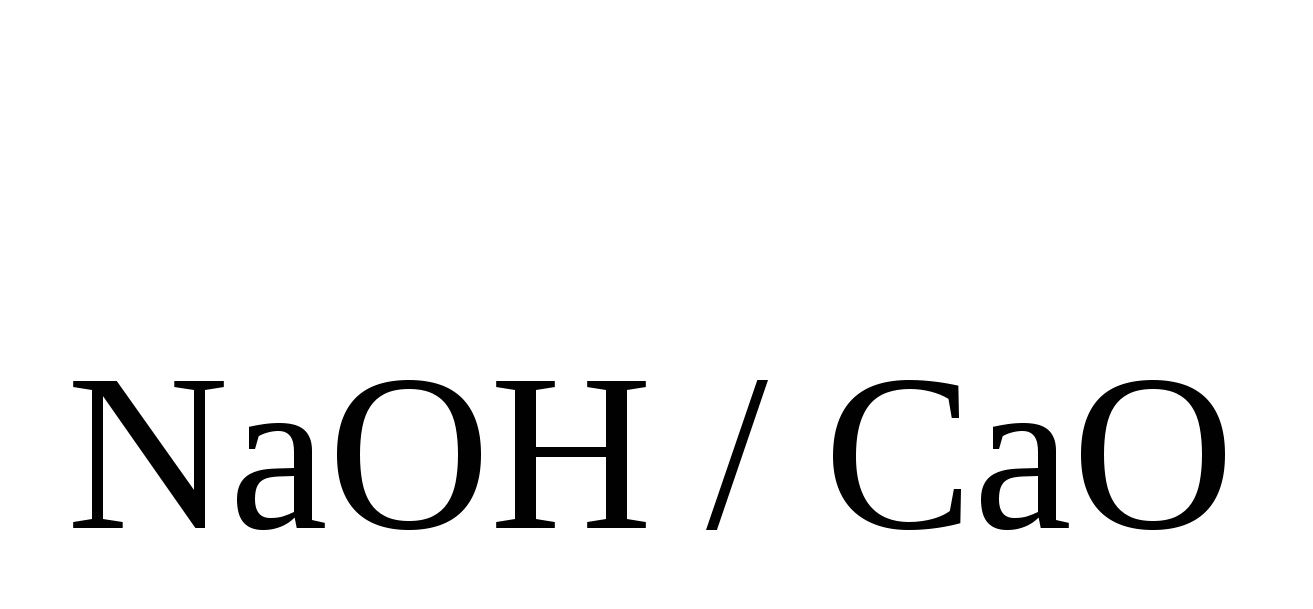 =0,002914. Ответ:0,1039 Н. =0,002914. Ответ:0,1039 Н.
Вычислить нормальность раствора, если T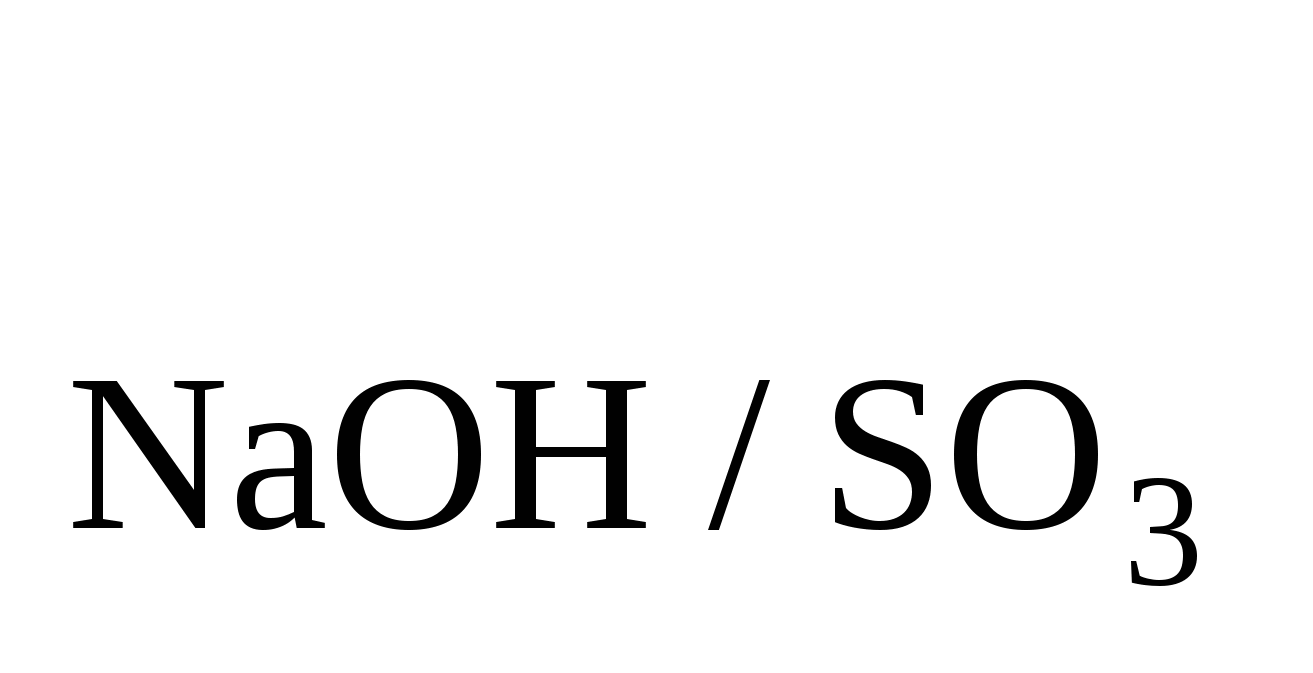 =0,02174. Ответ:0,5431 Н. =0,02174. Ответ:0,5431 Н.
Из навески образца массой 1,2548 г проэкстрагировали тиомочевину (NH2)2CS серной кислотой и оттитровали 0,0186 М раствором нитрата ртути (II), израсходовав 32,25 мл. Рассчитайте массовую долю (%) (NH2)2CS ( мол. масса 76,06) в образце. Ответ: 15,89 %
Нормальность раствора NaOH равна 0,09981. Рассчитать T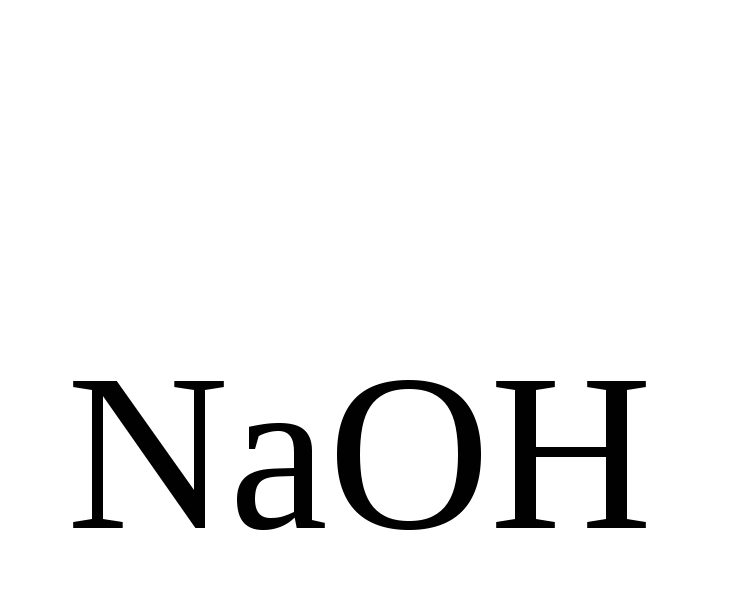 . Ответ: 0,03992 . Ответ: 0,03992
Нормальность раствора HCl равна 0,09798. Рассчитать T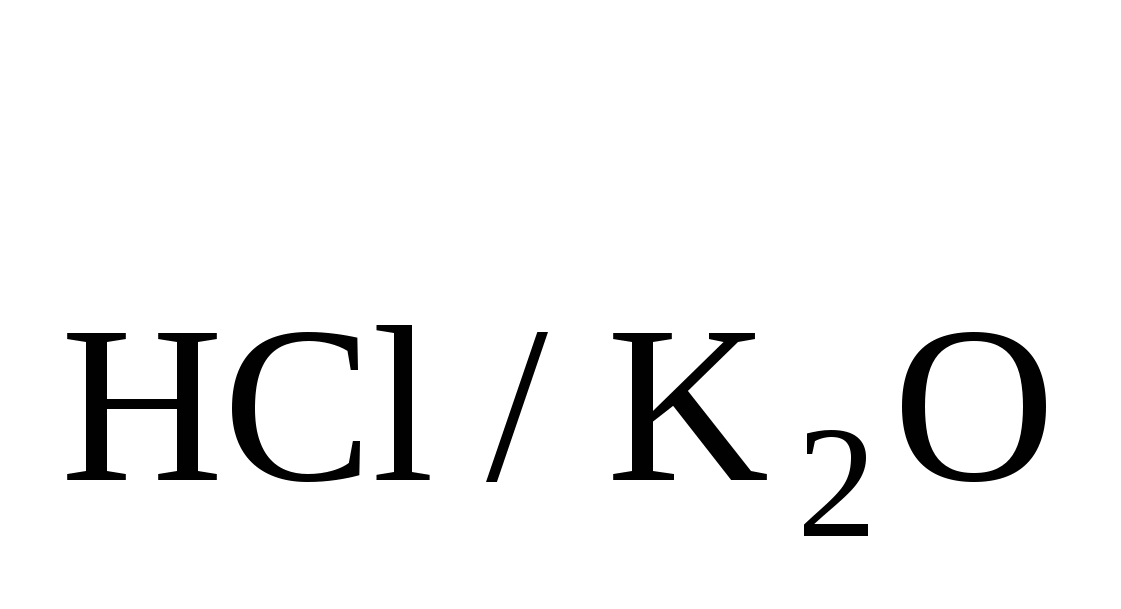 . Ответ: 0,004615 . Ответ: 0,004615
Нормальность раствора NaOH равна 0,1021. Рассчитать T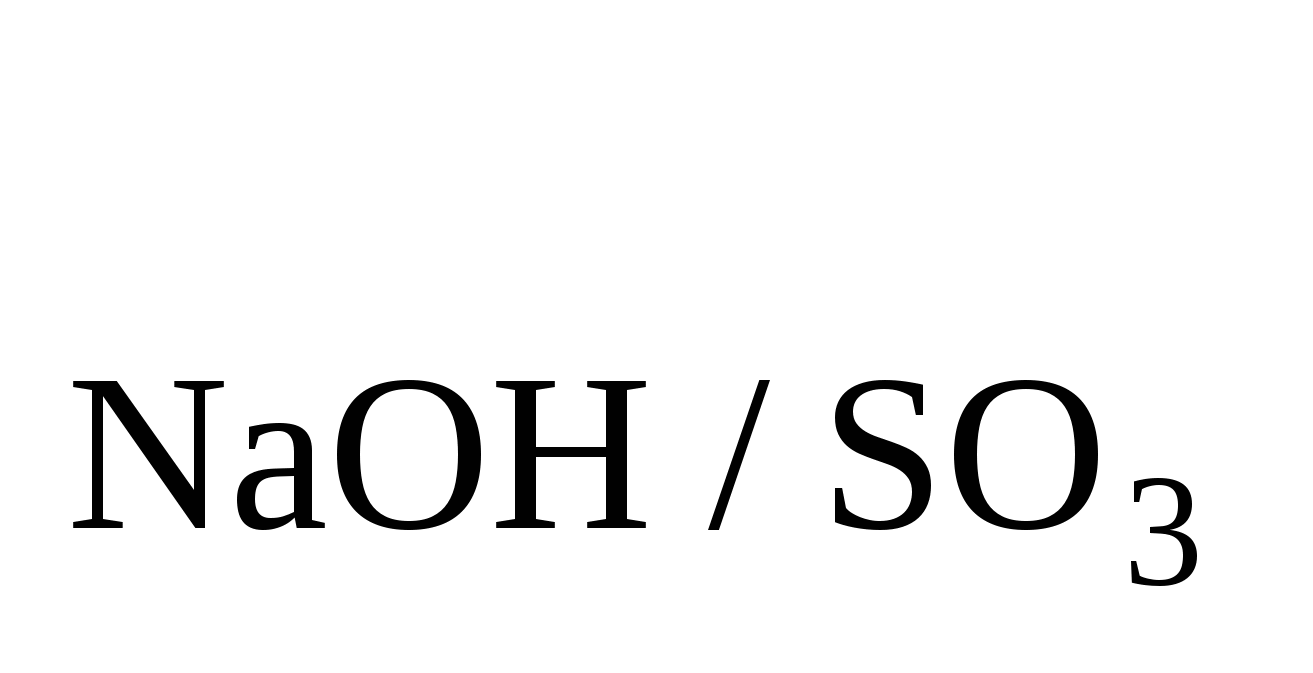 . Ответ: 0,004087 . Ответ: 0,004087
Найти T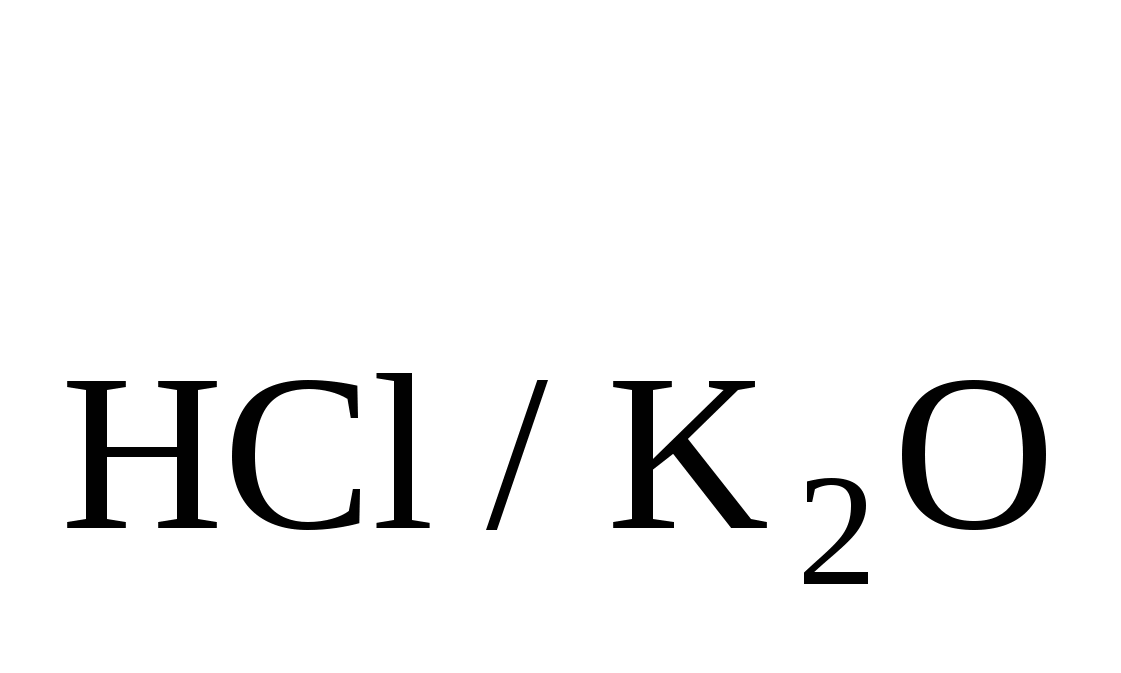 , если T , если T =0,03798. Ответ: 0,049058 =0,03798. Ответ: 0,049058
Найти T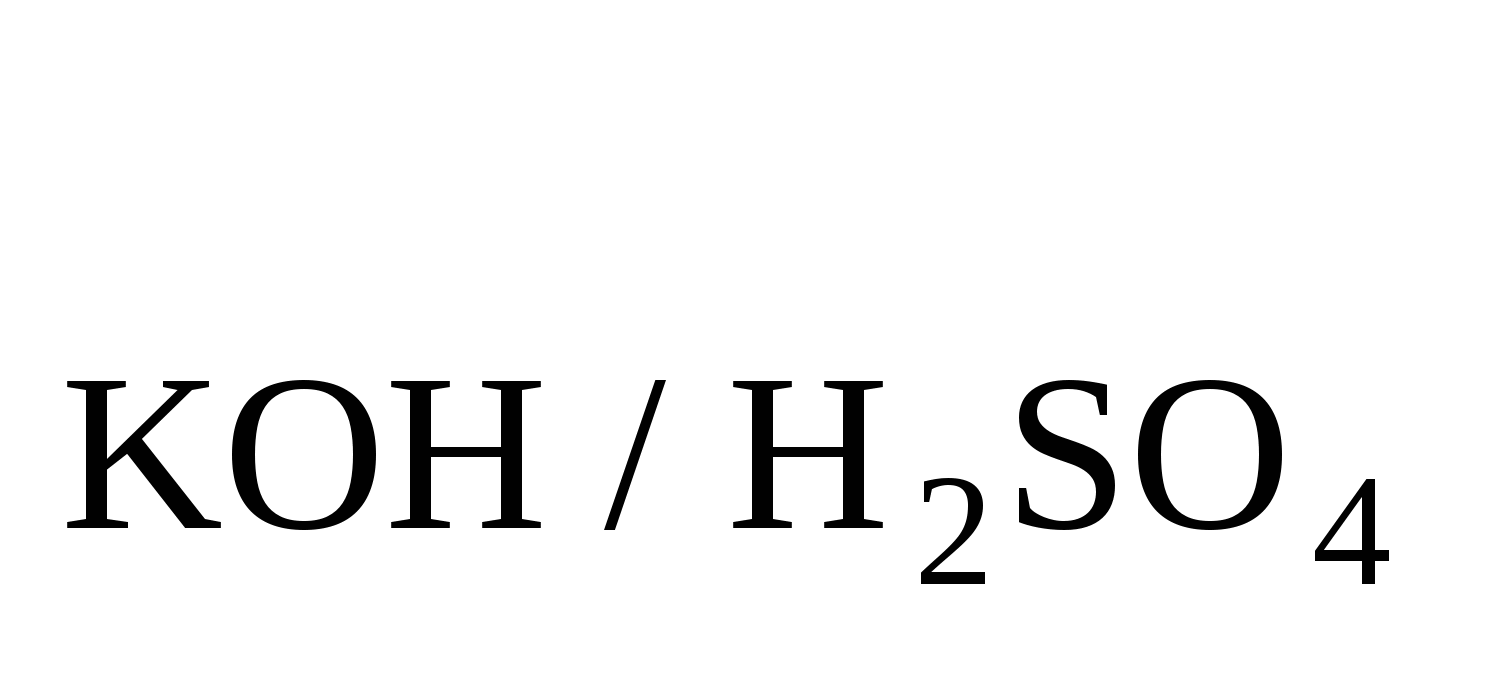 , если T , если T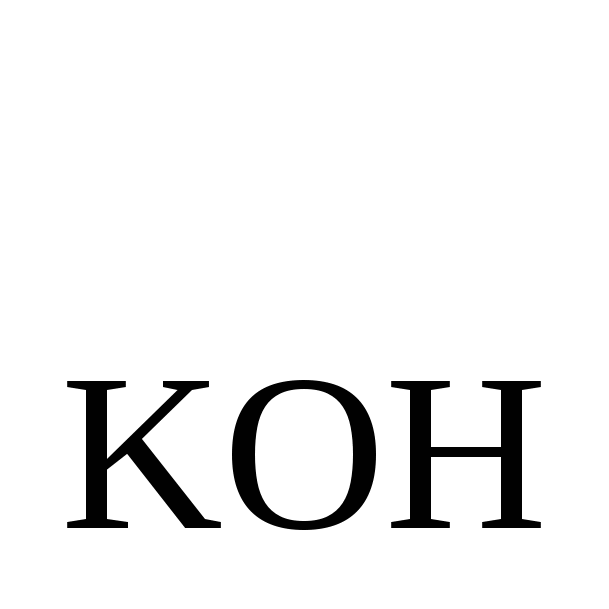 =0,005727. Ответ: 0,005004 =0,005727. Ответ: 0,005004
Найти T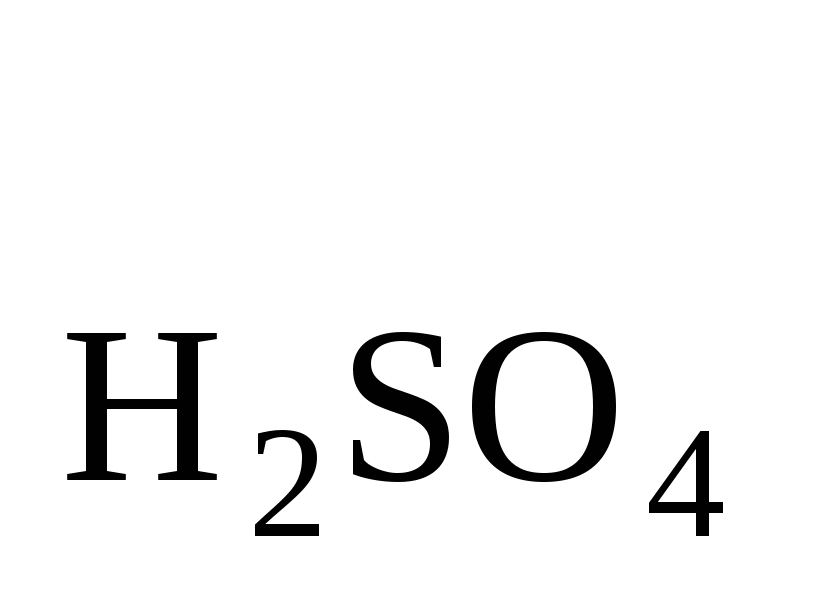 , если T , если T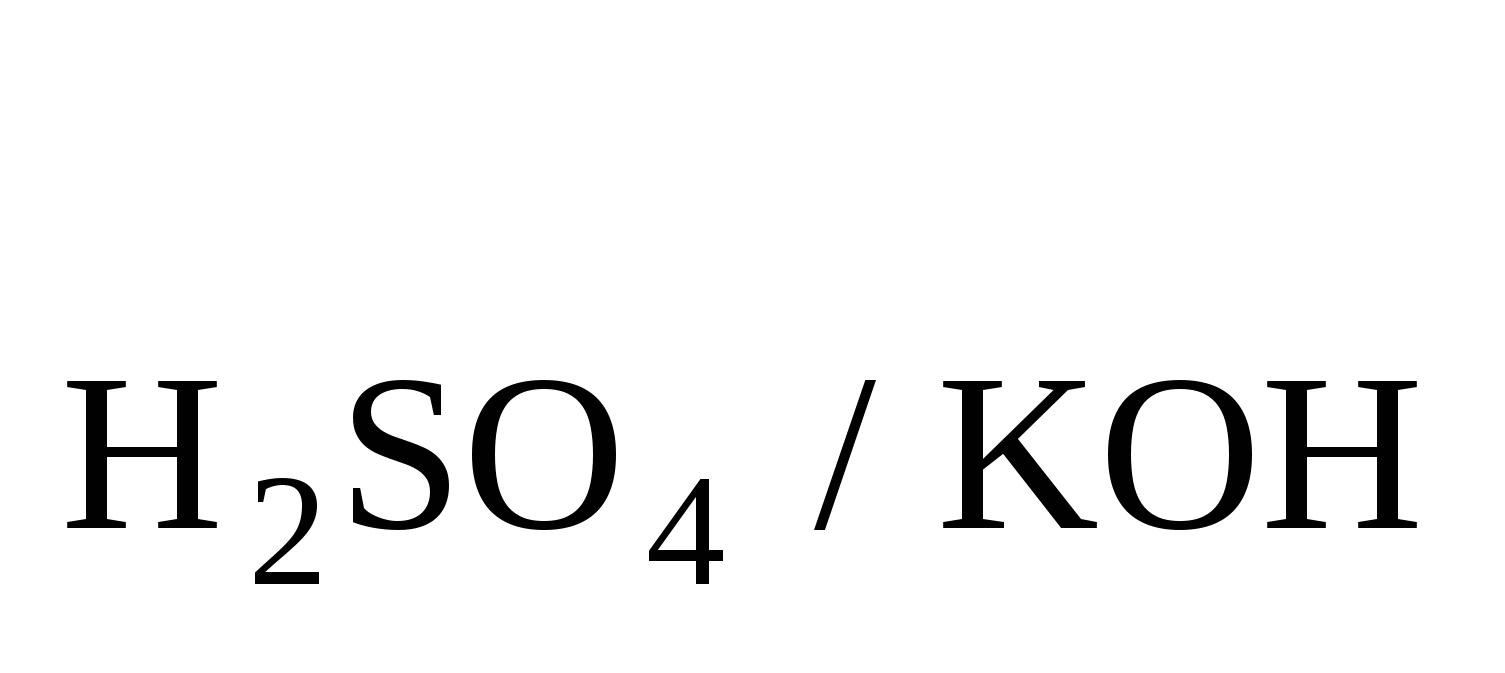 =0,005643. Ответ: 0,004932 =0,005643. Ответ: 0,004932
Найти T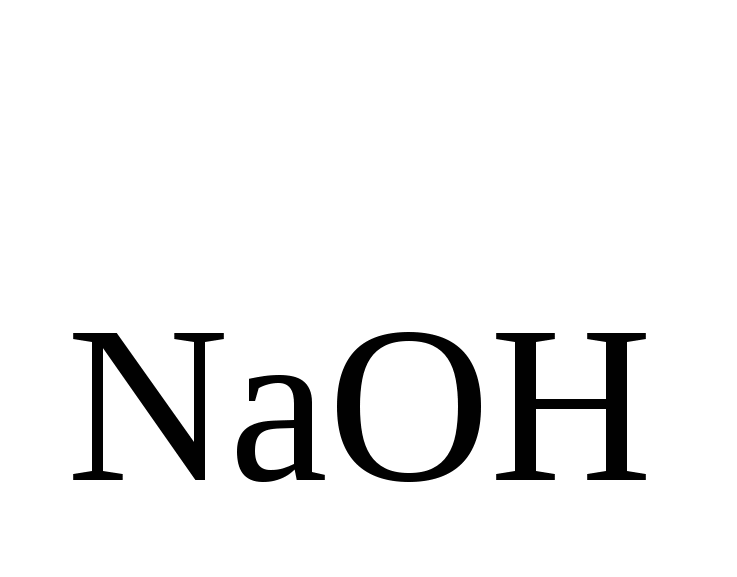 , если , если 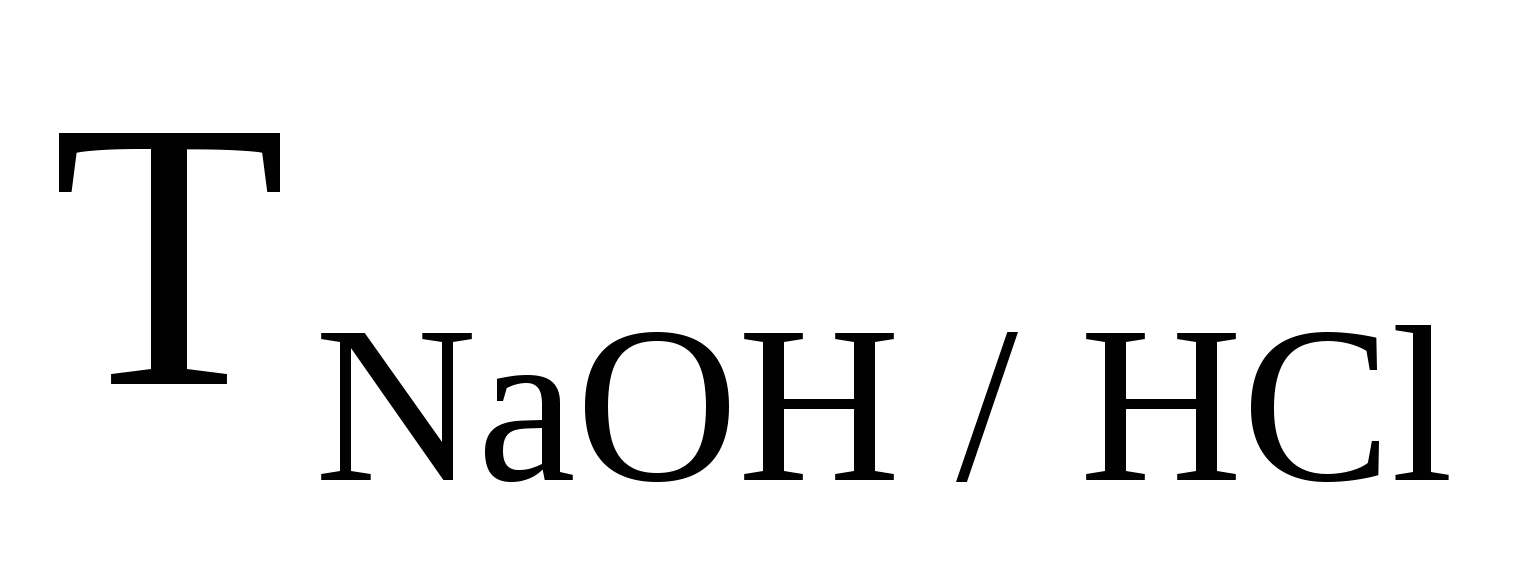 =0,003645. Ответ: 0,003999 =0,003645. Ответ: 0,003999
Вычислить T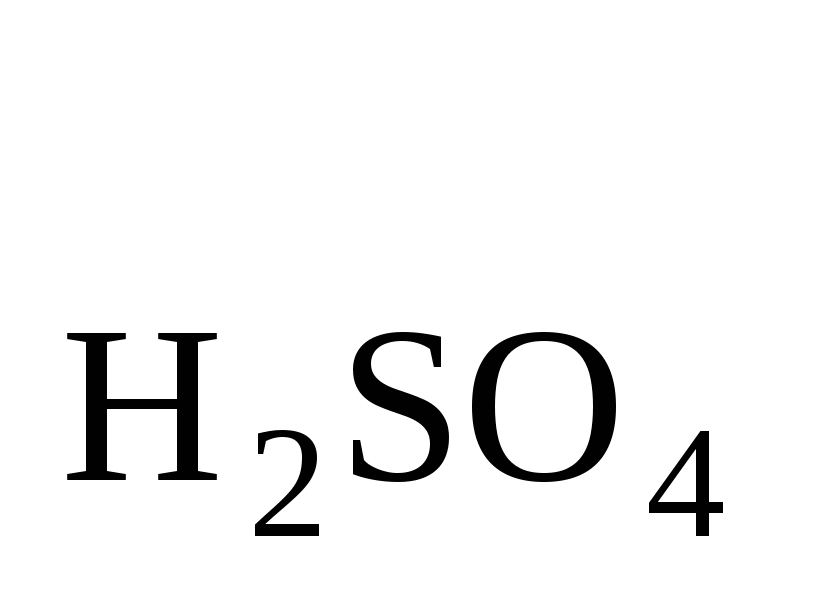 , если для 0,01 Н раствора К=0,9123. Ответ: 0,000447 , если для 0,01 Н раствора К=0,9123. Ответ: 0,000447
Вычислить T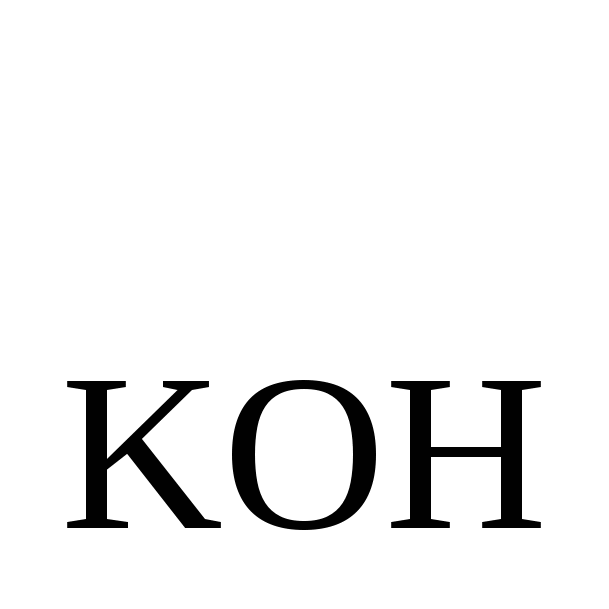 , если для 0,05 Н раствора К=0,8549. Ответ: 0,002399 , если для 0,05 Н раствора К=0,8549. Ответ: 0,002399
Имеется 0,1046 н. HCl. Определить T и T и T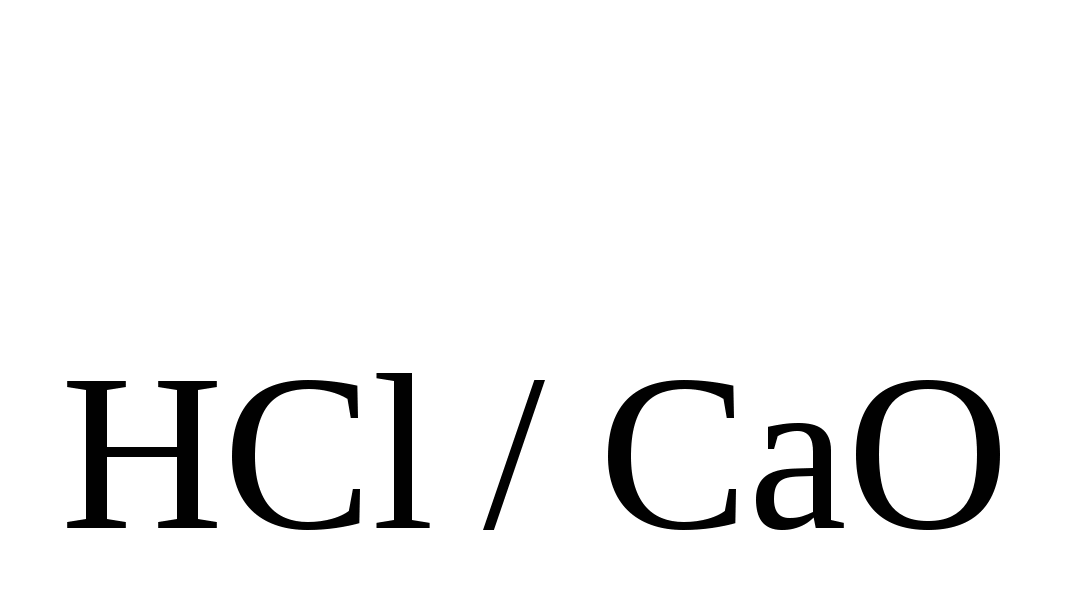 . Ответ: 0,002933; 0,003814 . Ответ: 0,002933; 0,003814
Найти нормальность H2SO4 T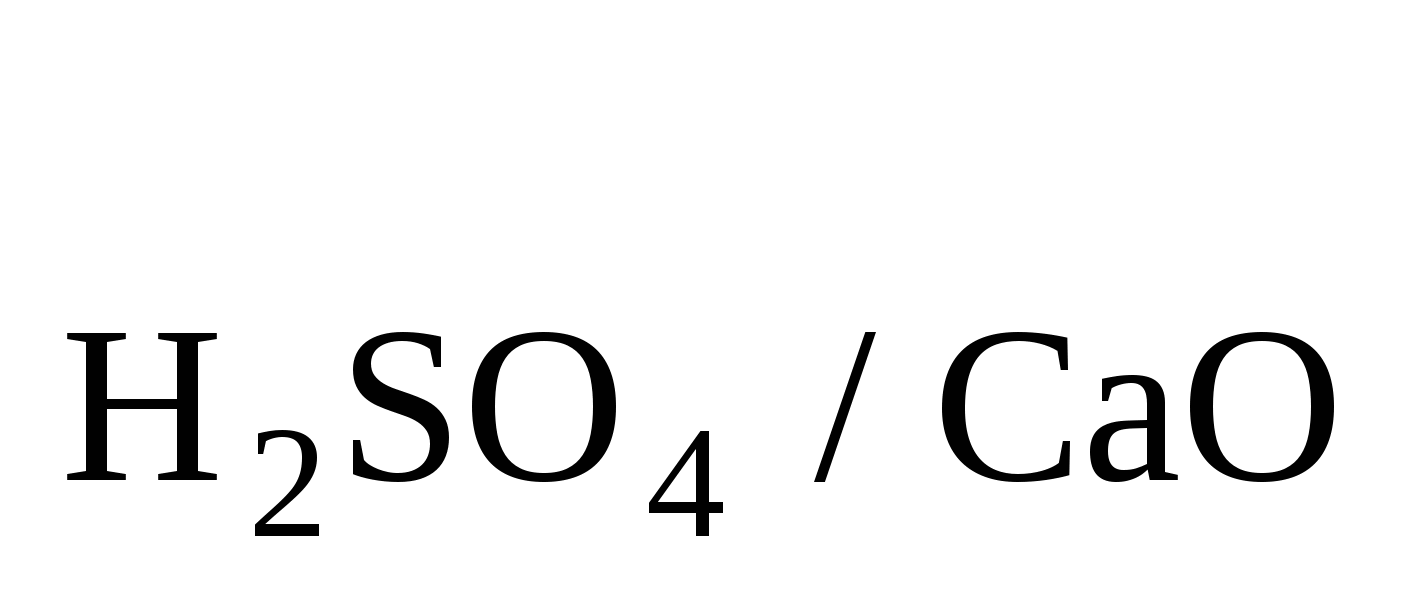 , если T , если T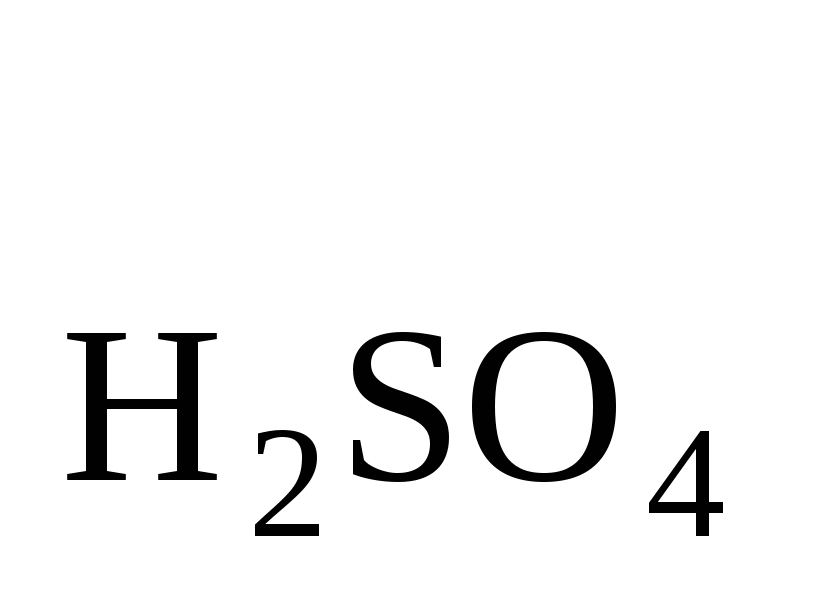 =0,004852.Ответ: 0,09895н.; 0,049470 г/мл. =0,004852.Ответ: 0,09895н.; 0,049470 г/мл.
Вычислить истинную нормальность, молярность, T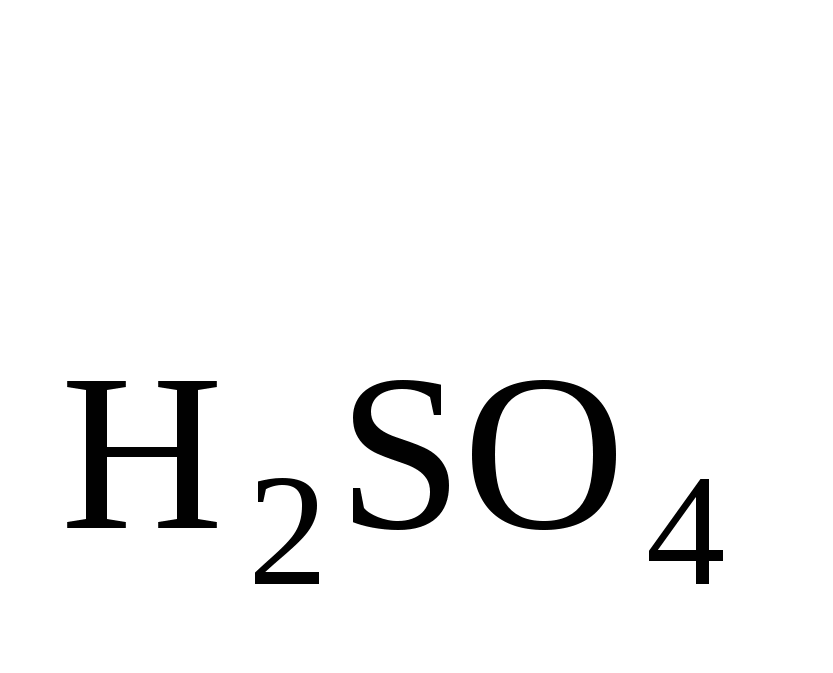 и T и T 0,1 Н H2SO4 (К=0,9808). Ответ: 0,04914 оль/л; 0,04810г/мл; 0,03923 г/мл. 0,1 Н H2SO4 (К=0,9808). Ответ: 0,04914 оль/л; 0,04810г/мл; 0,03923 г/мл.
В воде растворили 28,00г х.ч. КОН и 40,20г х.ч. NaOH и разбавили раствор до 1500 мл. Рассчитать нормальность полученного раствора. Ответ:1,0028 Н
К 550 л 0,1925 н. HCl прибавили 50,00 мл раствора HCl c титром 0,02370. Вычислить нормальность и титр полученного раствора. Ответ: 0,2307 моль/л; 0,008410 г/л.
Сколько миллилитров воды надо добавить к 1л 0,5300 н. HCl, чтобы получить 0,5000 Н раствор? Ответ:60 мл.
Навеску стали массой 1,0000 г растворили в кислотах, содержащийся в стали хром окислили до Cr2O72- и к полученному раствору добавилди 15,00 мл 0,2500 М раствора соли Мора. Избыток соли Мора оттитровали 0,1000 М раствором перманганата калия (f экв =1/5 KMnO4), израсходовав 25,00 мл. Рассчитайте массовую долю (%) хрома в стали. Ответ: 2,08%.
Навеску мрамора массой 0,2834 г растворили в 30,00 мл 0,3933 М раствора HCl. На титрование избытка кислоты пошло 14,10 мл 0,4400 М раствора NaOH. Найдите массовую долю примесей в образце. Ответ: 1,19%.
Сколько миллилитров H2SO4 (fэкв =1/2) плотностью 1,835 г/см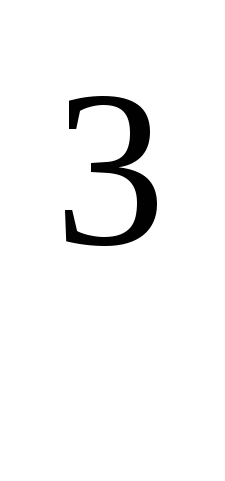 требуется для приготовления 2,5 л 0,2 н раствора? Ответ:27,9 мл. требуется для приготовления 2,5 л 0,2 н раствора? Ответ:27,9 мл.
Для приготовления 500,00 мл раствора было взято 20,00 мл HCl плотностью 1,19 г/см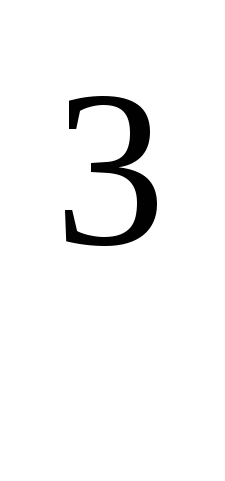 . Вычислить нормальность полученного раствора? Ответ: 0,5 н. . Вычислить нормальность полученного раствора? Ответ: 0,5 н.
Вычислить нормальность и титр раствора HCl, если на титрование 0,4217 г буры израсходовано 17,50 мл этой кислоты? Ответ: 0,1263 н.; 0,004610г/мл.
Какую навеску х.ч. безводной соды нужно взять, чтобы на её титрование израсходовать 20,00 мл 0,1М H2SO4? Ответ: 0,21 г.
Какую навеску щавелевой кислоты Н2С2О4·2Н2О нужно взять, чтобы на её титрование израсходовать 20,00 мл 0,1н. NaOH? Ответ: 0,1259 г.
Навеску 0,6000 г Н2С2О4·2Н2О растворили в мерной колбе емкостью 100 мл на титрование 20,00 мл полученного раствора израсходовано 18,34 мл NaOH. Определить молярную концентрацию раствора NaOH и его титр по Н2С2О4. Ответ: 0,1038; 0,004673 г/мл
Вычислить нормальность раствора HCl, если на титрование 20,00 мл его израсходовано 19,20 мл 0,1 н. NaOH, приготовленного из фиксанала. Ответ: 0,0960 н.
Навеску 0,5341 г щелочи, содержащей 92% NaOH и 8% индифферентных примесей, растворили в мерной колбе емкостью 100 мл. Определить нормальность и титр HCl, T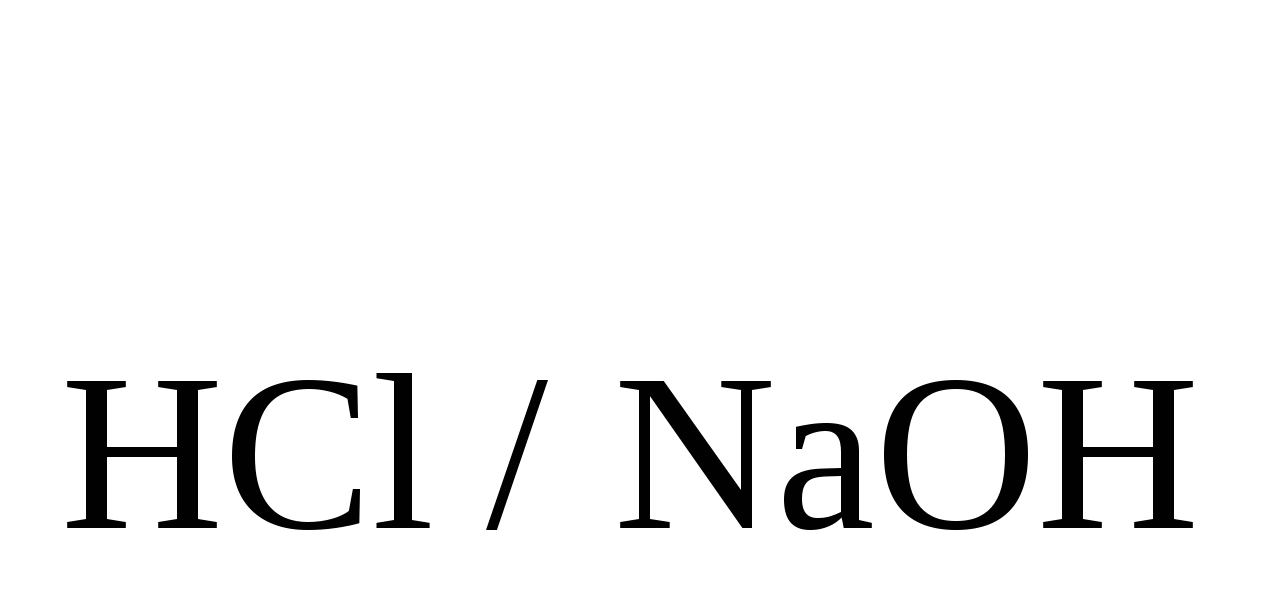 , если на титрование 15 мл раствора NaOH израсходовано 19,50 мл кислоты. Ответ: 0,09448 н.; 0,003447 г/мл; 0,003778 г/мл. , если на титрование 15 мл раствора NaOH израсходовано 19,50 мл кислоты. Ответ: 0,09448 н.; 0,003447 г/мл; 0,003778 г/мл.
Определить нормальность раствора КОН, если на титрование 15 мл его израсходовано 18,70 мл раствора HCl (T =0,002864). Ответ: 0,09792 н. =0,002864). Ответ: 0,09792 н.
До какого объема нужно довести раствор, в котором содержится 1,530 г NaOH, чтобы на титрование 20,00 мл раствора израсходовать 14,70 мл HCl (T =0,00380). Ответ: 499,32 мл. =0,00380). Ответ: 499,32 мл.
Рассчитать индикаторную ошибку титрования 0,01 н. HCl 0,01 н. раствором NaOH с фенолфталеином (pТ=9). Ответ: 0,2%.
Можно ли титровать 0,91 н. HCl 0,01Н раствором NaOH с бромфеноловым синим (рТ=3,8). Ответ:1·10-9 %.
Чему равна индикаторная ошибка 0,1 н. NaOH 0,1 н. раствором HCl метиловым красным (рТ=5). Ответ: 0,02%.
Рассчитать индикаторную ошибку 0,1н. NaOH 0,1 н. раствором HCl с тимолфталеином (рТ=10). Ответ: 1,7·10-3%
Вычислить индикаторную ошибку титрования 0,2 н. HCl 0,2 н. раствором NaOH с метиловым красным (рТ=5). Ответ:- 0,01%.
Вычислить индикаторную ошибку титрования 0,1 н. HCl 0,2 н. раствором NaOH с метиловым красным (рТ=5). Ответ:- 0,015%.
Можно ли точно оттитровать 0,2 н. HCl 0,2 н. раствором NaOH с крезолфталеином (рТ=9). Ответ:0,01%; да.
Рассчитать индикаторную ошибку титрования 0,01 н. раствора NH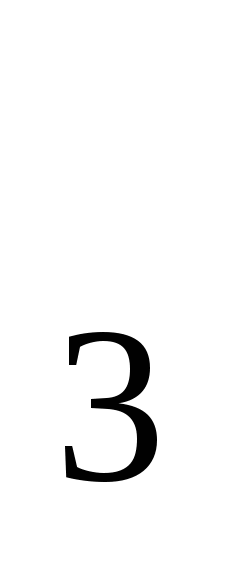 0,01 н. раствором HCl с метиловым оранжевым (рТ=4) Ответ: 2%. 0,01 н. раствором HCl с метиловым оранжевым (рТ=4) Ответ: 2%.
Можно ли оттитровать 0,01 н. NH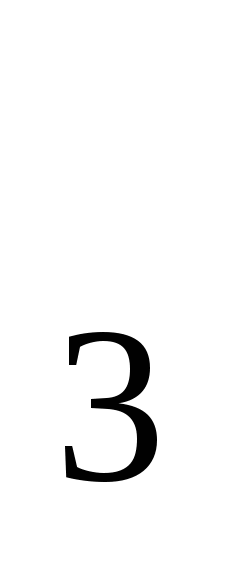 0,01 н. раствором HCl с фенолфталеином (рТ=9). Ответ: -36,31%; нет. 0,01 н. раствором HCl с фенолфталеином (рТ=9). Ответ: -36,31%; нет.
Какую навеску NaOH нужно взять, чтобы на титрование израсходовать 22,00 мл раствора HCl (T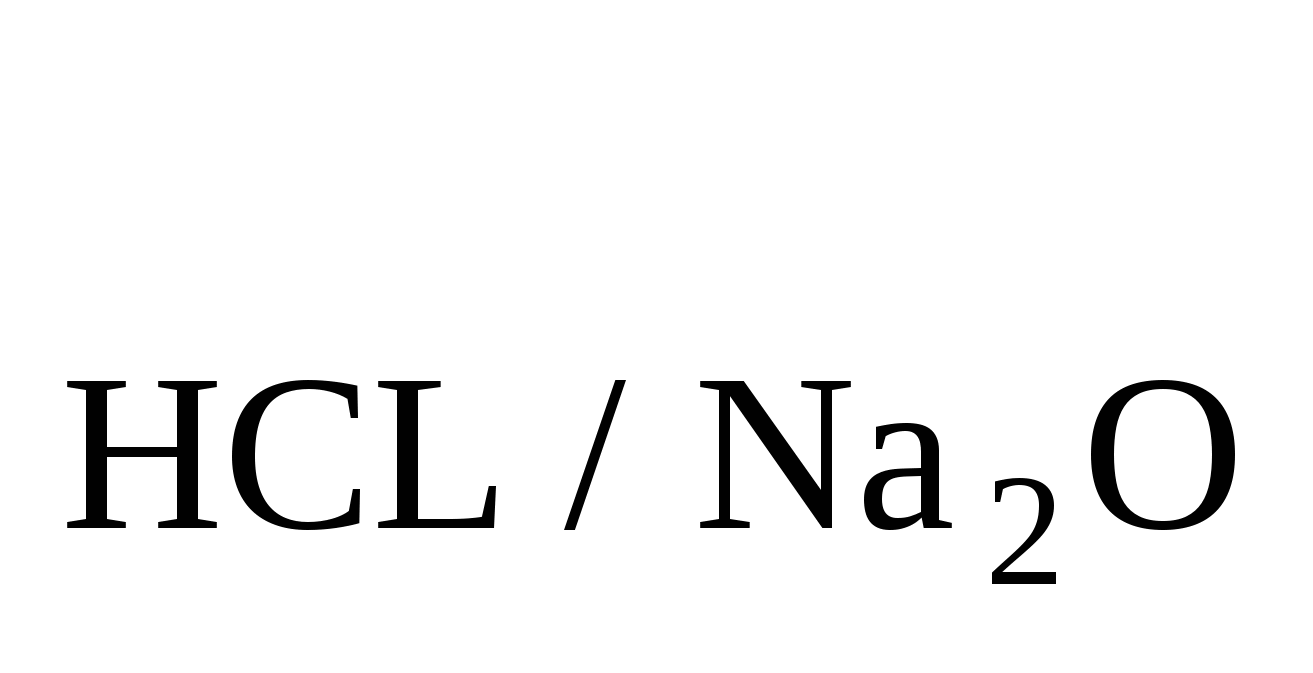 =0,003514). Ответ: 0,009978 г. =0,003514). Ответ: 0,009978 г.
Навеску 2,0712 г технической буры растворили в мерной колбе ёмкостью 100,00 мл. На титрование 20,00 мл раствора израсходовано 21,80 мл HCl (T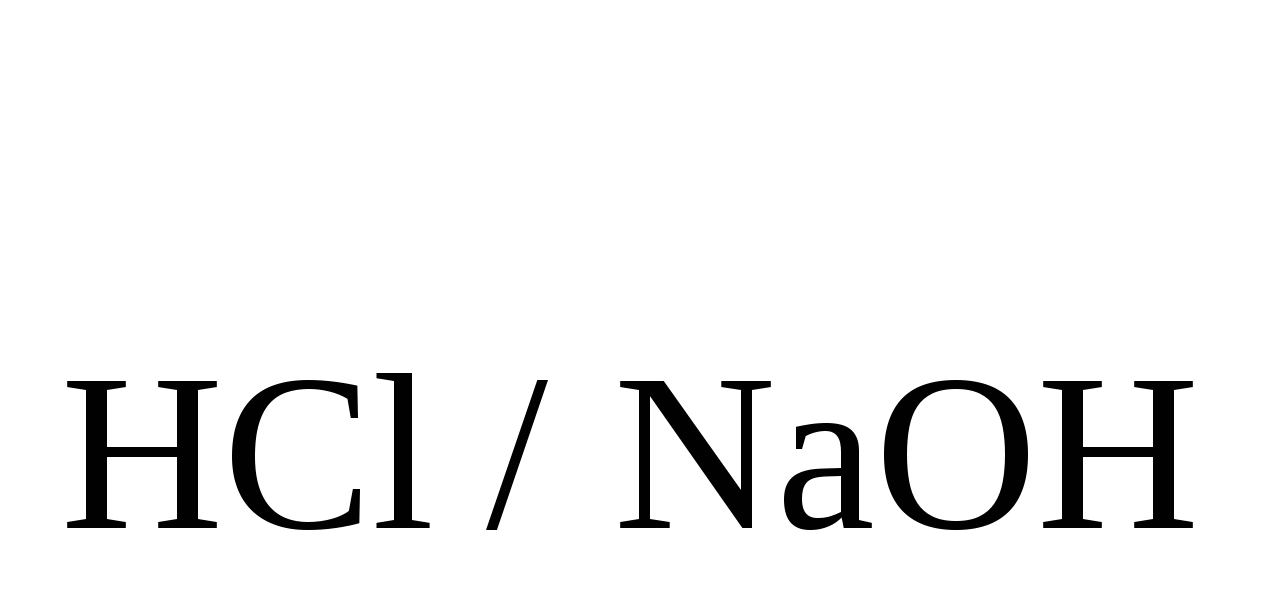 =0,003974). Вычислить процентное содержание х.ч. Na =0,003974). Вычислить процентное содержание х.ч. Na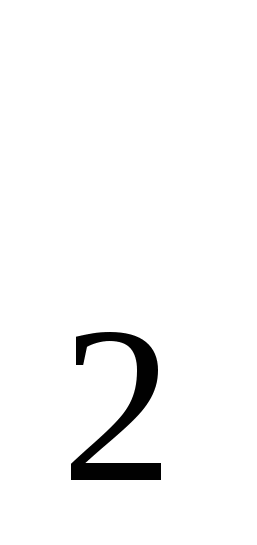 B B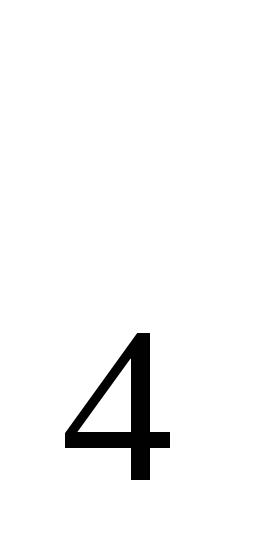 O O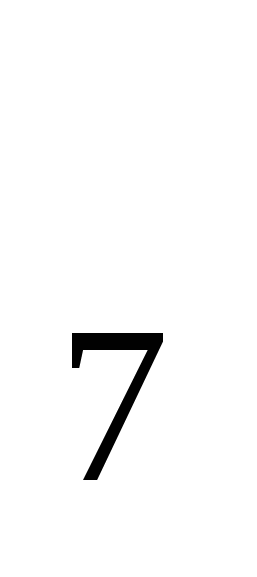 · 10 H · 10 H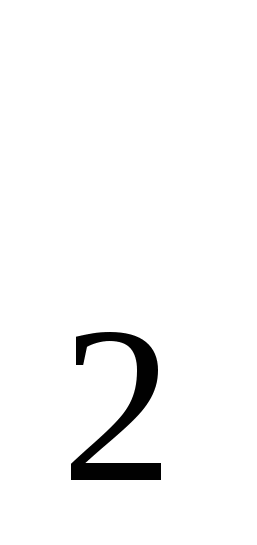 O. Ответ: 99,76 %. O. Ответ: 99,76 %.
На титрование раствора, содержащего 3,1580 г технического КОН, израсходовано 27,45 мл раствора HCl (T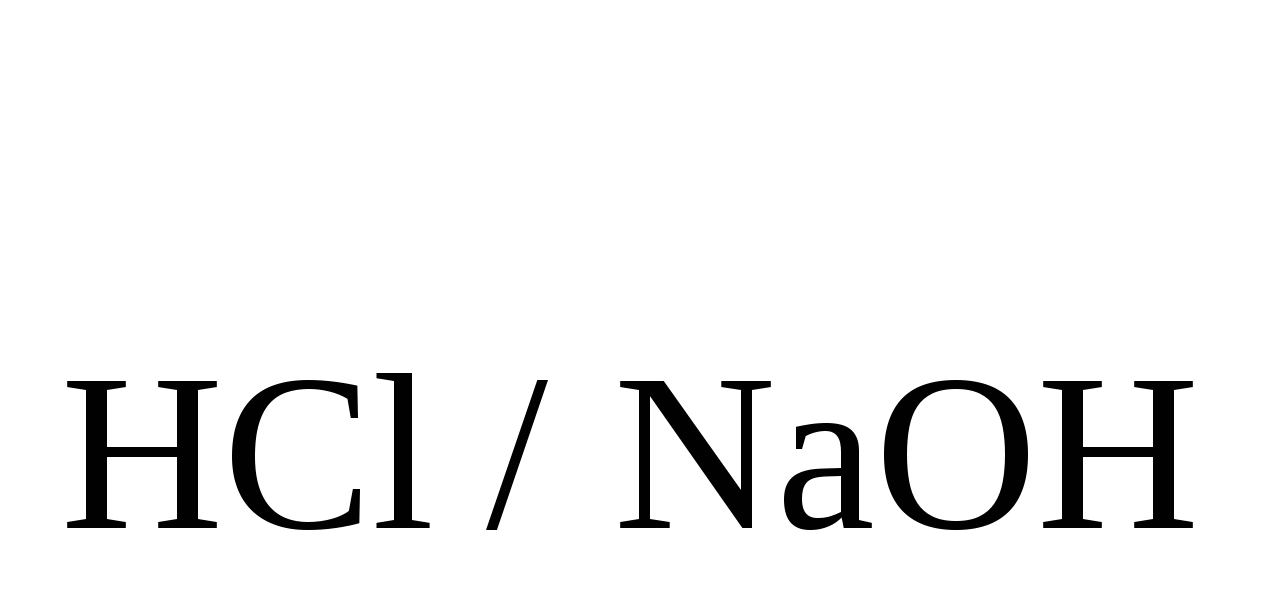 =0,07862). Вычислить процентное содержание КОН в образце. Ответ: 95,87%. =0,07862). Вычислить процентное содержание КОН в образце. Ответ: 95,87%.
Навеску 2,000 г неизвестного растворили в мерной колбе ёмкостью 100,00 мл. На титрование 25,00 мл раствора израсходовано 20,00 мл 0,4455 н. HCl. Определить что входило в состав анализируемого вещества: КОН или NaOH. Ответ: КОН.
Навеску 0,3251 г технической гидроокиси натрия растворили в мерной колбе ёмкостью 100,00 мл. На титрование 25,00 мл раствора фенолфталеином израсходовано 18,40 мл 0,1000 н. HCl, метиловым оранжевым 18,80 мл кислоты. Вычислить процентное содержание NaOH в образце. Ответ: 88,58%.
Ионы серебра, содержащиеся в 25,00 мл пробы, связали в цианидный комплекс, добавив избыток раствора Ni(CN)4 2- .На титрование выделившихся ионов никеля израсходовали 43,70 мл 0,0240 М раствора ЭДТА. Рассчитайте концентрацию (г/л) серебра в растворе пробы. Мол. масса (Ag) 107.86. Ответ: 9,05 г/л.
В каком объёме соляной кислоты HCl (T =0,003814) нужно растворить навеску 0,1234 г CaCO =0,003814) нужно растворить навеску 0,1234 г CaCO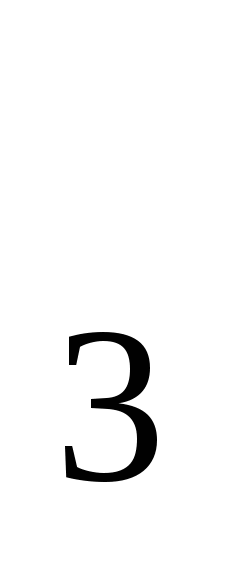 , чтобы на титрование избытка кислоты израсходовать 19,50мл раствора NaOH (T , чтобы на титрование избытка кислоты израсходовать 19,50мл раствора NaOH (T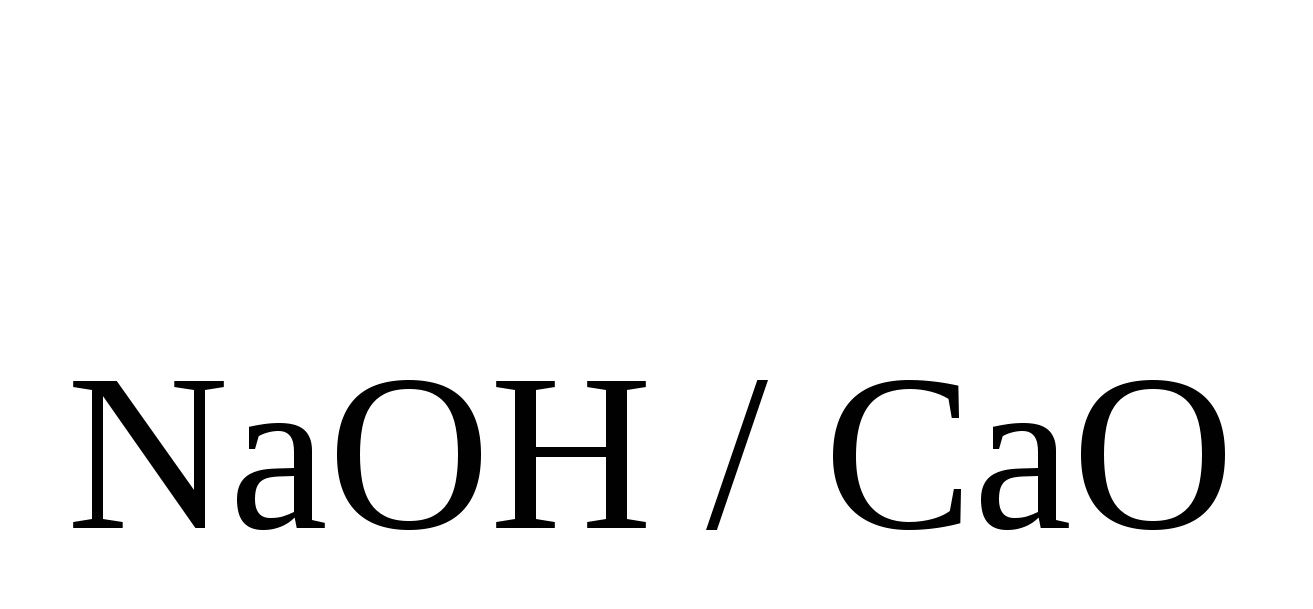 =0,002910)? Ответ: 42,99 мл =0,002910)? Ответ: 42,99 мл
После подкисления серной кислотой монохлоруксусную кислоту ClCH2COOH из 150,0 мл фруктового сока проэкстрагировалидиэтиловым эфиром. Кислоту затем реэкстрагтровали NaOH. После подкисления к полученному раствору добавили 40,00 мл 0,0489 М раствора AgNO3. Избыток AgNO3 оттитровали 0,0515 М раствором NH4SCN, израсходовав 18,70 мл. Рассчитайте содержание в мг ClCH2COOH (мол. масса 94,45) в 500,0 мл фруктового сока. Ответ: 312,6 мг.
К 0,5000 г смеси содержащей Na2CO3 и NaHCO3, прибавили 25,00 мл раствора HCl (T =0,004000). На титрование избытка кислоты израсходовали 15,00 мл раствора NaOH (T =0,004000). На титрование избытка кислоты израсходовали 15,00 мл раствора NaOH (T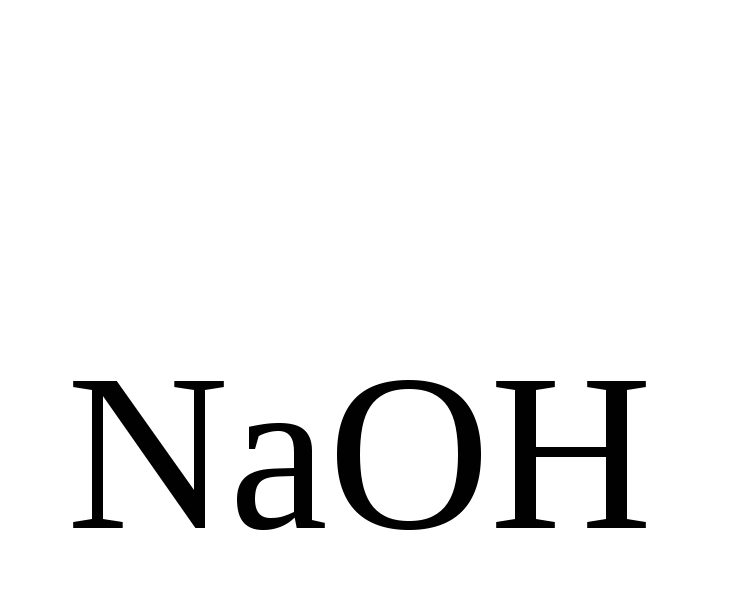 =0,002000). Вычислить процентное содержание Na2CO3. Ответ: 21,14%. =0,002000). Вычислить процентное содержание Na2CO3. Ответ: 21,14%.
К 25 мл раствора Н2S прибавили 50,00 мл 0,01960 н. раствора J2 (fэкв=1/2) и избыток иода оттитровали 11,00 мл 0,02040 н. Na2S2O3 (fэкв=1). Вычислить концентрацию(г/л) Н2S в растворе. Ответ: 0,5150 г/л.
Исследуемый раствор, в котором требуется определить кобальт в присутствии никеля, обработали уксусной кислотой и KNO2. Выпавший осадок K3Co(NO2)6 отфильтровали, промыли и растворили в 50,00 мл 0,09950 н. раствора KMnO4 (f экв= 1/5). Затем прибавили 20,00 мл 0,1040 н. раствора FeSO4, остаток которого оттитровали 11,65 мл 0,009950 н. KMnO4 (f экв= 1/5).Написать уравнение реакции растворения осадка и вычислить массу кобальта в первоначальном растворе. Ответ: 0,0217 г.
Навеску 5,0000 г пергидроля растворили в мерной колбе ёмкостью 5,00 мл. На титрование 25,00 мл раствора израсходовано 37,43 мл 0,1 н. KMnO4 (fэкв = 1/5, К=1,1240). Вычислить процентное содержание H2O2 в образце. Ответ: 28,59%.
Навеску образца 1,000 г содержащего 99,98% Fe, растворили в H2SO4, без доступа воздуха и оттитровали 0,1000Н KMnO4 (fэкв = 1/5). Сколько мл KMnO4 израсходовано на титрование? Ответ: 17,90 мл.
Навеску образца, содержащего фенобарбиталат натрия, массой 0,2438 г растворили при нагревании в растворе NaOH. После подкисления уксусной кислотой для количественного осаждения фенобарбиталата ввели 25,00 мл 0,0203 М раствора Hg(ClO4)2. Осадок отфильтровали, фильтрат разбавили до 250,0 мл. К 50,00 мл фильтрата добавили избыток раствора MgY2-. Выделившиеся по реакции Hg2+ + MgY2- = Mg2+ + Hg2- ионы магния оттитровали при рН 10,0 0,0121 М раствором ЭДТА, израсходовав 5,89 мл. Рассчитайте массовую долю(%) азота(N) и NaC12H11N2O3 в образце. Мол. масса (N) 14.01; (NaC12H11N2O3 ) 253,99.Ответ: (N) 3,47(%); NaC12H11N2O3 31,4(%).
К 10 мл раствора NiCl2 добавили дистиллированную воду, аммиачный буферный раствор и 20,00 мл 0,01085 М раствора ЭДТА. Избыток ЭДТА оттитровали 0,01292 М MgCl2 ,на титрование израсходовали 5,47 мл. Рассчитать исходную концентрацию (г/л) раствора NiCl2 .Ответ: 1,897 г/л.
Какую навеску негашеной извести, содержащей 90% СаО и 10% индифферентных примесей, требуется взять для анализа, чтобы на нейтрализацию её шло 20,00 мл раствора HCl с титром 0,007300? Ответ: 0,201 г.
К раствору, полученному после растворения навески анализируемой пробы массой 0,1500 г, содержавшей галлий(III), добавили буферный раствор с рН 10,00 и избыток MgY2-. На титрование выделившегося Mg(II) c эриохромом черным Т израсходовали 5,91 мл 0,0701 М раствора ЭДТА. Рассчитайте массовую долю (%) галлия в навеске. Молекулярная масса галлия 69,72.Ответ: 19,25%
К 10,00 мл раствора, содержащего пиридин, добавили спиртовой раствор CdCl2. Выпавший осадок Cd(C5H5N)2Cl2 отфильтровали, растворили и оттитровали 15,25 мл 0,01 М раствора ЭДТА с эриохромом черным Т в аммиачном буферном растворе. Рассчитайте концентрацию (г/л) пиридина в исходном растворе. Молекулярная масса пиридина 79,00.Ответ: 2,41 г/л.
100.На нейтрализацию 0,2140 г смеси, состоящей из карбонатов кальция и бария израсходовали 15 мл 0,2 М раствора HCl. Вычислить массовые доли (%) СаСО3 и ВаСО3 в смеси. Ответ: 39,44% СаСО3 ; 60,56% ВаСО3
|
 Скачать 0.79 Mb.
Скачать 0.79 Mb.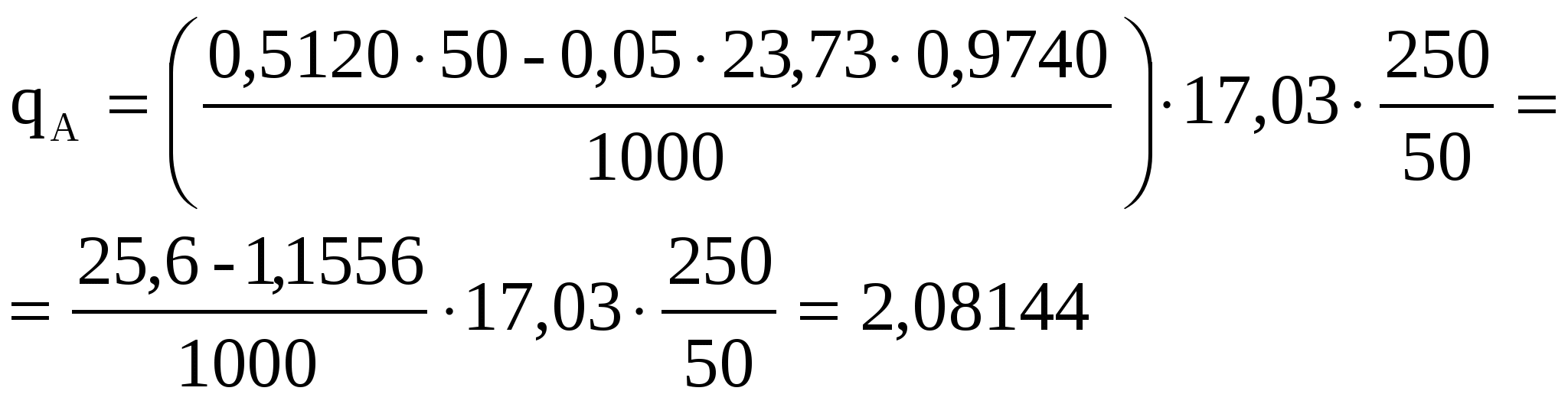
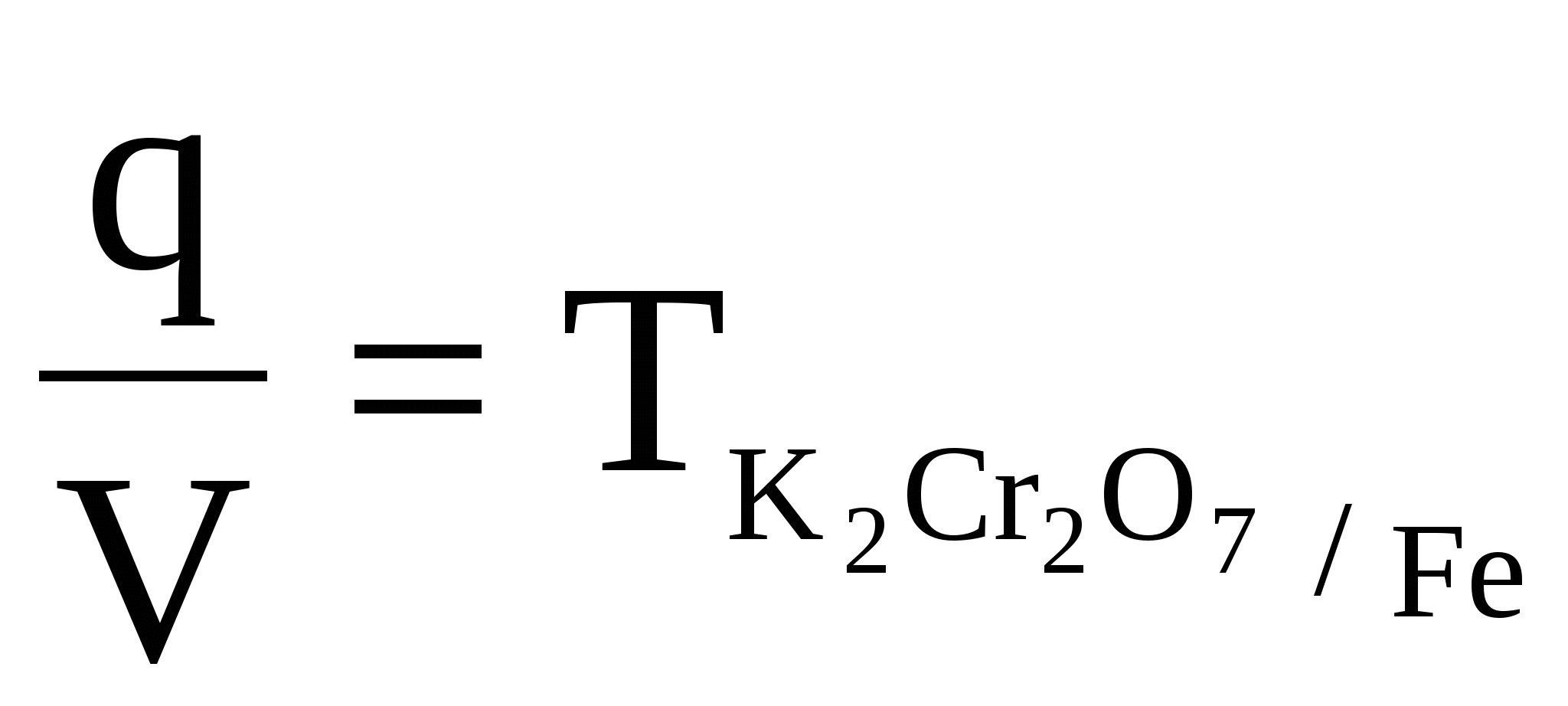
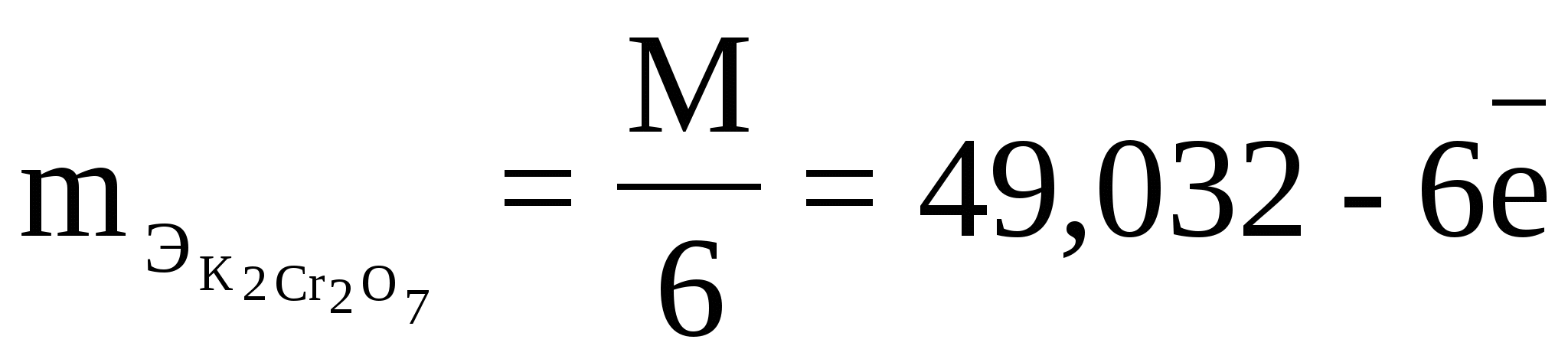 - два атома Cr по 3
- два атома Cr по 3