3 Расчет рН в растворах
3.1 Формулы для расчета рН в растворах
3.1.1 В растворе сильной кислоты рассчитать рН можно по формуле
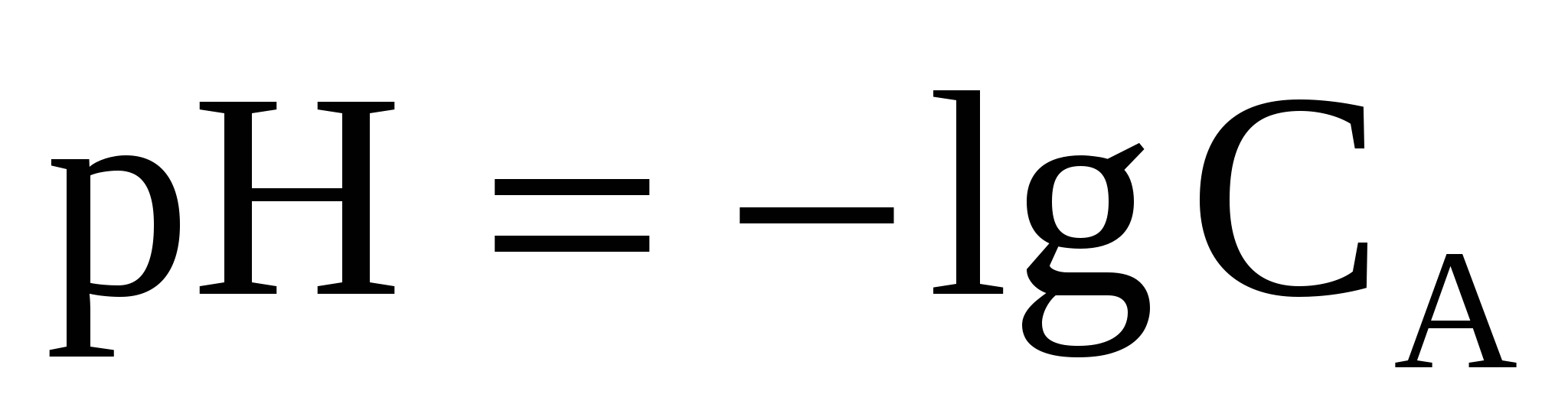 , (35) , (35)
где СА - концентрация кислоты.
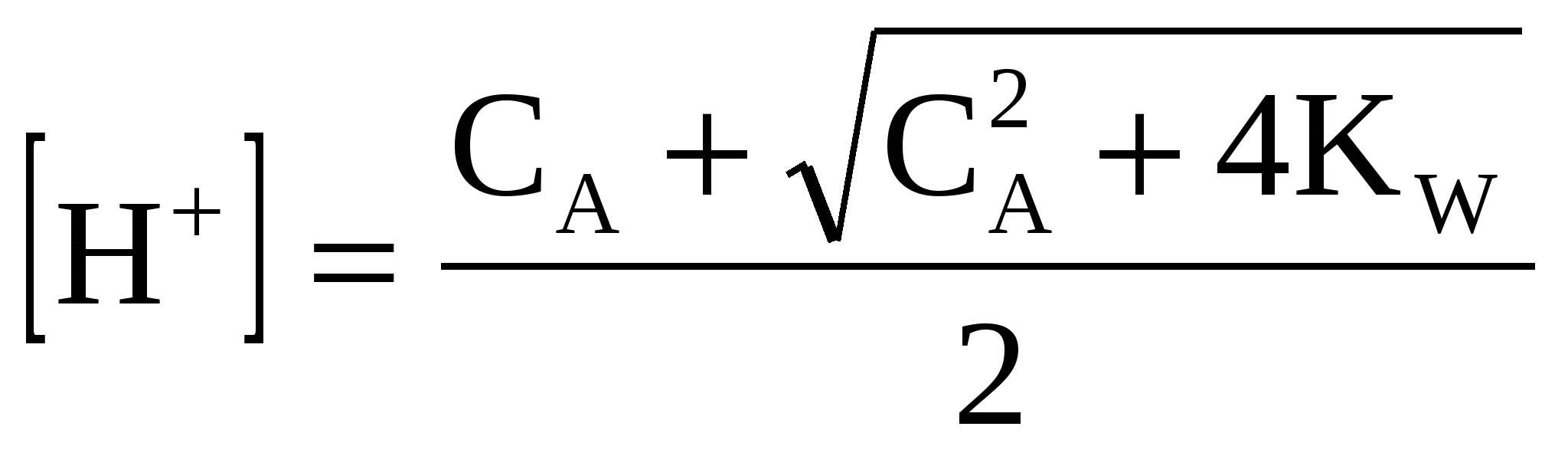 , (36) , (36)
где рКW - показатель константы ионизации воды справочные данные.
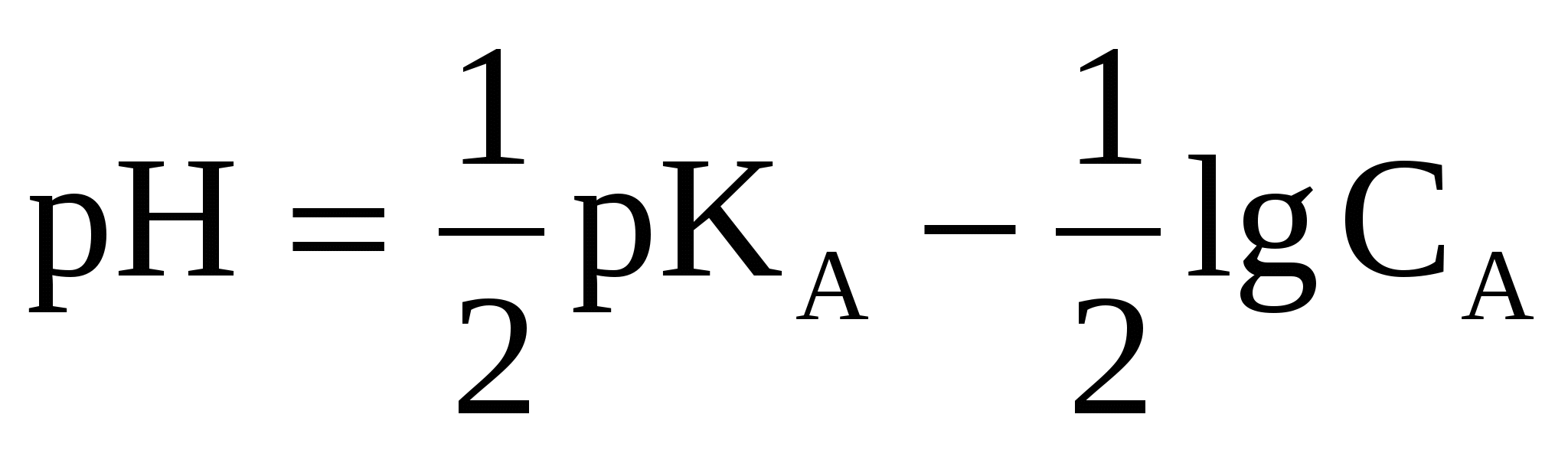 , (37) , (37)
где рКА - показатель константы ионизации кислоты справочные данные.
3.1.2 В растворе сильного основания рассчитать рН можно по формуле:
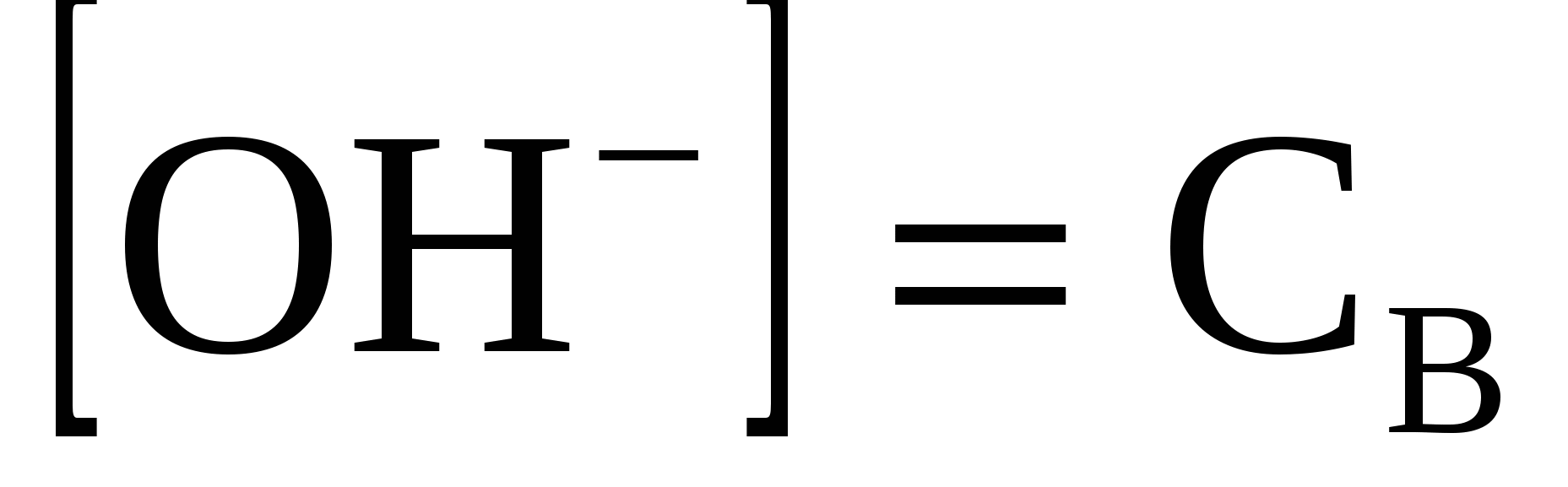 , (38) , (38)
где СВ - концентрация основания.
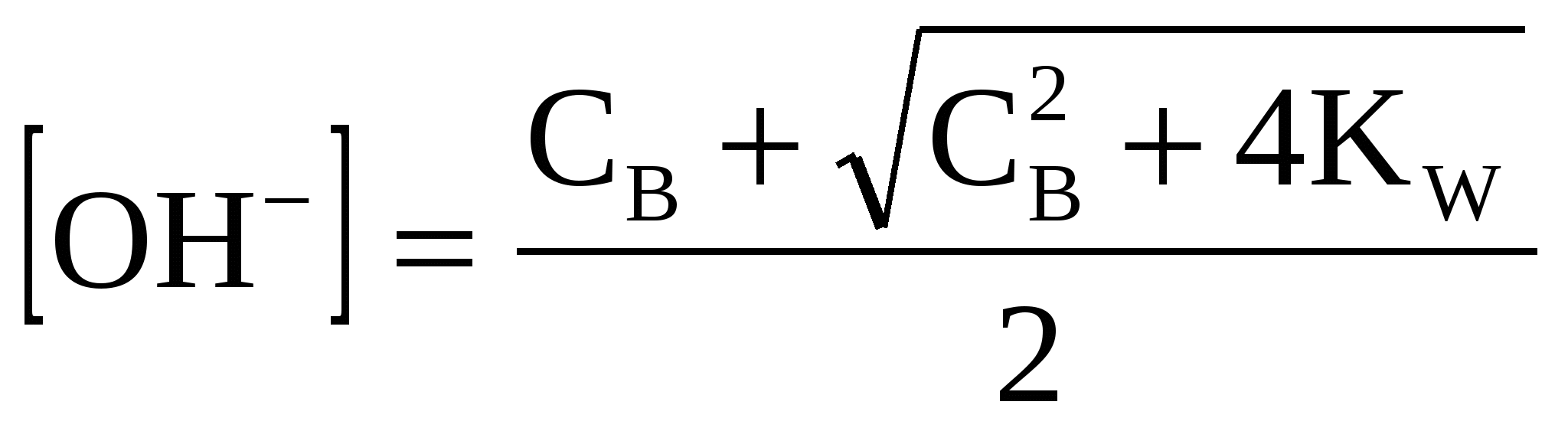 (39) (39)
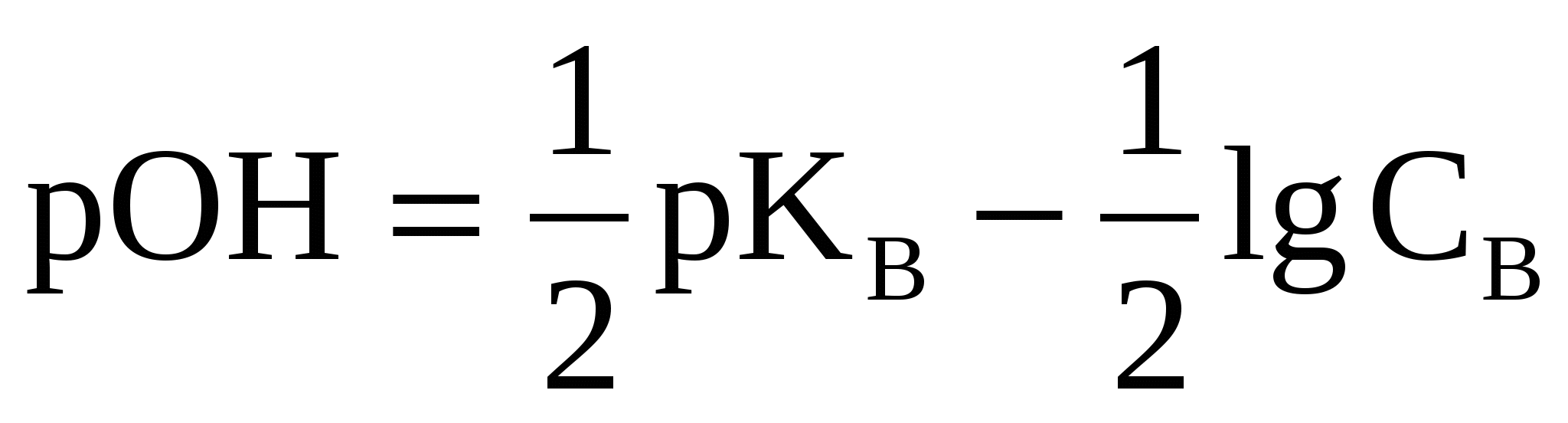 (40) (40)
3.2 Формулы для расчета рН в растворах гидролизующихся солей
3.2.1 Если даны соль слабой кислоты и сильного основания
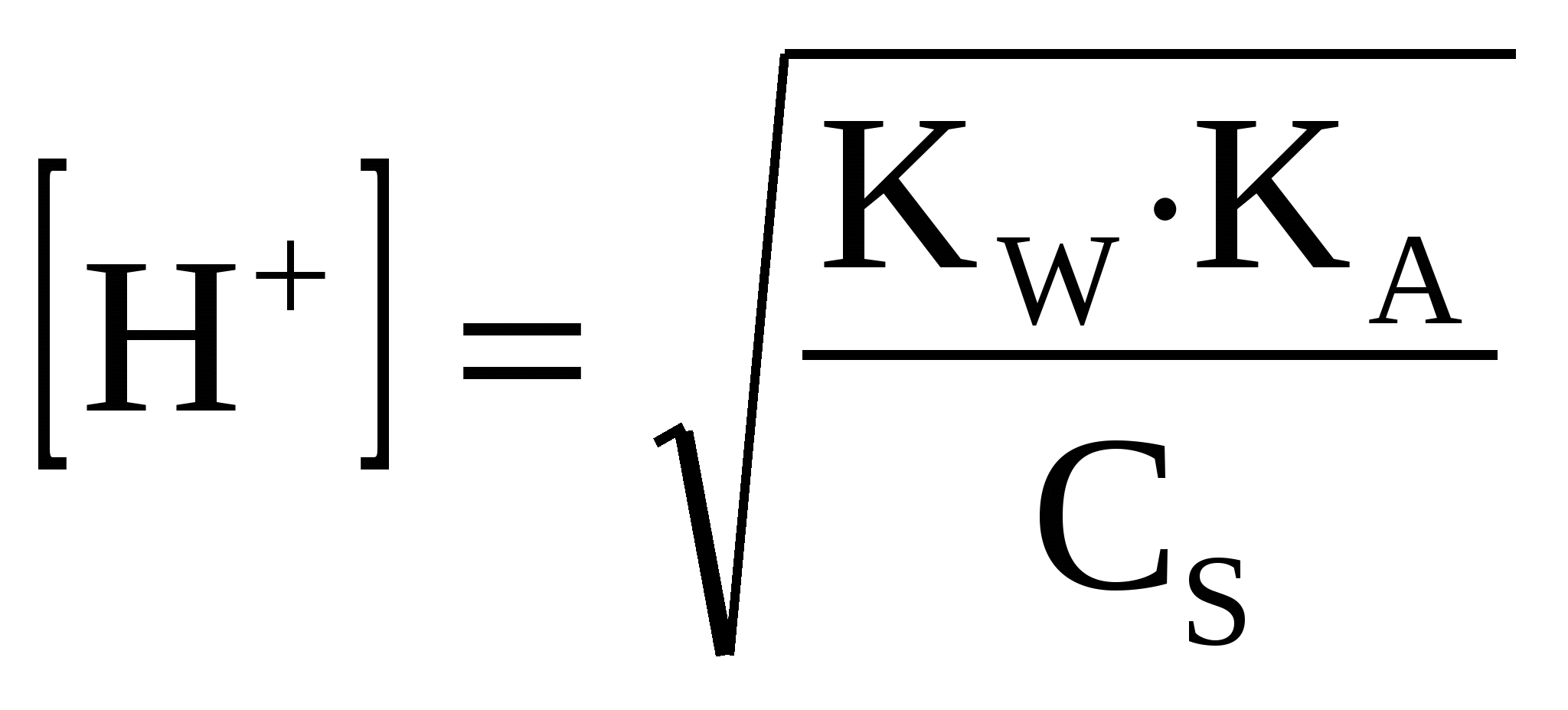 , (41) , (41)
где СS-концентрация соли.
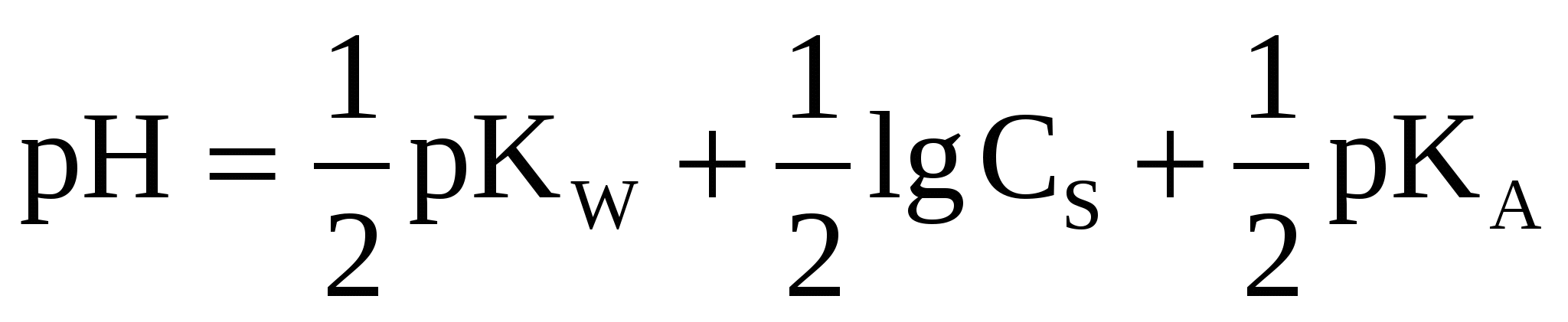 (42) (42)
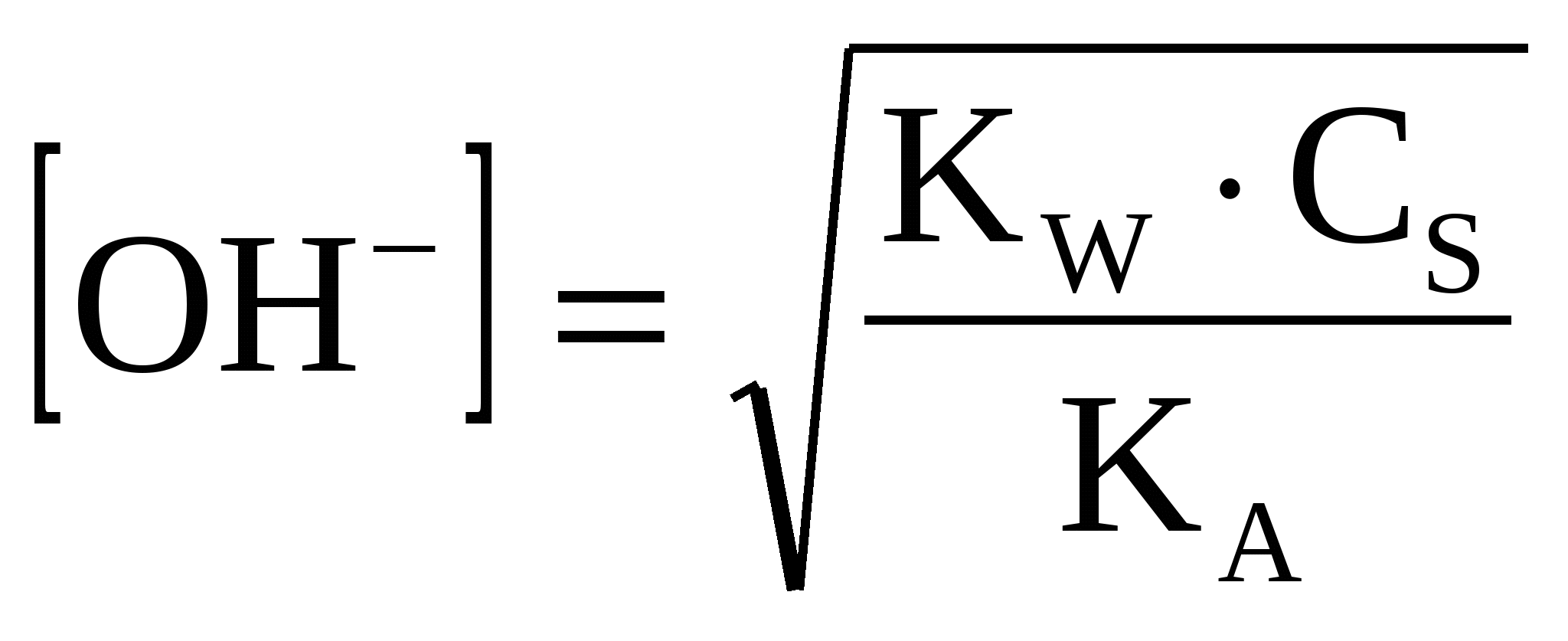 (43) (43)
3.2.2 Если даны соль сильной кислоты и слабого основания
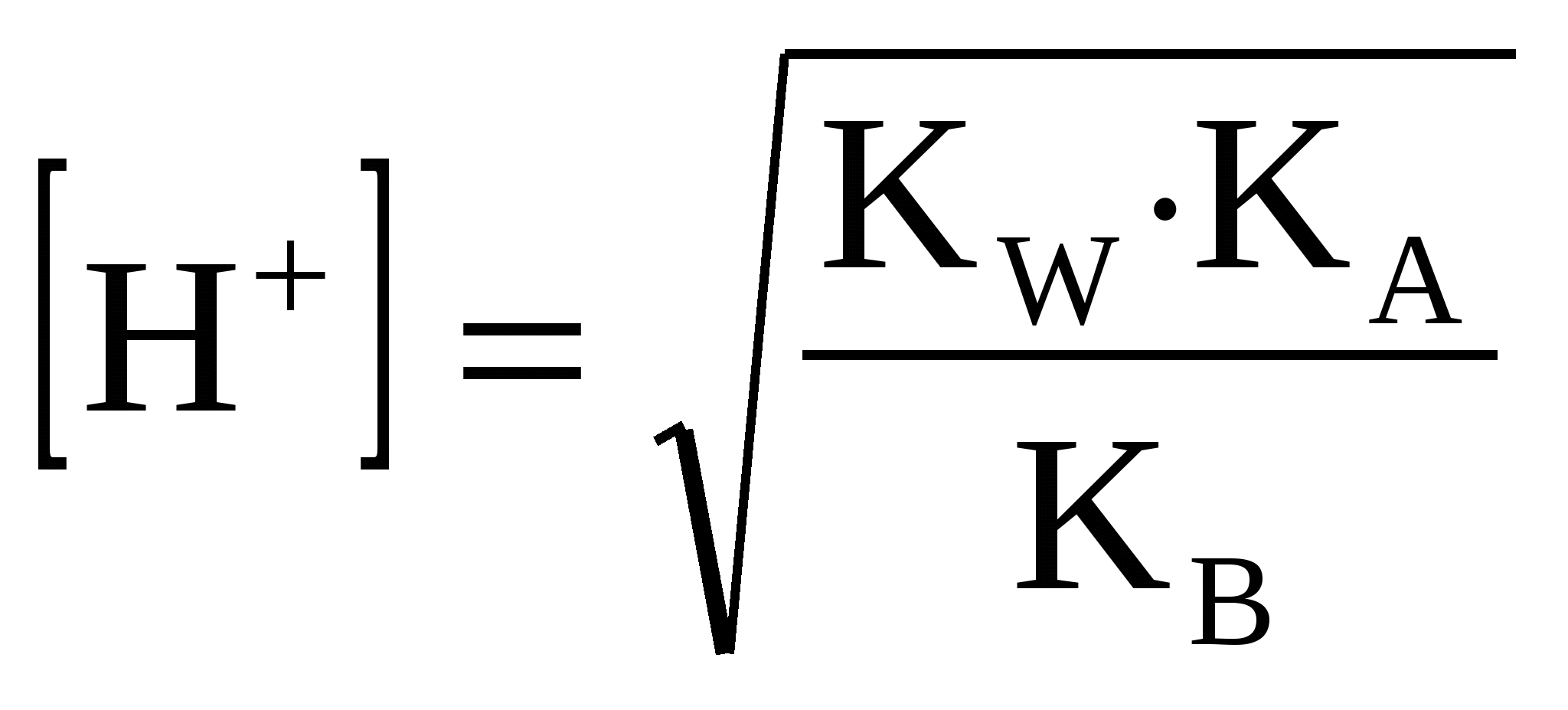 (44) (44)
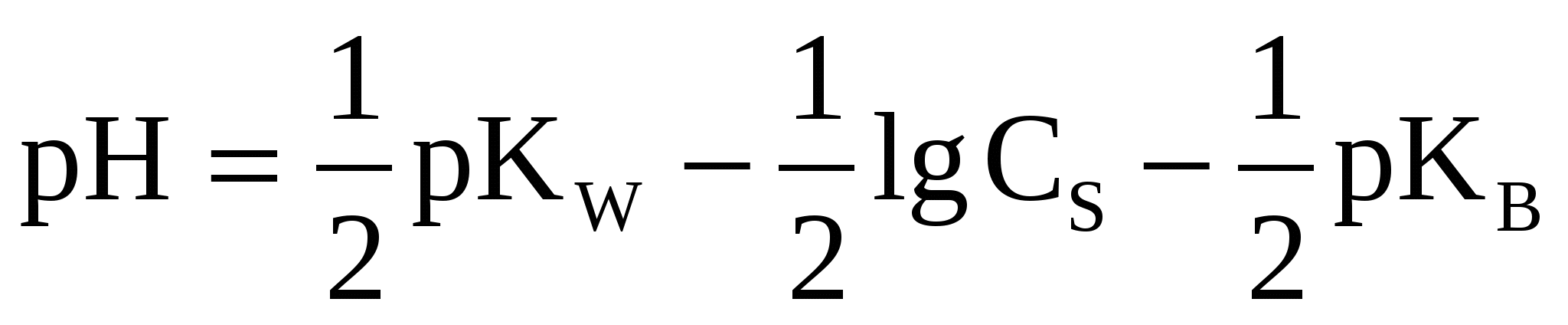 (45) (45)
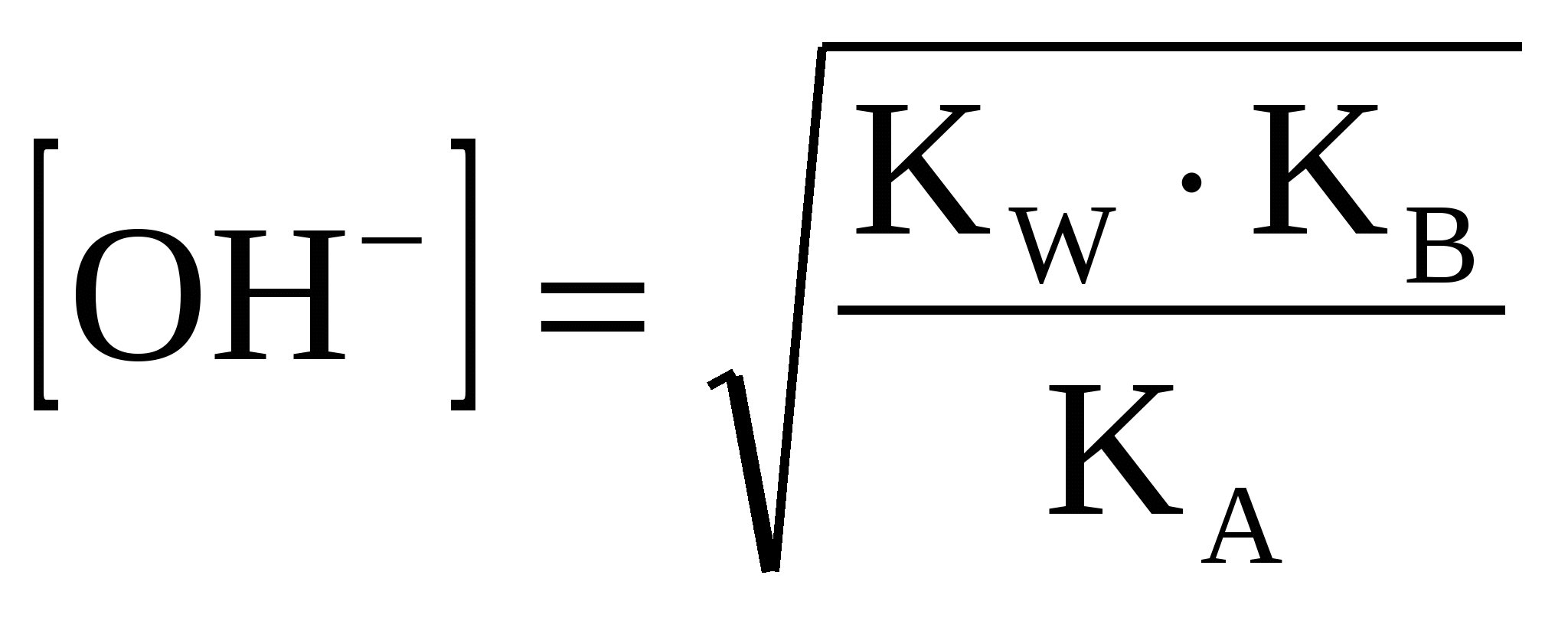 (46) (46)
3.2.3 Если даны соль слабой кислоты и слабого основания
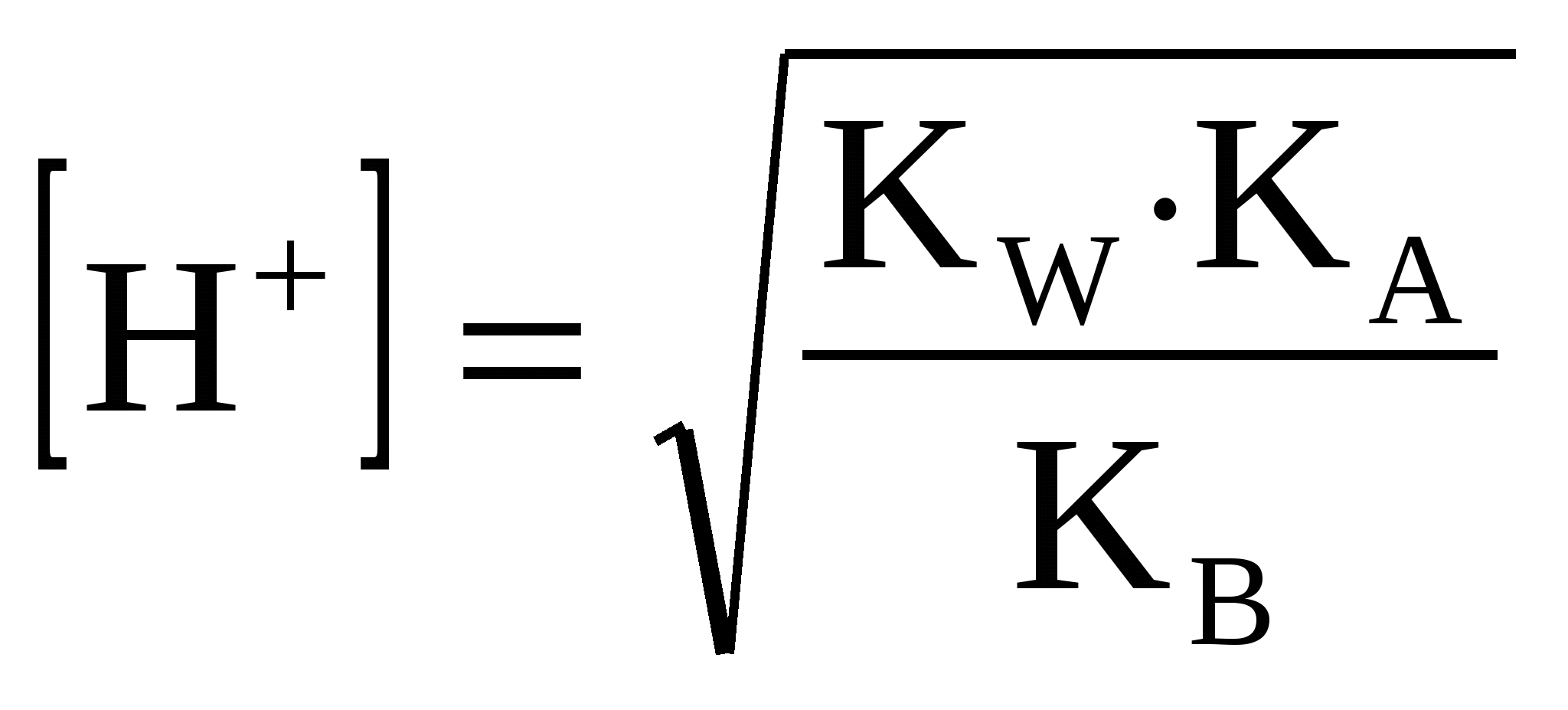 (47) (47)
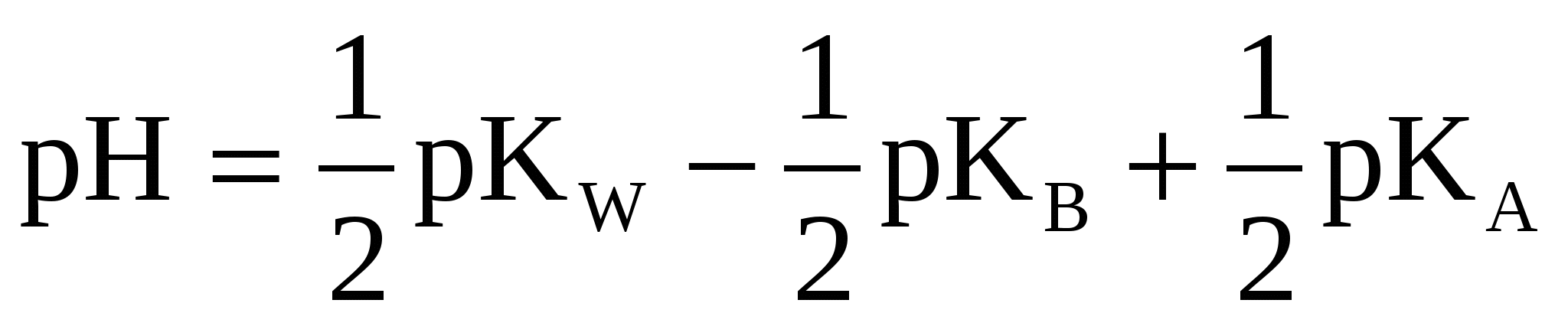 (48) (48)
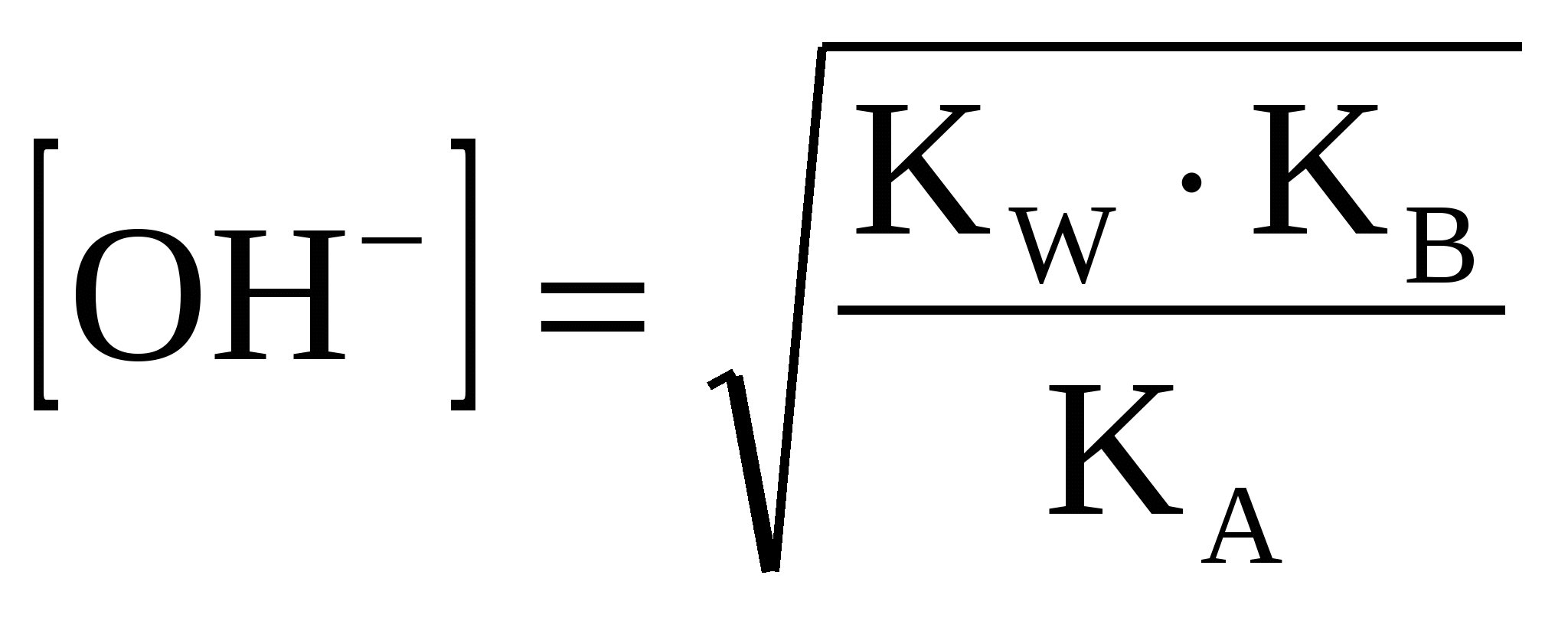 (49) (49)
3.3 Формулы для расчета рН в буферных растворах
3.3.1 Кислотные буферные системы
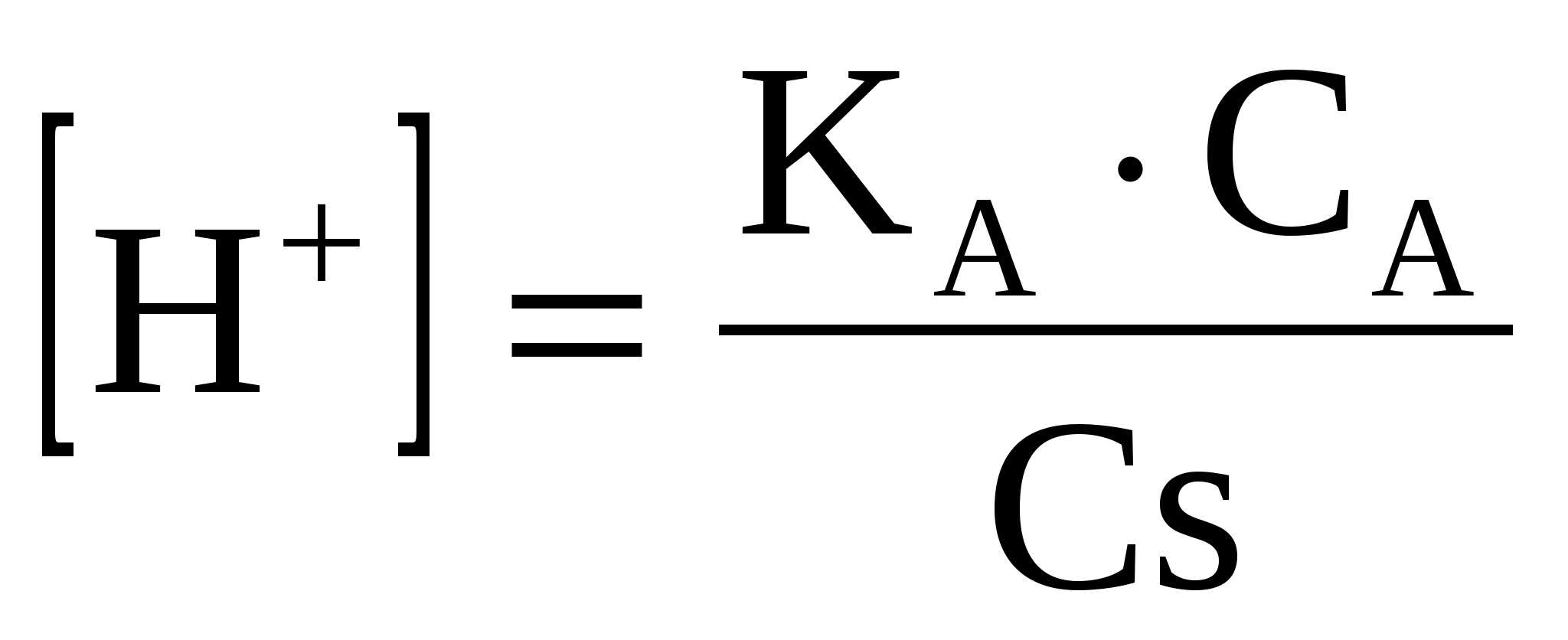 (50) (50)
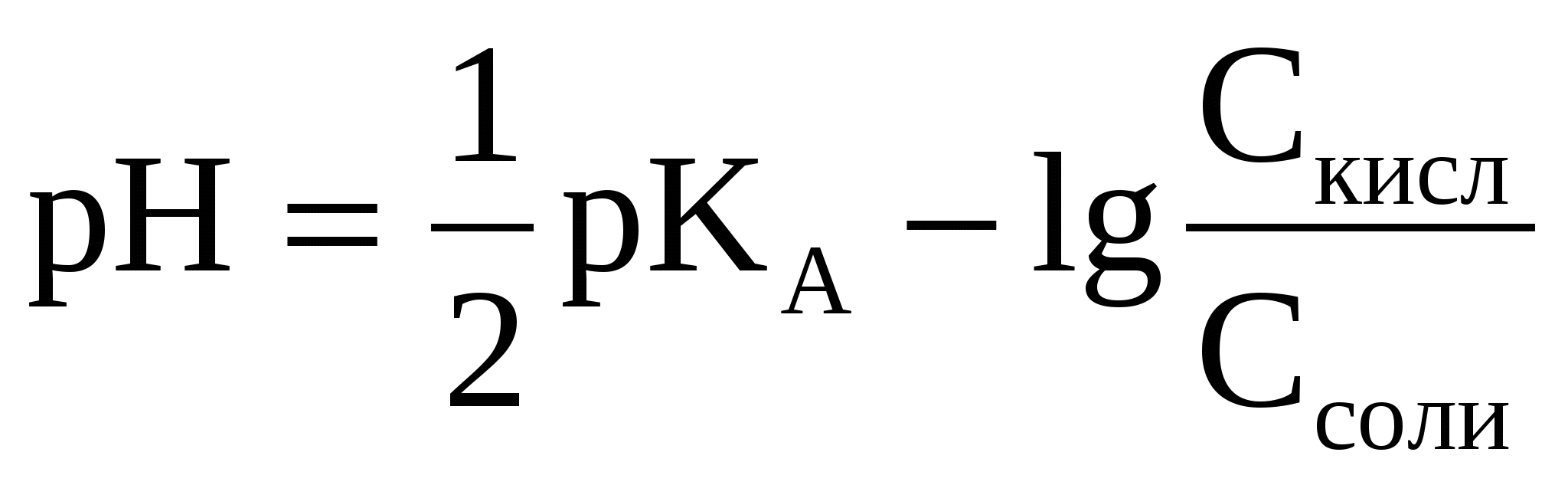 (51) (51)
3.3.2 Основные буферные системы
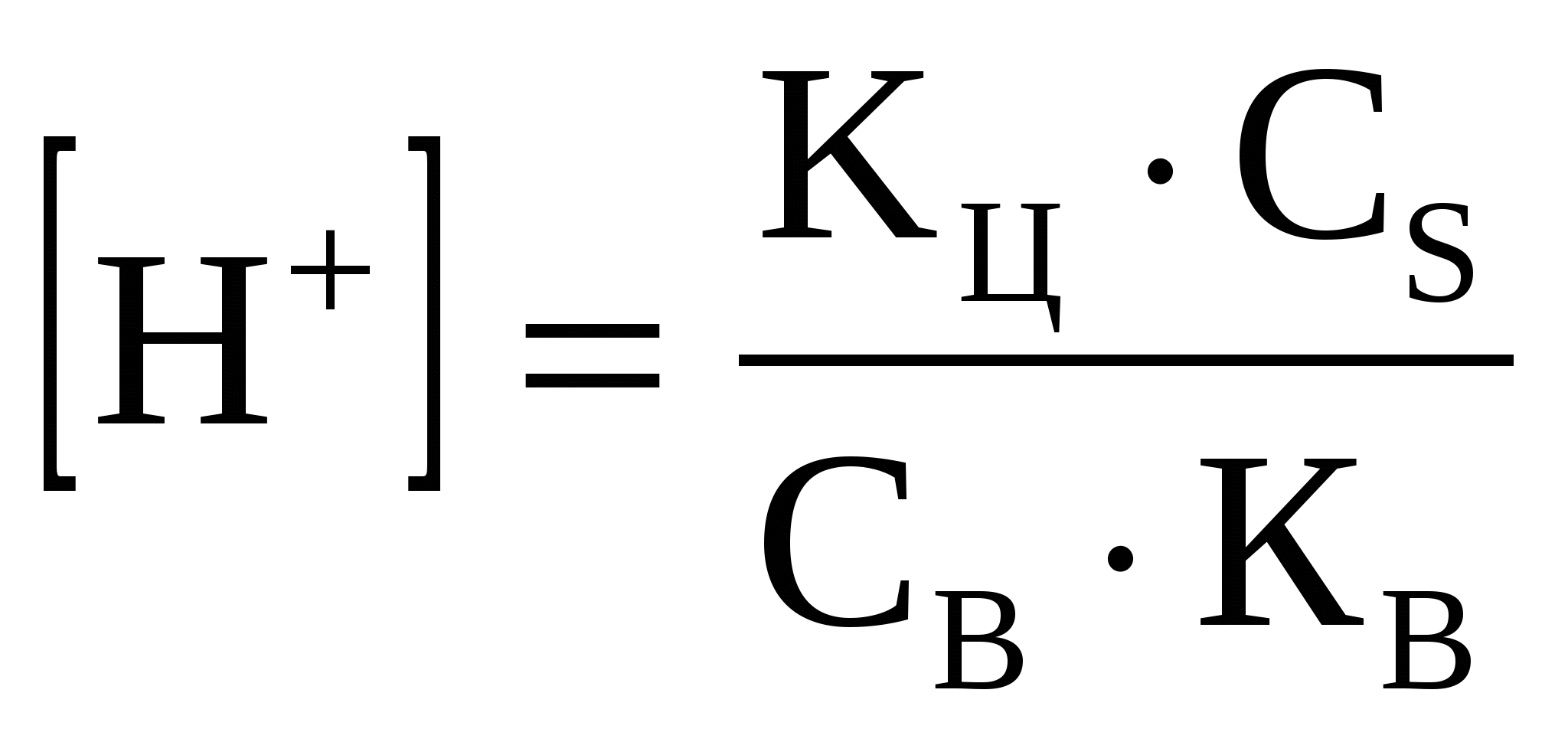 (52) (52)
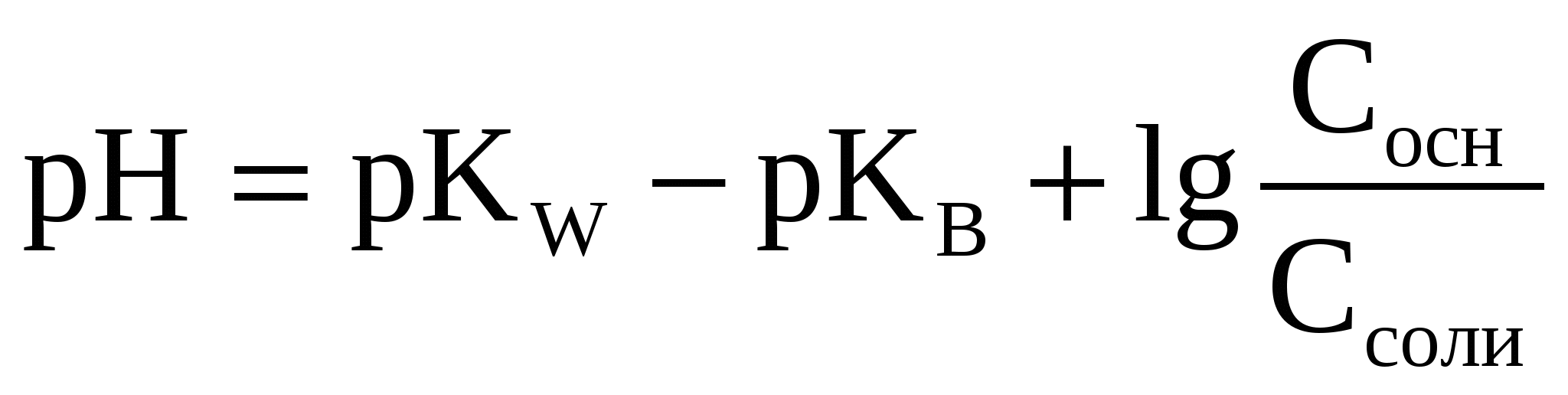 (53) (53)
Задачи для самостоятельного решения
Вычислить рН раствора NaOH,массовая доля 0,2%. Ответ:12,7
Вычислить рН раствора KOH,массовая доля 0,19%. Ответ:12,47
Вычислить рН раствора HCl,массовая доля 0,36%. Ответ:1,0
Вычислить рН раствора HNO3,массовая доля 0,32%. Ответ:1,3
Вычислить рН раствора H2SO4,массовая доля 0,4%. Ответ:1,1
Вычислить рН раствора NaOH, если плотность раствора ρ ═ 1,002. Ответ:12,95
Вычислить рН раствора КOH,если плотность раствора ρ ═ 1,004. Ответ:13,0
Вычислить рН раствораHCl, если плотность раствора ρ ═ 1,000. Ответ.1,0
Вычислить рН раствора HNO3, если плотность раствора ρ ═ 1,003. Ответ:1,7
Вычислить рН раствора H2SO4, если плотность раствора ρ ═ 1,005. Ответ:0,7
Вычислить рН 0,1M раствора HNO2 , если К═6,9 · 10-4. Ответ: 2,1
Вычислить рН 0.2M раствора HCN , если К═ 5 · 10-10. Ответ:5,0
Вычислить рН 0,01M раствора HCOOH, если К═1,8·10-4. Ответ:2,9
Вычислить рН 0,02M раствора CH3COOH,если К═1,74·10-5. Ответ:3,24
Вычислить рН 0,5M раствора NH4OH, если К═1,76·10-5. Ответ:11,03
Вычислить рН 0,2M раствора HJO, если К═2,3·10-11. Ответ:5,67
Вычислить рН 0,1M раствора фенола, если К═1,0·10-10. Ответ:5,5
Вычислить рН 0,1M раствора гидроксиламина, если К═8,9·10-9. Ответ:9,47
Вычислить рН 0,1M раствора хлорноватистой кислоты, если К═2,95·10-8. Ответ: 4,27
Вычислить рН 0,1M раствора циановой кислоты, если К═2,7·10-4. Ответ:2,3
Вычислить рН 0,1M раствора CH3COONa, если 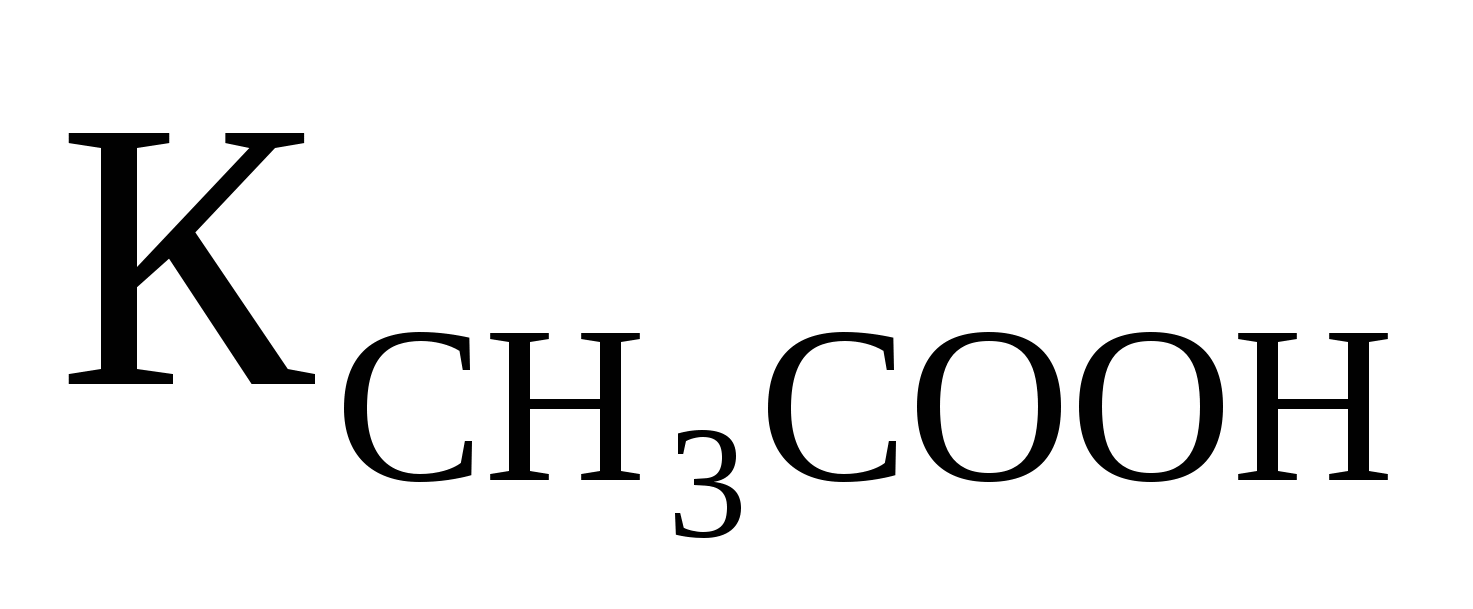 ═1,74·10-5. Ответ:8,88 ═1,74·10-5. Ответ:8,88
Вычислить рН 0,1M раствора NH4Cl, если ═1,76·10-5. Ответ: 5,12 ═1,76·10-5. Ответ: 5,12
Вычислить рН 0,1M раствора KCN, если КHCN═6.2·10-10. Ответ:11,15
Вычислить рН 0,1M раствора NH4CN, если КHCN═6.2·10-10. Ответ:9,27
Вычислить рН 0.1M раствора Na2SO3, если  ═ 6.2·10-10. Ответ:10,1 ═ 6.2·10-10. Ответ:10,1
Вычислить рН 0.1M раствора NaHSO3, если 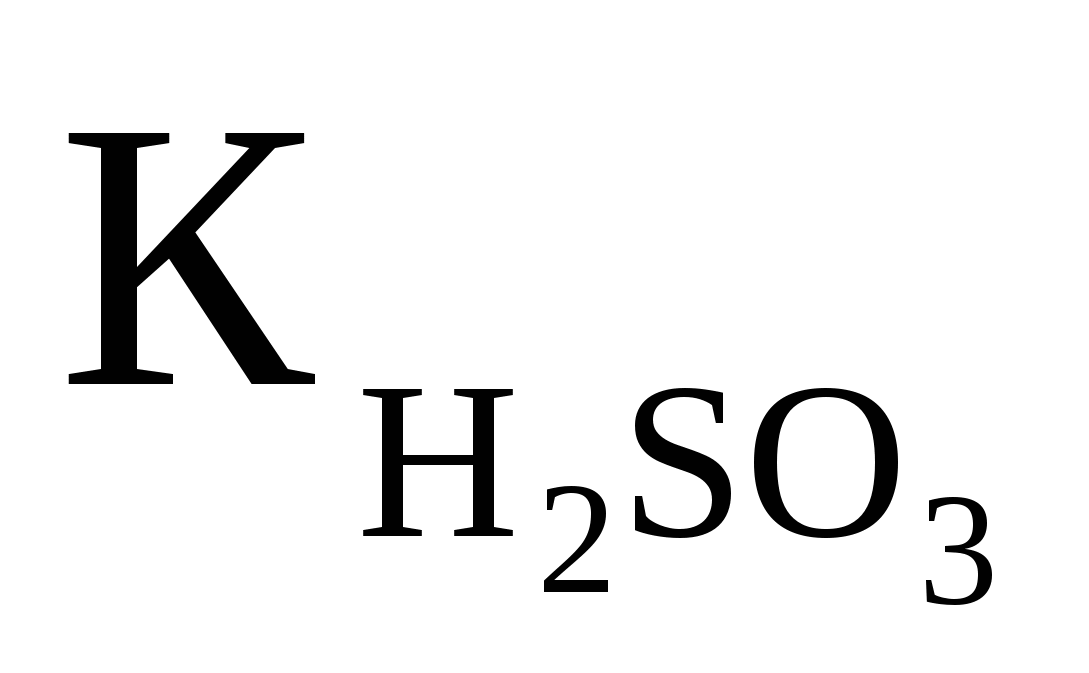 ═1,4·10-2. Ответ:7,42 ═1,4·10-2. Ответ:7,42
Вычислить рН 0,1M раствора раствора Na2 CO3, если 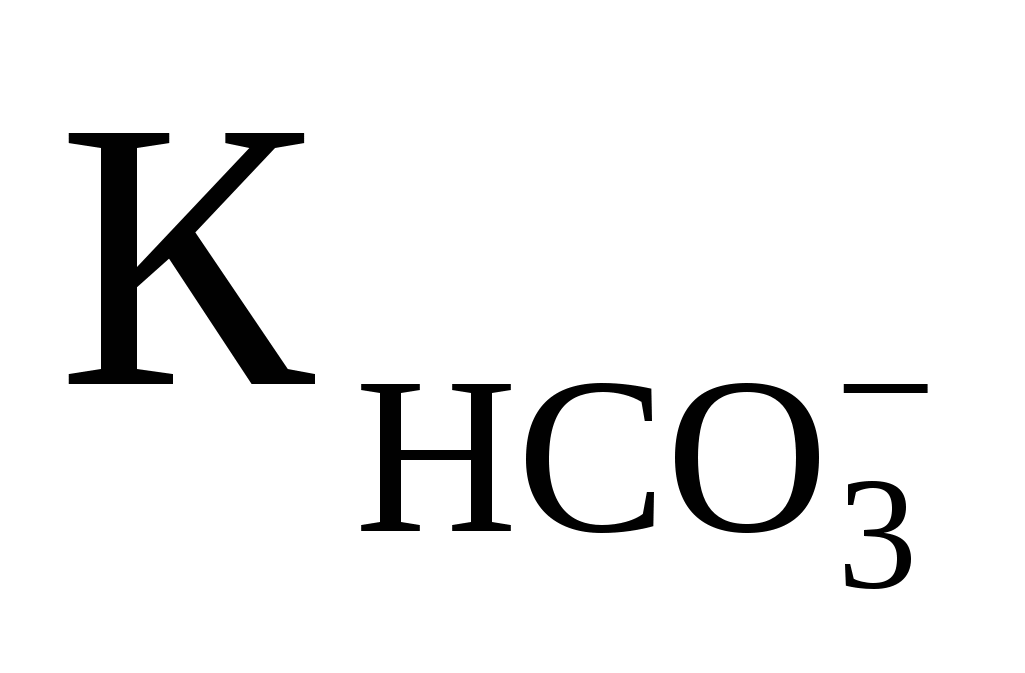 ═ 4,8·10-11. Ответ:11,66 ═ 4,8·10-11. Ответ:11,66
Вычислить рН 0.1M раствора NaHCO3, если 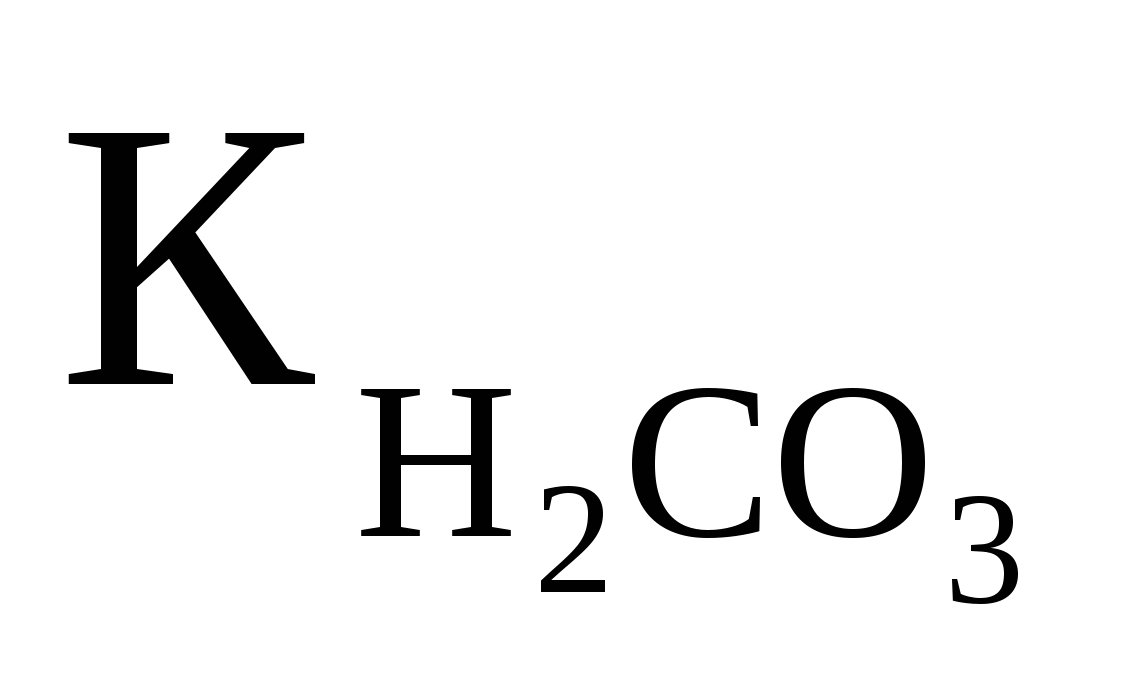 ═4,5·10-7. Ответ:9,67 ═4,5·10-7. Ответ:9,67
Вычислить рН 0,1M раствора (NH4)2CO3, если 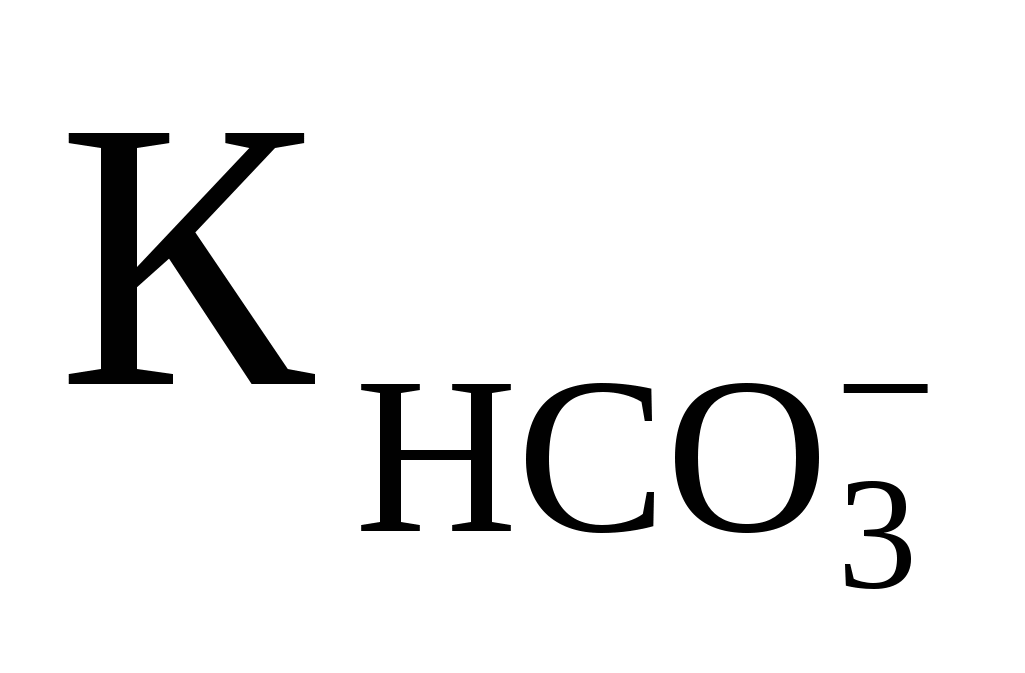 ═4,8·10-11; ═4,8·10-11;  ═1,76·10-5 Ответ:9,19 ═1,76·10-5 Ответ:9,19
Вычислить рН 0,1M раствора CH3COONH4, если  ═1,76·10-5; ═1,76·10-5; 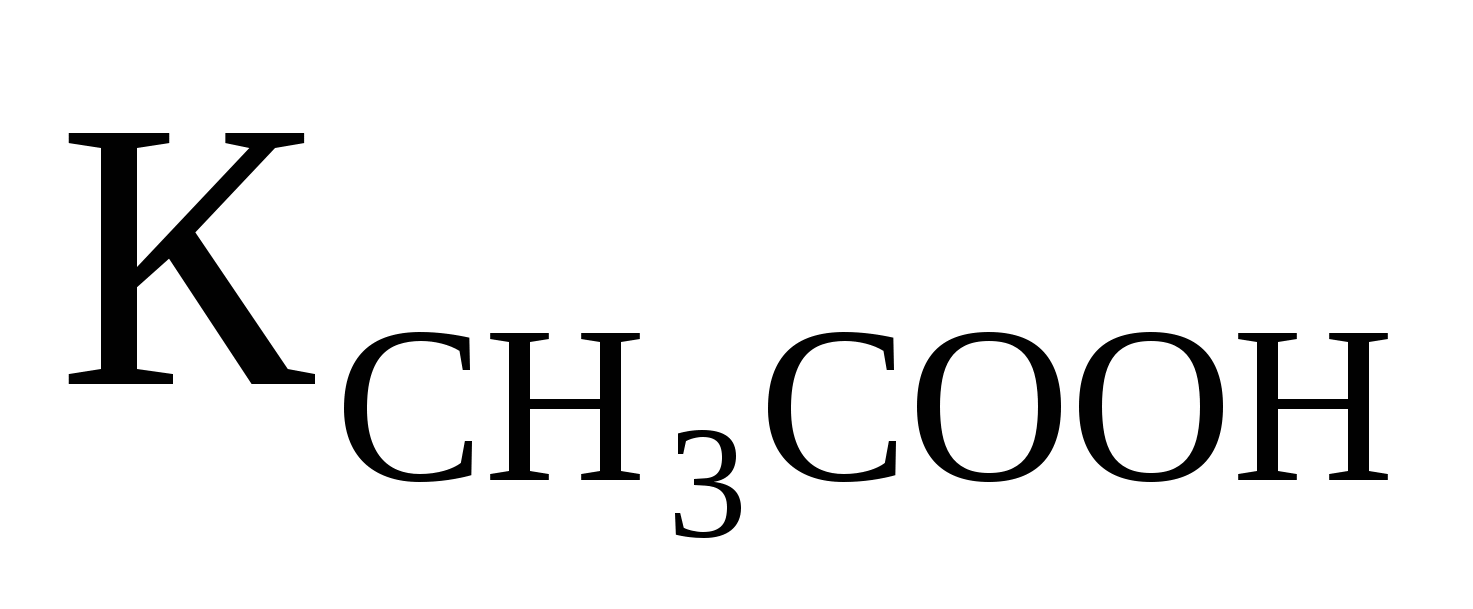 ═1,74·10-5. Ответ:7,0 ═1,74·10-5. Ответ:7,0
Вычислить рН 0,1M раствора Na3PO4, если 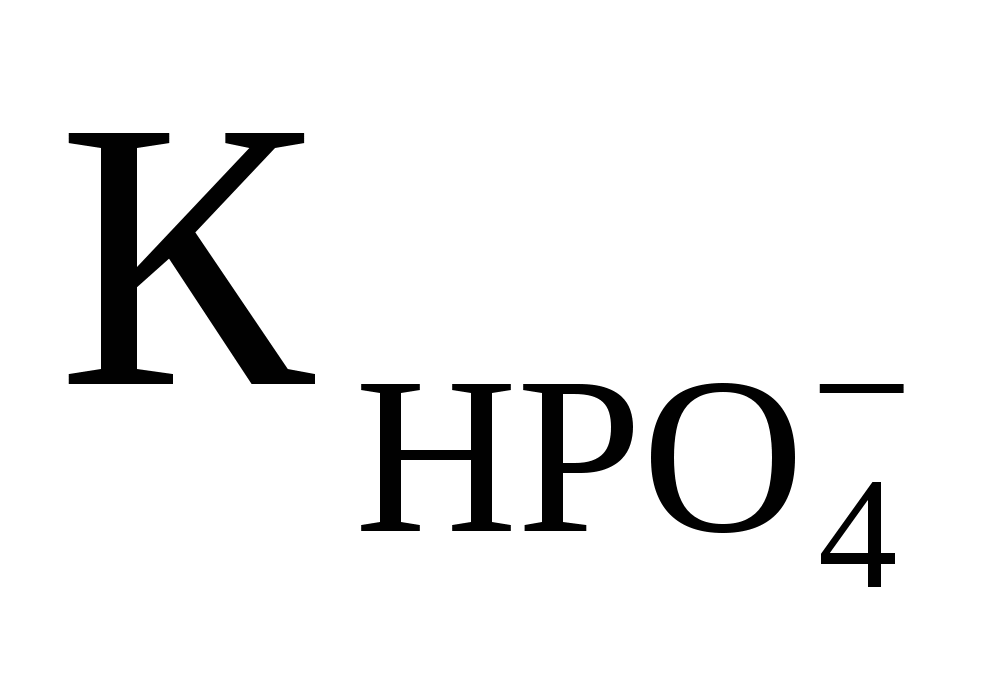 ═5,0·10-3. Ответ:12,5 ═5,0·10-3. Ответ:12,5
Вычислить рН 0,1M раствора NaClO, если КHClO═5,0·10-8.Ответ:10,26
Вычислить рН 0,1M раствора NaHS, если 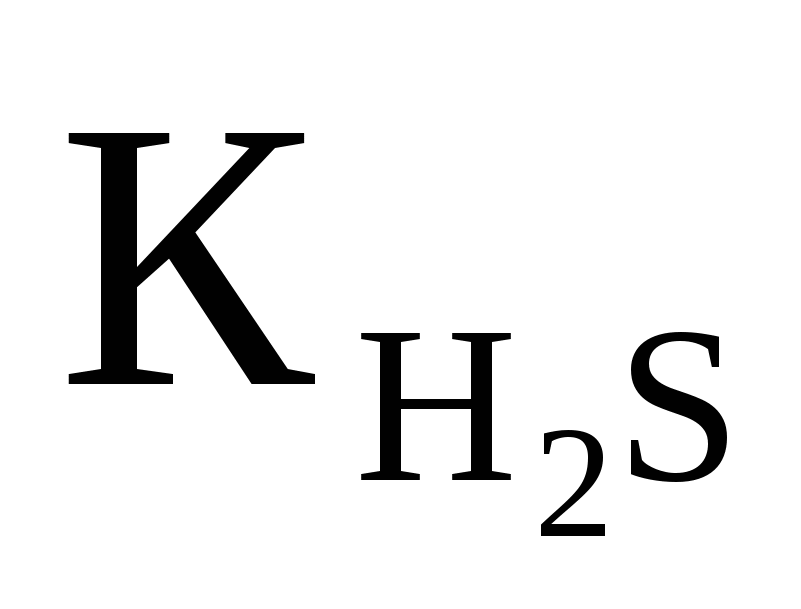 ═1,0·10-7.Ответ: 9,99 ═1,0·10-7.Ответ: 9,99
Вычислить рН 0,1M раствора K2S, если КHS-═2.5·10-3. Ответ: 12,80
Вычислить рН 0,1M раствора HCOONa, если КHCOOH═4,0·10-13. Ответ:8,37
Какую навеску хлорида аммония следует растворить в 100 см3 раствора, чтобы рН раствора был равен 6? Ответ:9,36 мг
В каком объеме следует растворить навеску ацетата натрия 0,03 г , чтобы получить раствор с рН═8? Ответ: 209 см3
Навеску Na2CO3 0,1 г растворили в 500 см3 раствора. Вычислить рН. Ответ:10,80
Навеску NaHCO3 0,05 г растворили в 100 см3 раствора. Вычислить рН. Ответ: 9,06
Какую навеску нитрата аммония следует растворить в 150 см 3 раствора, чтобы рН раствора стал равен 5? Ответ:2,1 г
В каком объеме следует растворить навеску соды Na2CO3 0,005 г , чтобы получить раствор с рН═9? Ответ: 9,92 см3
Какую навеску ацетата калия следует растворить в 500 см3 раствора, чтобы рН раствора стал равен 9? Ответ:8,59 г
Навеску хлорида аммония NH4 Cl 0,1 г растворили в 250 см3 раствора. Вычислить рН. Ответ:5,69
Вычислить рН буферной смеси, состоящей из равных объемов 1,0% растворов муравьиной кислоты и ее натриевой соли. Ответ:3,55
Вычислить рН буферной смеси, состоящей из равных объемов 5,0% растворов гидроокиси аммония и хлорида аммония. Ответ:9,41
Вычислить рН буферной смеси, состоящей из равных объемов 10,0% растворов йодноватистой кислоты и ее натриевой соли. Ответ:10,57
Вычислить рН буферной смеси, состоящей из 0,01 М раствора уксусной кислоты и 0,1 М раствора ее калиевой соли. Ответ:5,76
Вычислить рН буферной смеси, состоящей из 0,01 М раствора синильной кислоты и ее 1,0 М раствора калиевой соли. Ответ: 11,30
Вычислить рН буферной смеси, состоящей из 0,02 М раствора гидроксида аммония и 0,2 М раствора хлорида аммония. Ответ: 8,24
Вычислить рН буферной смеси, состоящей из равных объемов 5,0% растворов азотистой кислоты и ее натриевой соли: Ответ:3,12
Вычислить рН буферной смеси, состоящей из равных объемов 0,5% растворов бензойной кислоты и ее натриевой соли.Ответ: 4,13
Вычислить рН буферной смеси, состоящей из равных объемов1,0% растворов бромноватистой кислоты и ее натриевой соли: Ответ:8,53
Вычислить [Н+] и рН в 1н растворе СН3СООН. Ответ: 4,24∙10-3 ; 2,37
Вычислить [Н+] и рН в 0,01н растворе NH4ОН. Ответ: 2,37 ∙10-11; 10,625
Вычислить [Н+] и рН в 0,1н растворе Н2С2О4. Ответ: 5,2∙10-3; 1,284
рН раствора равно 2,63. Чему равны в нем концентрации [Н+] и [OН+]? Ответ: 2,34 ∙10-3; 4,27∙10-12
рН раствора равно 12,45. Чему равны в нем концентрации [Н+] и [OН+]? Ответ: 3, 55 ∙10-13; 2,8 ∙10-3
Раствор содержит 0,056 моль/л NH4OH и 0,1 моль/л NH4Cl. Чему равен рН этого раствора и как он изменится при прибавлении к 1л этого раствора: а) 0,001 моль NaOH; б) 0,001 моль HCl ? Ответ:8,99; 9,0102; 8,986.
На сколько единиц изменится рН раствора, содержащего NаОН в концентрации 2·10-5 М при прибавлении к 1л его 0,001 моль: а) NаОН б) НСl? Ответ :на 2; на 6.
Литература
1 Кельнер Р. Аналитическая химия. Проблемы и подходы. - М. : Мир, 2004. – 728 с.
2 Васильев В.П. Аналитическая химия. – М. : Дрофа, 2002. – 703 с.
3 Васильев В.П Аналитическая химия. Сборник вопросов, упражнений и задач. – М. : Дрофа, 2003. – 320 с.
4 Золотов Ю.А. Основы аналитической химии. – М. : Высшая школа, 2004. – 504 с.
5 Золотов Ю.А. Основы аналитической химии. Задачи и вопросы. – М. : Высшая школа, 2004. – 416 с.
6 Лурье Ю.Ю.Справочник по аналитической химии. М. : Химия, 1979. – 365 с.
7 Клещев Н.Ф. Задачник по аналитической химии. – М. : Химия, 1993. – 223 с.
Содержание
|
Введение………………………………………………………..........3
|
1
|
Титриметрические методы анализа…………………………..........4
|
2
|
Расчеты в гравиметрических методах анализа…………………..27
|
3
|
Расчет рН в растворах……………………………………………..41
|
|
Литература………………………………………...……………….47
|
|
 Скачать 0.79 Mb.
Скачать 0.79 Mb.