Использование дидактических заданий на уроках химии для формирования УУД при изучении темы «Неметаллы». Горбенко -Карпов УУД. Сера и ее соединения. При выполнении этого задания обучающиеся самостоятельно получают знания в процессе познавательной деятельности
 Скачать 149.85 Kb. Скачать 149.85 Kb.
|
|
Использование дидактических заданий на уроках химии для формирования УУД при изучении темы «Неметаллы» Согласно новым стандартам, одним из видов образовательных результатов являются универсальные учебные действия, формирование и развитие которых в учебно-воспитательном процессе осуществляется в контексте усвоения разных предметных дисциплин. Химия как учебный предмет не является исключением. Различного рода задания, используемые учителем на уроках химии, выступают как дидактические средства формирования УУД. В качестве примера мы предлагаем задание по теме «Сера и ее соединения». При выполнении этого задания обучающиеся самостоятельно получают знания в процессе познавательной деятельности. 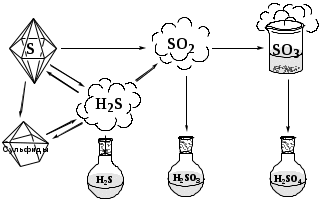 Сера кристаллическое вещество, с молекулярной кристаллической решёткой, имеет невысокие температуры плавления и кипения, растворима в неполярных растворителях. Сера горит с образованием сернистого газа, растворимого в воде, обладающего кислотными свойствами. Ему соответствует слабая сернистая кислота. Оксид серы (VI) получают окислением сернистого газа на катализаторе. Высший оксид серы – легко кипящая жидкость, при комнатной температуре чаще газ, в воде растворяется с выделением тепла, образуя серную кислоту. Окислительные свойства сера проявляет в реакциях с водородом и металлами, образуя соответственно сероводород и сульфиды, последние легко гидролизуются с образованием сероводорода. Раствор сероводорода в воде обладает кислотными свойствами, сам же сероводород – хороший восстановитель, горит с образованием оксида серы (IV), очень ядовит. Внимательно рассмотрите схему превращений. Генетический ряд какого химического элемента она отражает? К каким классам неорганических соединений относятся представленные в схеме вещества? Прочитайте предложенный вам текст и разделите его на логические абзацы. Вставьте в текст соответствующие уравнения химических реакций, представленные в схеме, обозначив их цифрами в тексте и на рисунке. Какие из процессов являются окислительно-восстановительными? Составьте к ним электронный баланс и укажите окислитель и восстановитель. Самостоятельно предположите и укажите в тексте, какие вещества в предложенной схеме превращений за счет атома серы могут проявлять окислительно-восстановительную двойственность. Обменяйтесь отчетами о выполнении задания со своим напарником. Проверьте правильность полученного результата и укажите друг другу на ошибки, если они будут обнаружены. Работа над заданием может быть индивидуальной, но более целесообразно организовать выполнение предложенного задания в парах. Ученики, сидящие за одной партой, получают одно и то же задание; вначале каждый выполняет задание самостоятельно, затем они обмениваются тетрадями, проверяют правильность полученного результата и указывают друг другу на ошибки, если они будут обнаружены. В таблице представлены разные виды универсальных учебных действий, которые формируются и развиваются у обучающихся при выполнении задания.
При изучении свойств азота для схемы и текста вопросы используются, как и в предыдущем задании. 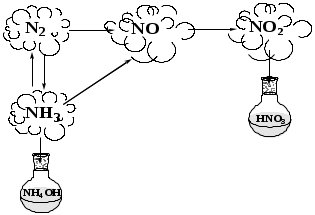 +NО  Азот при нормальных условиях газ без цвета и запаха очень плохо растворим в воде. С кислородом воздуха реагирует при очень высоких температурах, в природе это канал молнии, получающийся оксид азота (II) не растворим в воде, и является несолеобразующим. Он при нормальных условиях окисляется до оксида азота (IV), который легко растворяется в воде с образованием азотной кислоты и оксида азота (II), идёт реакция диспропорционирования, в избытке кислорода растворение происходит с образованием только азотной кислоты. Окислительные свойства азот проявляет в реакции с водородом. Эта реакция обратима, так как образующийся аммиак разлагается при нагревании, которое идёт за счёт реакции. Аммиак очень хорошо растворим в воде с образованием гидроксид аммония, проявляющего свойства основания в реакциях с кислотами даёт соли аммония. В кислороде аммиак горит, выделяя пары воды и азот, окисление аммиака на катализаторе приводит к образованию оксида азота (II). Задания подобного рода могут быть разработаны учителями самостоятельно, и использованы на уроках химии в курсе основной школы при изучении темы «Неметаллы». | ||||||||||||||||||||||||||||||||||
