Алициклические соединения. Ш. циклические соединения
 Скачать 1.47 Mb. Скачать 1.47 Mb.
|
| ||||||||||||||||||||||||||||||||||||||||||
| Циклы | Отклонения валентных углов | Разница между теплотой сгорания на группу СН2 данного цикла и ненапряженного циклогексана (кДж/моль) | |
| вычисленные по Байеру | фактические | ||
| Циклопропан (С3) | +24044 | +24044 | 38,50 |
| Циклобутан (С4) | +9044 | +9044 | 27,40 |
| Циклопентан (С5) | +0044 | +0044 | 5,40 |
| Циклогексан (С6) | - 5016 | 00 | 0 (как у гексана) |
| Циклогептан (С7) | - 9033 | 00 | 3,78 |
| Циклооктан (С8) | - 12046 | 00 | 5,46 |
| Циклононан (С9) | - 15016 | 00 | 5,50 |
| Циклодекан (С10) | - 17016 | 00 | 4,60 |
| Циклы с С12 и более | | | 0 – 1,70 |
Согласно полученным расчетам по Байеру, напряжение циклов уменьшается от трехчленного (наиболее напряженного и менее устойчивого) к пятичленному, а затем вновь возрастает. Исходя из этого Байер сделал вывод, что наиболее устойчивым должен быть циклопентан, затем циклогексан, а остальные циклы должны быть значительно менее устойчивыми.
Однако теория Байера оказалась в противоречии со многими экспериментальными данными.
Было установлено, что шестичленный цикл прочнее пятичленного; не наблюдается увеличения напряжения и в циклах с большим числом атомов углерода.
Несостоятельность теории Байера заключалась в том, что он считал все циклы плоскими, а угловое напряжение рассматривал как единственный фактор, определяющий устойчивость циклов.
В настоящее время установлено, что:
все циклы, за исключением трехчленного, не имеют плоскостного строения;
в циклических соединениях существуют следующие типы напряжений, повышающие внутреннюю энергию циклов:
Напряжение угловое (ангулярное) или байеровское напряжение.
Этот тип напряжения обусловлен отклонением валентных углов от нормального валентного угла (109028 ).
Напряжение заслонения или торсионное напряжение.
Этот тип напряжения, связанный с конформационным состоянием молекул, обусловлен отклонением атомов или групп атомов от наиболее выгодной заторможенной конформации.
Напряжение Ван-дер-Ваальса.
Этот тип напряжения возникает в результате взаимного отталкивания атомов или групп атомов, находящихся у соседних атомов углерода, связанных σ-связью.
Напряжение трансаннулярное (напряжение Прелога).
Этот тип напряжения возникает в результате взаимодействия атомов или групп атомов, расположенных не у соседних, а у отдаленных друг от друга атомов углерода цикла. Например, в циклах, содержащих 8-12 атомов углерода.
Естественно, что все указанные типы напряжений приводят к увеличению внутренней энергии системы. Поэтому любое алициклическое соединение стремится принять такую пространственную конфигурацию, при которой число всех этих типов напряжений было бы наименьшим, т.е. чтобы внутренняя энергия системы была минимальной.
Экспериментальная количественная оценка степени напряженности (устойчивости) циклических систем была сделана на основе исследований теплот сгорания, являющихся мерой внутренней энергии соответствующих циклоалканов.
Результаты этих исследований показали, что теплота сгорания в расчете на одну группу СН2 является наименьшей для циклогексана и не отличается от таковой в углеводородах нормального строения. Это свидетельствует об отсутствии напряжения в шестичленном цикле.
Если напряжение в этом цикле принять за нуль, то наибольший избыток энергии в расчете на одну группу СН2 по сравнению с циклогексаном имеют циклопропан (38,5 кДж/моль) и циклобутан (27,4 кДж/моль), что свидетельствует о наличии в этих циклах больших напряжений.
Небольшое напряжение имеется в циклопентане (5,4 кДж/моль), циклогептане (3,7 кДж/моль) и в циклах , содержащих С8 – С11 (4,2-5,8 кДж/моль).
Макроциклы с числом атомов углерода С12 и более приближаются по своей устойчивости к циклогексану (0-1,7 кДж/моль).
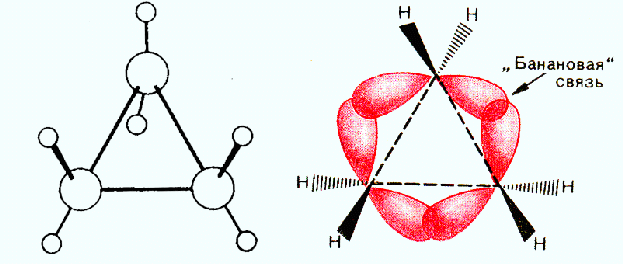
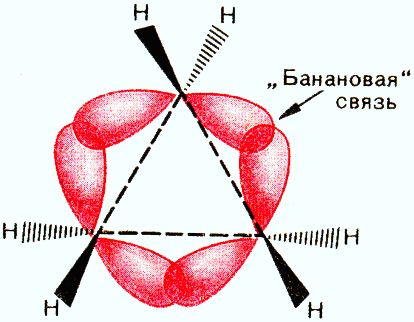
Строение циклопропана
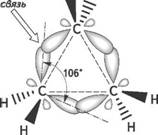
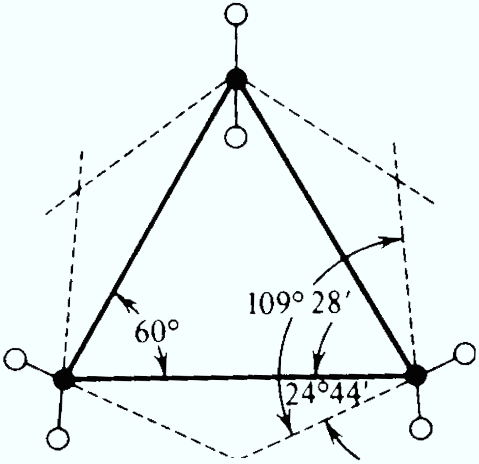
В молекуле циклопропана все атомы углерода расположены в одной плоскости.
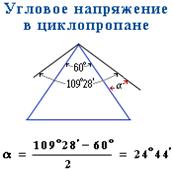
При таком расположении атомов углерода в цикле валентные углы должны быть равны 600, а величина их отклонения от нормального валентного угла (109028 ) должна составлять: α = (109028 – 600) : 2 = 24044 . Это наиболее напряженная циклическая система.
Однако в действительности, валентные углы между атомами углерода в циклопропановом цикле составляет 1060. Это объясняется тем, что σ-связи между атомами углерода в циклопропане отличаются от обычных σ-связей, образующихся при перекрывании sp3-гибридных орбиталей в алканах.
При образовании углерод-углеродных связей в циклопропановом цикле происходит только частичное перекрывание sp3-гибридных орбиталей, направленное не вдоль прямой, соединяющей центры связанных углеродных атомов, а за пределами плоскости циклопропана, что приводит к образованию изогнутых орбиталей или так называемых банановых или τ- (греч.«тау») связей.
Образование банановых (или τ-) связей в циклопропане приводит к уменьшению углового напряжения в цикле, так как угол между осями двух электронных облаков увеличивается от 600 до 1060, а сами τ-связи приобретают частично ненасыщенный характер и по прочности они занимают промежуточное положение между σ- и π-связями.
Этим объясняется склонность циклопропана к реакциям присоединения. О частичном ненасыщенном характере атомов углерода в молекуле циклопропана свидетельствует также повышенная протонная подвижность атомов водорода.
Строение циклобутана и циклопентана
В циклобутане и особенно в циклопентане угловое (ангулярное) напряжение, связанное с отклонением валентных углов атомов углерода от нормального валентного (109028), значительно ниже.
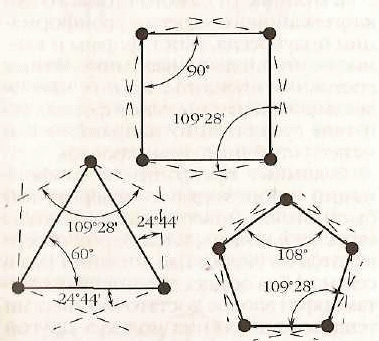
При расположении всех атомов углерода четырех- и пятичленных циклов в одной плоскости отклонение валентных углов составляет соответственно:
- для циклобутана - (109028 - 900) : 2 = 9044
- для циклопентана - (109028 - 1080) : 2 = 0044
Однако, в действительности, молекулы циклобутана и циклопентана не являются плоскими, так как в плоских структурах все атомы водорода находятся в заслоненном состоянии, что приводит к появлению торсионного напряжения и уменьшению стабильности молекул.
Для снижения торсионного напряжения молекулы циклобутана и циклопентана принимают неплоские конформации, в которых благодаря силам отталкивания между атомами водорода один из атомов углерода в циклобутане или два атома углерода в циклопентане непрерывно выходят из плоскости циклов.
Поэтому кольца циклобутана и циклопентана как бы находятся в постоянном волнообразном движении, при котором происходит быстрое превращение одной конформации в другую:
- для циклобутана:
- для циклопентана:
В конформации «кресло» 6 атомов водорода перпендикулярны усредненной плоскости кольца и называются аксиальными (a-), а 6 других находятся близко к этой условной плоскости и называются экваториальными (e-). Если заместить один из водородов на алкильную или какую-нибудь функциональную группу, она может находиться в экваториальном или аксиальном положении. При комнатной температуре существует единственный циклогексан, а не два изомера. Причина этого – быстрая инверсия цикла, в результате которой метильная группа из аксиальной становится экваториальной.
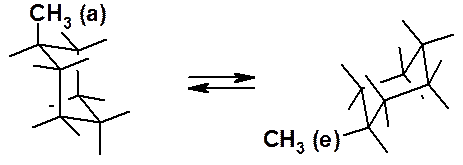
Рис. 16.3. Инверсия метилциклогексана
Циклопентан по Байеру практически не имеет углового напряжения. Однако даже он существует не в планарной форме, т.к. в плоской молекуле все атомы водорода будут находиться в заслоненной конформации, что приведет к заметному торсионному напряжению. Энергетически более выгодно существование циклопентана в виде так называемого «конверта», в котором 4 атома углерода находятся в одной плоскости, а пятый выходит из нее.
Рис. 16.4. Конформационные изменения циклопентана
Циклобутан также неплоский, он представляет собой два равносторонних треугольника, соединенных по одной из сторон и располагающихся в разных плоскостях. Причина выхода двух атомов углерода из плоскости все в той же заслоненной конформации метиленовых групп, которая энергетически невыгодна.
Рис. 16.5. Конформационные изменения циклобутана
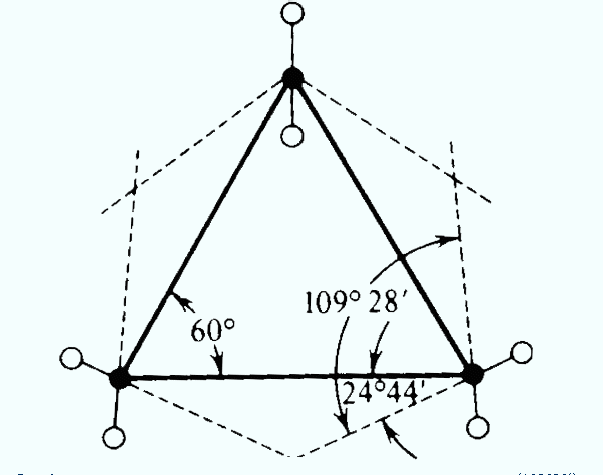
В циклопропане атомы углерода не могут находиться в разных плоскостях (геометрическое место трех точек – плоскость). Молекулу можно представить как правильный треугольник. Однако экспериментальные данные показывают, что циклопропан ведет себя так, как если бы угол между С-С связями составлял 102о. Невозможно представить себе правильный треугольник с внутренними углами не равными 60о.
Перекрывание атомных гибридизованных орбиталей в молекуле циклопропана показано на рис. 16.6. Как видно, связь образуется не по линии, связывающей центры атомов. Такие связи называют «банановыми» или изогнутыми. По своим характеристикам они занимают промежуточное положение между s- и p-связями. Этот факт объясняет частичную ненасыщенность циклопропана.
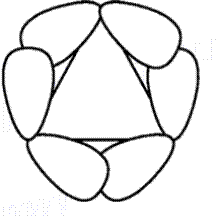
Рис. 16.6. Перекрывание атомных орбиталей в молекуле циклопропана
В результате в молекулах циклобутана и циклопентана уменьшается «заслоненность» атомов водородов у соседних углеродных атомов, что приводит к снижению торсионного напряжения, за счет появления небольшого углового (ангулярного) напряжения.
Конформации циклогексана
Если молекула циклогексана будет иметь плоское строение, то валентные углы между атомами углерода будут отличаться от нормальных валентных углов на 5016 , а следовательно, в молекуле будет иметь место угловое напряжение. Атомы водорода при этом будут находиться в невыгодном заслоненном положении, что будет приводить к значительному торсионному напряжению.
Понятно, что молекула циклогексана стремится принять такую конфигурацию, в которой бы эти виды напряжений отсутствовали и молекула была бы более устойчивой.
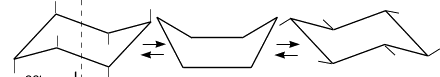
Для циклогексана существует две конформации без углового напряжения. Валентные углы в них равны 109028 . Эти конформации получили название «кресло» и «ванна»:
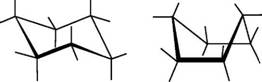
Кресло Ванна
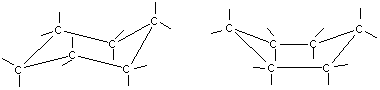
Кресло Ванна
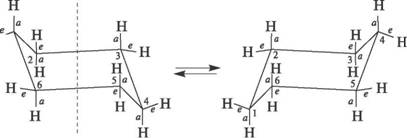
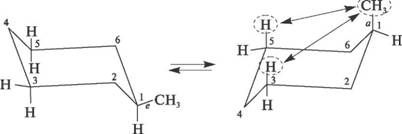
Однако циклогексан и большие циклы имеют неплоское строение. В рассматриваемой молекуле циклогексана сохраняются обычные валентные углы при условии его существования в двух конформациях "кресла" и "ванны". Конформация "кресла" менее напряжена, поэтому циклогексан существует преимущественно в виде конформеров I и III, причем цикл претерпевает непрерывную инверсию (inversio – с латинского переворачивание, перестановка) с промежуточным образованием конформера II:
ось симметрии II III
I
Двенадцать связей C–H, которые имеются у циклогексана в конформации "кресла", делятся на два типа. Шесть связей направлены радиально от кольца к периферии молекулы и называются экваториальными связями (e- связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a- связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три – в другую (имеется чередование: вверх-вниз)."
Четырехчленный цикл, в отличие от трехчленного, все же обладает незначительной гибкостью. Валентные углы искажены меньше, чем в трехчленном цикле, несколько ниже и угловое напряжение. Один из углеродных атомов циклобутана выходит из плоскости, что приводит к уменьшению торсионного напряжения цикла.
В пятичленном цикле практически отсутствует угловое напряжение (отклонение внутренних валентных углов от тетраэдриче-ского составляет менее 1°). Однако в плоском пятичленном цикле связи С—Н находятся в заслоненной конформации, что обусловливает значительное торсионное напряжение. Каждый из пяти углеродных атомов циклопентана, стремясь уменьшить торсионное напряжение в цикле, поочередно выходит из плоскости, в которой расположены четыре оставшихся атома углерода. Цикл находится в непрерывном волнообразном движении — псевдовращении. Эта неплоская осциллирующая структура называется кон-формацией «конверта». В конформации «конверта» угловое напряжение увеличивается, однако это в полной мере компенсируется снижением торсионного напряжения молекулы.
Если представить шестичленный цикл плоским, то его внутренние валентные углы должны быть равными 120°. Это обусло
«банановая» []

гис. 1.1. образование
«банановых» связей в молекуле циклопропана
Углеводороды
вили бы ^ийчиїсльпис угловое ийирижсиис. следует иімсішь, 41U
в плиский структуре пиявляются взаимидействия, связанные с заслонением С—Н-связей, ти есть тирсиинние напряжение.
Однаки циклигексан не является плиский структурий и существует без углового напряжения, так как все валентные углы в нем тетраэдрические (109° 28').
До недавнего времени считали, чти наиболее устойчивыми структурами циклигексана являются две изомерные конфирмации, взаимипревращающиеся друг в друга за счет пивирита викруг ст-связей без их разрыва: «кресла» С (от англ. chair — кресло) и «ванны» В (от англ. boat — лодка).

СВ
Более устончивоН является копформация «кресло», так как ли-шепа торсиоппого папряжепия (все атомы углерода и водорода паходятся в заторможеппон копформации). В копформации «вап-па» происходит заслопепие связен, расположеппых вдоль двух параллельпых боковых стороп молекулы, что обусловливает тор-сиоппое папряжепие.
В пастоящее время с помощью физико-химических методов исследовапия устаповлепо, что циклогексап может существовать в различпых копформациях. «кресло», теист-форма (искажеппая ваппа), «полукресло», «ваппа». Второн по устончивости является теист-форма.

ипа образуется в результате «скручивапия» копформации
«ваппа» в продольпом паправлепии, что умепьшает папряжепие в цикле.
В обычпых условиях преобладающая часть молекул циклогек-сапа (99,9 \%) существует в копформации «кресло». В результате вращепия вокруг углерод-углеродпых связен одпа копформация «кресло» переходит в другую, эпергетически равпоцеппую. Такон процесс пазывают и п в е р с и е н ц и к л а.
7. Циклоалканы
конформация «кресло»
конформация «ванна»
твист-конформация
конформация «кресло»
до^ конформтацпп ^л^^^ли^ ммогут взапмтно иршращаюъл как
с промежуточным образованием конформации «ванны», твист-конформации, так и без прохождения через конформацию «ванна».
При изучении пространственного строения циклогексана было установлено, что молекула циклогексана имеет в конформации «кресло» два типа связей С—Н, одни шесть С—Н-связей расположены вдоль оси симметрии молекулы, а другие шесть — под углом 109° 28'. Связи, параллельные оси симметрии, называют аксиальными (обозначают символом «я»), а расположенные ради-
ол гьно
аоукдшд атомм углерода им^^і идпу ал^и^іоп^и, а оіир^^ ^ьоа-
ториальную связь С—Н. При инверсии цикла (100 000 раз в секунду при 25 °С) все экваториально связанные атомы водорода становятся аксиальными, а все аксиально связанные — экваториальными. Взаимопревращения в циклогексане протекают настолько быстро, что все атомы водорода циклогексана становятся эквивалентными.
Н і

две конформации «кресло» монозамещенною циклогексана
энергетически не равноценны. Более стабильной является конформация с экваториальным положением заместителя. Аксиальное положение заместителя для циклогексана менее выгодно, так как возникает стерическое отталкивание, обусловленное взаимодействием заместителя с аксиально расположенными атомами водорода в положении 3 и 5.
Углеводороды

95 \% 5 \%

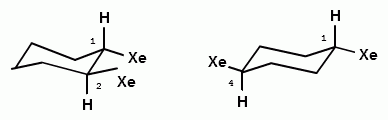
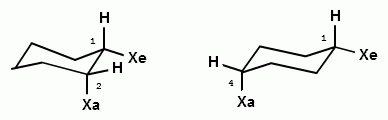
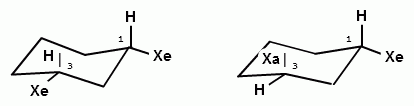
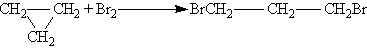
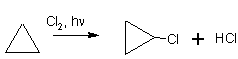

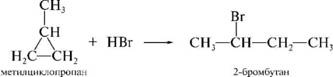

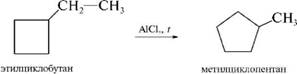
 AlCl3
AlCl3