Алициклические соединения. Ш. циклические соединения
 Скачать 1.47 Mb. Скачать 1.47 Mb.
|
Получение. СвойстваПолучение. 1. Основной способ получения циклоалканов - отщепление двух атомов галогена от дигалогеналканов: 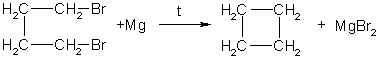 2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные: t°,P,Ni C6H6 + 3H2 → C6H12. Химические свойства. По химическим свойствам малые и обычные циклы существенно различаются между собою. Циклопропан и циклобутан склонны к реакциям присоединения, т.е. сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения. 1. Так, например, циклопропан и циклобутан способны присоединять бром (хотя реакция и идет труднее, чем с пропеном или бутеном): 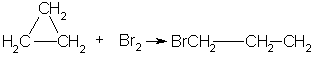 2. Циклопропан, циклобутан и даже циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора: 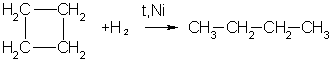 3. В реакцию присоединения с галогеноводородами опять же вступают только малые циклы. Присоединение к гомологам циклопропана происходит по правилу Марковникова: 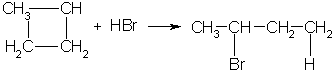 4. Реакции замещения. Обычные циклы (С6 и выше) устойчивы и вступают только в реакции радикального замещения подобно алканам: t° С6Н12 + Вr2 → С6Н11Вr + НВr. 5. Дегидрирование циклогексана в присутствии никелевого катализатора приводит к образованию бензола: t° Ni C6H12 → C6H6 + 3H2. 6. При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота: 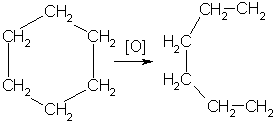 Особенности строения циклоалканов и их химическое поведение. Выше мы продемонстрировали неустойчивость малых циклов и их способность разрываться и вступать в реакции присоединения. Причины этого кроются в строении циклов. Так, циклопропан имеет плоское строение, поэтому атомы водорода у соседних атомов углерода располагаются над и под плоскостью цикла в энергетически невыгодном ("заслоненном") положении. Это — одна из причин "напряженности" цикла и его неустойчивости. И 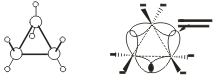 сходя из того, что трехчленный цикл является плоским равносторонним треугольником, валентные углы между атомами углерода должны быть равными 60°, т.е. резко отличающимися от величины нормального валентного утла 109,5° для классического случая sp'-гибридизации . сходя из того, что трехчленный цикл является плоским равносторонним треугольником, валентные углы между атомами углерода должны быть равными 60°, т.е. резко отличающимися от величины нормального валентного утла 109,5° для классического случая sp'-гибридизации .Установлено, что образование -связей между атомами углерода происходит путем перекрывания sp3-гибридных орбиталей не по прямой, соединяющей ядра атомов, а вне ее. Такое перекрывание не является осевым, характерным для образования -связей, а несколько приближается к боковому перекрыванию, характерному для образования -связей. Образовавшиеся -связи с расположением максимальной электронной плотности вне прямой между ядрами связываемых атомов называют "банановыми". По свойствам они напоминают -связи. Действительно, циклопропан способен вступать в реакции присоединения (с разрывом цикла). Обычные циклы, наоборот, очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации. Среди неплоских конформаций наиболее энергетически выгодной является конформация кресла, так как в ней все валентные углы между атомами углерода равны 109,5°, а атомы водорода у соседних атомов углерода находятся относительно друг друга в заторможенном положении. 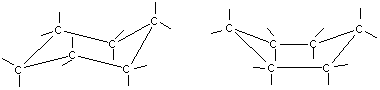 a б Конформации шестичленного цикла: а — кресло: 6 — ванна. Другое возможное для циклогексана расположение атомов соответствует конформации ванны, хотя оно менее устойчиво, чем конформация кресла. Следует отметить, что и в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
Понятие ароматичности. Название «ароматические соединения» возникло случайно, в связи с тем, что первые соединения этого ряда, выделенные из природных смол и бальзамов, обладали приятным ароматным запахом. Так, например, еще в ХУ1 веке из бензойной смолы были выделены бензойная кислота и бензиловый спирт; из масла горького миндаля – бензойный альдегид; из толуанского бальзама – толуол; из сосновой смолы – цимол и т.д. В дальнейшем было установлено, что такое же строение и химические свойства имеют и многие другие вещества, не обладающие приятным ароматным запахом. Поэтому название «ароматические вещества» потеряло свое первоначальное значение. Немецкий химик Кекуле первым обратил внимание, что многие ароматические соединения в обычных химических превращениях сохраняют характерную циклическую группировку из шести атомов углерода и поэтому бензол, как простейший представитель с шестичленной группировкой был признан родоначальником ароматических соединений. Бензол был открыт в 1825 году Фарадеем, который выделил его из конденсированных остатков светильного газа, получаемого из каменного угля. Фарадей определил и соотношение углерода и водорода в этом соединении, равное 1:1. В 1834 году Э.Митчерли при нагревании солей бензойной кислоты (вещества, выделяемого из природных ароматических смол) получил это же соединение и дал ему название бензин. Однако позже Ю.Либих предложил назвать это вещество бензолом. В 1845 году Гофман выделил бензол при перегонке каменноугольной смолы. Бензол и ряд его гомологов, а затем и большая группа других соединений вскоре после их открытия были выделены в группу ароматических соединений, так как обладали особыми «ароматическими свойствами»:
- ароматические амины менее основны, чем алифатические; - ароматические гидроксильные производные – фенолы, обладают значительно более кислотным характером, чем спирты; - ароматические галогенпроизводные значительно труднее вступают в реакции замещения, чем алифатические. Совокупность перечисленных свойств и являлась тем «химическим критерием» с помощью которого определялась принадлежность того или иного вещества к ароматическим соединениям, его «ароматический характер». 2. Развитие представлений о строении бензола. Формула Кекуле. Структурную формулу бензола как системы циклогексатриена впервые предложил в 1865 году немецкий химик А.Кекуле. Согласно Кекуле, бензол – замкнутая система с тремя сопряженными двойными связями – циклогексатриен-1,3,5. Формула Кекуле правильно отражает: 1) элементный состав, соотношение атомов углерода и водорода (1:1) в молекуле бензола; 2) равноценность всех атомов водорода в молекуле бензола (однозамещенные бензола не имеют изомеров). Однако, эта формула не отвечает многим особенностям бензола: 1) являясь, согласно формуле Кекуле, формально ненасыщенной системой, бензол в то же время вступает преимущественно в реакции замещения, а не присоединения. Почему бензол не обесцвечивает бромную воду? 2) эта формула не может объяснить высокой устойчивости бензольного кольца; 3) если исходить из формулы Кекуле, у бензола должно быть два орто-изомера. Однако известен только один орто-изомер. 4) и, наконец, формула Кекуле не в состоянии объяснить равенства расстояний между углеродными атомами в реальной молекуле бензола. Чтобы выйти из этого затруднения, Кекуле был вынужден допустить возможность постоянного изменения положения двойных связей в молекуле бензола и выдвинул теорию «осцилляции», согласно которой двойные связи не фиксированы на одном месте: В связи с этим понятие «ароматические соединения», «ароматические свойства» приобрели другой смысл. К ароматическим соединениям стали относит соединений, содержащие шестичленную циклическую группировку с тремя двойными связями (бензольное кольцо) и обладающие особыми физическими и химическими свойствами. Противоречия между формальной «ненасыщенностью» и своеобразными физическими и химическими свойствами, объясняет только квантовая органическая химия. 3. Современные электронные и квантово-химические представления о строении бензола. Согласно современным представлениям молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой и составляют 0,140 нм. Это расстояние является средним значением между величинами 0,154 нм (длина одинарной связи) и 0,134 нм (длина двойной связи). Однако не только углеродные атомы, но и связанные с ними шесть атомов водорода лежат в одной плоскости. Углы образованные связями С-С-С и Н-С-С равны 1200. Атомы углерода в молекуле бензоле находятся в состоянии sp2-гибридизации. При этом три гибридизованные орбитали образуют обычные σ-связи (две С-С и одну С-Н), а четвертая – негибридизованная 2р-орбиталь перекрывается с 2р-орбиталями двух соседних углеродных атомов: 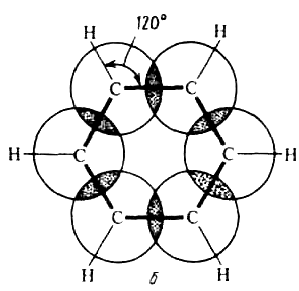  Рисунок 2 - Взаимное перекрывание 2р-орбиталей в молекуле бензола: а - вид сбоку; б - вид сверху В отличие от алкенов у бензола электроны π-связей не заключены в областях между каждой парой атомов углерода, а равномерно распределены по всем шести углеродным атомам, т.е. делокализованы. В результате шесть делокализованных π-электронов, находясь на гантелеобразных орбиталях, оси которых перпендикулярны плоскости бензольного кольца, образуют единую устойчивую замкнутую циклическую π-систему, электронное облако которой расположено под и над плоскостью бензольного кольца.  Рисунок 3 - Равномерное распределение π-электронной плотности в молекуле бензола в виде двух соприкасающихся «бубликов» (торов) В результате такого равномерного перекрывания 2р-орбиталей всех шести углеродных атомов происходит «выравнивание» простых и двойных связей, т.е. в молекуле бензола отсутствуют классические двойные и одинарные связи. Квантово-химические представления о строении бензола. Существует два квантово-химических критерия для определения ароматичности органических соединений - структурный и энергетический. Структурный критерий заключается в тенденции к копланарному расположению атомов и выравниванию длин связей в ароматическом цикле. Тенденция к копланарности обусловливается выгодностью расположения осей атомных р-орбитателей для их эффективного перекрывания. Если же это требование не выполняется, то в молекуле нарушается параллельность осей р-электронных орбиталей, что приводит к устранению сопряжения и, как следствие, к нарушению выравнивания π-электронной плотности в системе. Так, например, молекула циклооктатетраена не имеет плоского строения, а поэтому лишена ароматических свойств. |
