Заразные болезни. Сибирская язва (Anthrax) остропротекающая инфекционная болезнь, характеризующаяся признаками септицемии и тяжелой интоксикации, а также образованием карбункулов
 Скачать 3.52 Mb. Скачать 3.52 Mb.
|
|
2. Метастронгилезы свиней Заболевания свиней, вызываемые паразитированием нематод различных видов семейства Metastrongylidae, подотряда Strongylata. Локализация — бронхи и трахея. Возбудители. В нашей стране и странах ближнего зарубежья распространены три вида нематод: Metastrongylus elongatus, M. salmi и М. pudendodectus. Метастронгилюсы — белые или желтовато-белые тонкие нематоды, самцы которых достигают в длину 1,5— 2,5 см, самки — 2,8—5,0 см. У самцов хвост снабжен половой бурсой. Характерные морфопризнаки — длинные нитевидные спикулы у самцов (у М. elongatus спикула длиной 4—4,2 мм). На конце спикул один крючок. У М. pudendodectes спикулы 1,2—1,4 мм, в конце спикулы снабжены двойным крючком, а у М salmi длина спикул 1,2— 1,4 мм с одним крючком на концах, кутикулярный надвульварный клапан у самок более выражен (у М. pudendodectus) (рис. 56). Яйца мелкие, серого цвета, размерами (0,04...0,06)X(0,03...0,04) мм, овальной формы, покрытые толстой скорлупой, наружная оболочка которой мелкобугристая. Внутри яйца содержится личинка. Биология развития. Метастронгилюсы — биогельминты. Дефинитивные хозяева — свиньи, кабаны, промежуточные (олигохе-ты) — дождевые черви родов Eisenia, Bimastus и др., которые обитают в почве, навозе. Самки нематод откладывают в просвет бронхов яйца с развившейся личинкой, которые попадают с мокротой в глотку, заглатываются и вместе с фекалиями выделяются во внешнюю среду. В сырой почве из яиц редко выходят личинки. Дождевые черви вместе с почвой или навозом заглатывают яйца (личинки) этих нематод. Личинки в черве часто внедряются в толщу пищевода или его кровеносные сосуды, дважды линяют и через 11—21 сут становятся инвазионными. Свиньи заражаются при заглатывании дождевых червей с инвазионными личинками метастронгилюсов. В пищеварительном канале животного дождевые черви перевариваются, а освободившиеся личинки внедряются в слизистую кишечника, затем лимфогематогенным путем заносятся в легкие и через 25—35 сут в бронхах достигают половой зрелости. Продолжительность жизни нематод около одного года. 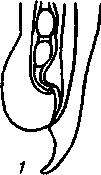 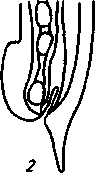 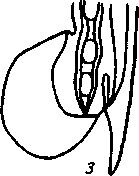 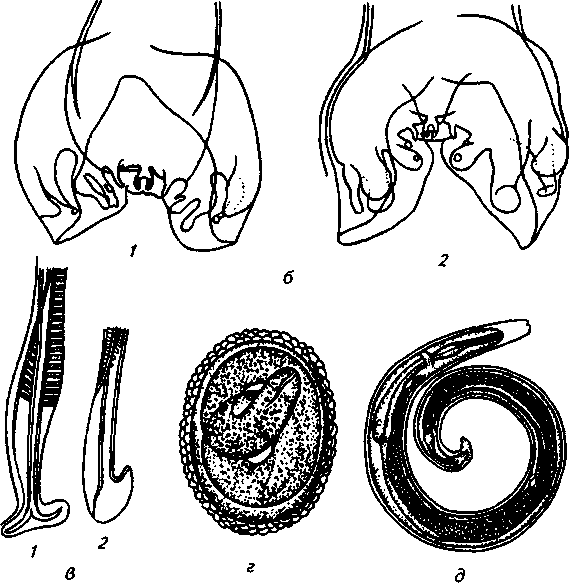 Рис. 56. Метастронгилюсы: а — мостовые концы самок: 1 — М. elongates; 2 — М. salmi; 3 — М. pudendotectus; 6 — бурсы самцов: 1 — м. salmi; 2 — М. pudendotectus; в — нижние концы спикул: 1 — М. salmi; 2 — М. pudendotectus; г — яйцо; д — личинка метастронгилид Эпизоотологические данные. В дождливые годы метастронги-лезы распространены более широко. Черви родов Eisenia и Bimastus обитают вблизи свинарников, живут 5—7 лет. ЭЙ у червей дости- гает 80 % при высокой ИИ — до 900 личинок. Плотность олигохет на территории свинарников на 1 м2 может достичь 1,5 тыс. экз. Чаще и интенсивнее болеют поросята. Инвазия нарастает постепенно, достигая максимума летом и осенью. Личинки в теле червей остаются жизнеспособными до 3 лет и более. Отмечались случаи зимних вспышек заболеваний свиней в утепленных свинарниках с земляными и особенно с плохими деревянными полами, настланными прямо на землю. В таких случаях черви скапливаются под досками. Свиньи могут переворачивать доски и поедать червей, инвазированных личинками гельминтов. Стационарно неблагополучными по метастронгилезам чаще бывают те хозяйства, где территория вокруг свинарников сильно занавожена и где свиней летом постоянно выпасают на сырых, ограниченных по площади выпасах. Патогенез. Мигрирующие личинки метастронгилюсов механически повреждают сосуды кишечника, лимфоузлы и альвеолы. Гиперсекреция в бронхах и бронхиолах как результат реакции организма на внедрившихся личинок обусловливает возникновение альвеолярных эмфизем и ателектозов. Яйца гельминтов при затрудненном и усиленном дыхании попадают в бронхиолы, которые могут травмировать их, даже перфорировать (при кашле). Возникает интерстициальная, интралобулярная эмфизема, всегда наблюдающаяся при бронхитах, пневмонии и ателектазах в результате метастронгилеза свиней. Дыхательная поверхность легких уменьшается, в результате развиваются одышка и кислородное голодание. Личинки нематод инокулируют в организм зараженных животных патогенную микрофлору. Установлено, что вирус инфлюэнцы свиней передается личинками гельминтов и сохраняется в инвазионных личинках в теле инвазионных червей до 32 мес. Вирус инфлюэнцы, пассажированный через личинок, обладает выраженными патогенными свойствами. Личинки в процессе миграции и развития выделяют продукты метаболизма — антигены. Из тела погибших личинок высвобождаются соматические антигены. Все это у зараженных животных вызывает аллергическую реакцию — эозинофи-лию, образование в печени, легких паразитарных узелков. Продукты обмена веществ взрослых гельминтов также являются мощным антигенным фактором, приводящим к аллергизации животных. В результате у больных животных развивается приобретенный иммунитет. У переболевших животных метастронгилюсы не достигают половой зрелости, гельминты вырастают меньших размеров, они менее плодовиты и меньше задерживаются в организме животного. Взрослые переболевшие животные легче переносят повторное заражение, тогда как молодняк 2—9 мес болеет тяжело. Развитие иммунитета сопровождается сложными иммуноморфологичес-кими реакциями, образованием в ткани легких и других органах (печени, почках) гиперплазии лимфоидной ткани и интенсивным образованием плазматических клеток. В сыворотке крови увеличивается количество свободных антител — гамма-глобулинов, сохраняющихся до 6—9 мес. Симптомы болезни. У поросят через месяц после заражения, начинается кашель. С развитием болезни он становится более частым и сильным, проявляется приступами. При беспокойстве сви4 ней, выходе их на свежий воздух кашель учащается и усиливается] Из носовых отверстий выделяется густая желтая слизь, отмечается истечение из глаз. Поросята отстают в росте и развитии, хотя anne-j тит сохранен и температура тела нормальная. В тяжелых случая наблюдаются рвота, расстройство функции пищеварения. Усиливаются слабость, сонливость, животные истощаются и нередко погибают. Слабая инвазия, у животных старше 6—8 мес. симптомы болезни протекают без выраженных признаков. Патологоанатомические изменения. При метастронгилезах наб людаются бронхиты, бронхиолиты, альвеолярная эмфизема, ателектазы, слизь, в которой клубки гельминтов преимущественно задних и средних долях легких. Слизистая бронхов на местах локализации метастронгилюсов разрыхлена, набухшая, гиперемирована.1 Объем легких увеличивается, цвет от серо-красного до серого. Участки ателектаза более темные и плотные. Просвет мелких брон-| хов заполнен слизью, содержащей лейкоциты, эпителиальные клет-| ки, мелкозернистую массу, личинок и яйца гельминтов. Структура! легочной ткани в случаях развития бронхопневмонии, осложненной! гнойными процессами, сильно изменена. В паренхиме легких и под! плеврой встречаются узелки, окруженные соединительной тканью! величиной от 1 до 5 мм в диаметре. Медиостенальные и бронхиаль-1 ные лимфоузлы увеличены, отечны. Диагностика. При жизни метастронгилезы диагностируют гель-1 минтоовоскопически по методу Щербовича. Эффективен метод! флотации с применением раствора аммиачной селитры. Кроме того, I учитывают эпизоотологические данные и симптомы болезни. При! посмертном исследовании обращают внимание на наличие нематод | в бронхах и патологические изменения в легких. Метастронгилез следует дифференцировать от бронхитов и| бронхопневмоний другой этиологии, в частности простудного происхождения. Этого добиваются в основном гельминтокопроско-пическими исследованиями. Лечение. При метастронгилезах эффективен антгельминтик I нилверм в дозах: поросятам живой массой до 20 кг — ОД г, более 50 кг — 0,25 г на животное, подсвинкам от 20 до 50 кг — 0,005 г/кг с | кормом один раз в день. Для преимагинальной профилактической дегельминтизации ука-1 занные дозы назначают два дня подряд, для лечебной — три дня. Фенбендазол (панакур) дают в дозе 5 мг/кг (по ДВ) двукратно в течение 2 сут в смеси с кормом. Вероятно, будут эффективны многие другие препараты, используемые при аскаридозе свиней, в том числе ивомек-премикс, раствор ивомека и фебантел. Профилактика и меры борьбы. Для профилактики метастронгилезов свиней в неблагополучных хозяйствах проводят ветеринарно-санитарные мероприятия. Навоз из помещений удаляют ежедневно для биотермической обработки. Деревянные полы в свинарниках должны быть плотными (без щелей). Выгульные дворики изолируют от прилегающей территории глубокой канавой, стенки которой должны быть строго вертикальны. Летние лагеря желательно строить на возвышенных местах. Не рекомендуется выпасать свиней сразу после дождя. Два раза в год животных дегельминтизируют: осенью за 10 сут до переведения свиней в помещение на стойловое содержание и весной до выхода на пастбище или выгульные дворики. Лечебные дегельминтизации проводят в любое время по необходимости. Дождевых червей уничтожают в местах их скопления и вокруг свинарников, применяя 10%-ный раствор поваренной соли из расчета 10 л на 1 м2. Это мероприятие лучше проводить после дождя.  3. Методы выявления молока коров, больных субклиническим маститом, и его санитарная оценка. Физико-химические исследования молока осуществляют при маститах следующим образом. Приготовляют водно-спиртовые рабочие растворы индикаторов: 5 г димастина растворяют в 100 мл дистиллированной воды; 2 г мастидина растворяют в 100 мл дистиллированной воды; 1 г кристаллической розоловой кислоты растворяют в 99 мл 60%-ного спирта-ректификата и к 9 мл этого раствора прибавляют 80 мл 60%-ного спирта-ректификата. Спиртовые реактивы сохраняются годами, если флаконы плотно закрыты резиновыми или стеклянными пробками; водные растворы димастина и мастидина пригодны к использованию несколько недель. Для исследования берут паренхимное молоко по 10— 15 мл в пробирки отдельно из каждой четверти вымени. По внешнему виду определяют его физические свойства— цвет, запах, консистенцию. Хлопья, сгустки и другие примеси устанавливают процеживанием через черную марлю или специальное сито. Пробирки с молоком ставят в холодильник (на ледник) при температуре 4—6° на 12—18—24 ч. Затем осматривают. В нормальном молоке осадка не образуется. При скрытом (субклиническом) мастите осадок имеется. Если проба отстаивания дает сомнительные результаты, то целесообразно провести дополнительные лабораторные исследования. Молоко исследуют на щелочность разными физико-химическими методами (табл.7). 1. На небольшую фарфоровую (кафельную) белую плитку, тарелочку или кусок обычного оконного стекла, под которое подложен лист белой бумаги, наносят пипеткой по 2—3 капли молока из каждого соска и прибавляют по столько же капель рабочего раствора розоловой кислоты, отмечают изменение цвета. 2. На молочно-контрольную пластмассовую пластинку с луночками наносят 1 мл исследуемого молока и к нему добавляют специальным клювиком 1 мл рабочего растворе димастина или мастидина. Индикатор и молоко перемешивают стеклянной или деревянной палочкой и отмечают изменение цвета и образование желеобразного сгустка (рис. 81). 3. Полоски индикаторной бумажки погружают в исследуемое и нормальное (контроль) молоко, вынимают, стряхивают с них оставшиеся капли, при бромтимоловом тесте (Чехословацкое производство) молоко наносят пипеткой или непосредственно из пробирки прямо на индикаторную бумажку и смотрят изменение окраски. Смачивать молоком индикаторные бумажки можно и непосредственно под коровой. При надаивании проб молока из вымени на молочно-контрольную пластинку последнюю держат отверстием по направлению к голове коровы (или наоборот), что позволяет легко ориентироваться, из какой четверти взято молоко в ту или иную луночку. Иногда молоко коров, не больных маститом, а также перед запуском и в первые дни после отела содержит значительное количество различных клеток, в том числе и лейкоцитов. Такое молоко с димастином и мастидином дает сомнительную реакцию. Но в таких случаях реакция выражена слабее, чем при заболевании маститом, и она отмечается во всех четырех луночках. Определение пигментов крови и гноя в молоке. Готовят рабочие растворы (по И. М. Беляеву): 5 г пирамидона растворяют в 95 мл 96%-ного спирта-ректификата; 50 мл уксусной кислоты растворяют в 50 мл дистиллированной воды; 5 г гваяковой смолы растворяют в 95 мл 90%-ного спирта-ректификата. Проба с пирамидоном-к 5 мл молока прибавляют 1 мл 50%-ного раствора уксусной кислоты, взбалтывают и добавляют 0,5 мл 5%-ного спиртового раствора пирамидона, 6—8 капель перекиси водорода. Если в молоке есть кровяные пигменты, жидкость окрашивается в светло-фиолетовый (аметистовый) цвет. Проба с гваяковой смолой. В пробирку наливают 1 мл 5%-ного спиртового раствора гваяковой смолы и 0,5 мл перекиси водорода или озонированного скипидара Смесь осторожно наслаивают на исследуемое молоко (предварительно налитое в пробирку — 5 мл). При содержании в молоке гноя или пигмента крови на границе соприкосновения жидкостей через 2— 3 мин образуется синее или темно-синее кольцо. При встряхивании вся жидкость окрашивается в темно-синий цвет. Проба с бензидином. Для выявления в молоке пигментов крови в пробирку наливают 5 мл 3%-ного раствора перекиси водорода и 2 мл насыщенного раствора бензидина в ледяной уксусной кислоте. Смесь тщательно взбалтывают и прибавляют в нее 2—10 капель исследуемого молока. При положительной реакции жидкость окрашивается сначала в зеленый цвет, а через 0,5—1 мин в темно-синий. При отрицательной реакции жидкость будет светлая с беловатым хлопьевидным осадком. Определение титра лизоцима в молоке. Вымя коровы обмывают теплой водой, высушивают полотенцем или индивидуальной салфеткой, соски дезинфицируют 70%-ным спиртом, после сдаивания из каждой четверти берут в стерильные пробирки по 5—10 мл молока. В чашку Петри (по одной на корову) на подсушенный МПА (рН 7,2) микропипеткой наносят 0,3—0,4 мл суточной бульонной культуры золотистого стафилококка штамма ВМ, предварительно разбавленной физиологическим раствором 1 : 10000, и, равномерно распределив на агаре, оставляют на 30—40 мин. Пробочником № 5 в агаре делают четыре луночки диаметром 10 мм. Затем в каждую луночку вносят стерильной пипеткой по 0,1 мл (2 капли) исследуемого молока. Чашки выдерживают при комнатной температуре (18—22°) 18 ч, после чего помещают в термостат на 5—6 ч и затем просматривают. Если молоко содержит лизоцим молока (М), то вокруг луночки отмечается задержка роста стафилококков в виде кольца По диаметру кольца задержки роста микроба определяют титр лизоцима молока; задержка роста меньше 16 мм — молоко от коровы, больной субклиническим маститом; 17—24 мм — сомнительное; 25 мм и более — молоко от здоровой коровы. Определение лейкоцитов в молоке. В специальные пробирки до отметки 10 наливают молоко и центрифугируют 5 мин при 2000 оборотах в минуту. Определяют, есть ли осадок в узком конце пробирки. Если уровень осадка ниже отметки 1, молоко считается нормальным, если осадок достигает отметки 1 и выше, это служит показателем заболевания вымени и недоброкачественности молока. Проводят подсчет лейкоцитов по методу Брида. В 1 мл молока здоровых четвертей содержится до 500 тыс. соматических клеток; при маститах количество их значительно увеличивается. Определение каталазы с помощью всплывания диска. Метод можно использовать при массовых исследованиях проб молока непосредственно в хозяйстве. Из хроматографической бумаги марки Ф-1 готовят диски диаметром 12 мм. Приготавливают (в день исследования) 3%-ный раствор перекиси водорода на М/15-фосфатном буфере, рН 7,2. Бумажный диск погружают пинцетом в тщательно перемешанную пробу испытуемого молока, а затем переносят в раствор перекиси водорода, предварительно налитый в количестве 5 мл в пробирку размером 60X16 мм. Время, прошедшее от момента погружения диска и до его всплывания на поверхность, отмечают по секундомеру. При наличии клеток в молоке (до 100 тыс. в 1 мл) время всплывания диска равно 1—5 мин, свыше 200 тыс. в 1 мл — диск всплывает за 30—35 с. При маститах диск всплывает за 3—7 с или мгновенно. Молоко с положительными или сомнительными реакциями в продажу не допускается, его уничтожают. Ситуационное задание В хозяйстве на двух производственных отделениях содержится 640 голов крупного рогатого скота. При плановых серологических исследованиях на лейкоз, 76 голов реагировали в РИД. Хозяйство расположено в неблагополучном по лейкозу районе. Какие действия должен провести главный врач ветеринарной медицины хозяйства Дейсвовать необходимо согласно инструкции государственного департамента ветеринарной медцины по профилактике и ликвидации лейкоза КРС. ІНСТРУКЦІЯ по профілактиці та оздоровленню великої рогатої худоби від лейкозу І. Загальні положення 1.1. Лейкоз великої рогатої худоби — інфекційна, повільно перебігаюча хвороба, яка характеризується ураженням кровотворної системи з проявленням лімфоцитозу у крові, пухлиноподібних утворень в органах і тканинах організму. Хвороба має три послідовні стадії: інкубаційну, коли тварина вже заражена збудником, але антитіла в неї ще не виявляються; продромальну — з моменту виявлення позитивної на лейкоз серологічної реакції; повного розвитку — після виявлення гематологічних і клінічних ознак хвороби. Лікування та специфічна профілактика лейкозу не розроблені. 1.2. Збудник лейкозу великої рогатої худоби — онкоген-ний РНК — вірус, який паразитує у лейкоцитах. Вірус нестійкий до нагрівання, гине при температурі 76°С. 1.3. До вірусу лейкозу великої рогатої худоби сприйнятливі: велика рогата худоба, вівці, кози, свині, кролі, миші незалежно від породи, віку і продуктивності. 1.4. Джерелом збудника хвороби є заражені вірусом лейкозу тварини на всіх стадіях перебігу хвороби. 1.5. Вірус виділяється з організму заражених тварин з кров'ю, молоком, іншими секретами й екскретами, які містять лейкоцити. 1.6. Факторами передачі вірусу можуть бути молоко, кров та інші матеріали, які містять складові частини крові хворих тварин. 1.7. Тварини можуть заражатися при потраплянні збудника парентеральне, ентерально, внутріутробно. 1.8. Основою ефективного забезпечення благополуччя тваринництва щодо лейкозу є: 1.8.1. Своєчасна діагностика хвороби. 1.8.2. Чітке знання епізоотичної ситуації в кожному стаді. 1.8.3. Негайне вилучення зі стад (ферм) вірусоносіїв і забій тварин з гематологічними та клінічними ознаками лейкозу. 1.8.4. Забезпечення чіткого зоотехнічного обліку і нумерації тварин. 1.8.5. Дотримання ветеринарно-санітарних правил на фермах. 1.8.6. Забезпечення асептики й антисептики при масових обробках тварин (нумерація тварин, взяття крові, вакцинація, алергічні дослідження). 1.9. Проведення ретельної дезінфекції тваринницьких будівель та обладнання після кожного дослідження тварин і ізоляції вірусоносіїв. 2. Діагностика лейкозу 2.1. Відбір, доставку проб у лабораторію, їх дослідження проводять згідно з діючими методичними вказівками по діагностиці лейкозу великої рогатої худоби. 2.2. Дослідження на лейкоз проводять серологічним, клінічним, гематологічним, патологоанатомічним і гістологічним методами. 2.3. Основним методом прижиттєвої діагностики лейкозу є серологічний — реакція імунодифузії (РІД). 2.4. Гематологічний і клінічний методи досліджень використовують для визначення стадії повного розвитку хвороби у серопозитивних тварин. 2.5. Патологоанатомічними дослідженнями визначають ступінь ураженості органів злоякісними новоутвореннями, а гістологічними — встановлюють морфологічні форми лейкозу. 2.6. Діагноз на лейкоз вважають встановленим при наявності одного з таких показників: позитивного результату серологічного дослідження по РІД; типових патологоанатомічних ознак хвороби; позитивного результату гістологічного дослідження патологічного матеріалу. 290 2.7. Тварину вважають хворою при наявності позитивного результату серологічного дослідження по РІД і включають у звіт (ф. 1-вет). 3. Заходи у благополучних щодо лейкозу стадах, фермах, господарствах 3.1. Благополучним щодо лейкозу великої рогатої худоби є стадо, ферма, господарство, в яких при серологічних дослідженнях у тварин не виявлені антитіла до вірусу лейкозу. 3.2. Серологічні дослідження тварин проводять, починаючи з 4—6-місячного віку. 3.2.1. У стадах громадської та інших форм власності — один раз на рік. 3.2.2. Бугаїв-плідників в племпідприємствах, господарствах, а також тварин-продуцентів крові біофабрик та біо-цехів — через кожні шість місяців. 3.3. Тварин, завезених у господарство для племінних і користувальних цілей, досліджують на лейкоз серологічне в період карантинування. 3.4. При виявленні у завезених тварин позитивних серологічних реакцій на лейкоз, все поголів'я, яке надійшло, підлягає поверненню господарству-постачальнику (продавцю) або забою при його згоді. 3.5. Забороняється введення серопозитивних тварин у благополучні стада. Формування фермерських, орендних та індивідуальних господарств проводять тільки серологічне негативними тваринами. 3.6. Реалізація тварин із благополучних господарств дозволяється без обмежень при умові, що такі тварини за ЗО днів до цього досліджені серологічне з негативними результатами. 4. Заходи у неблагополучному щодо лейкозу господарстві, фермі, стаді 4.1. Господарство, ферму, стадо, в яких діагноз встановлено серологічним методом при двократному дослідженні з інтервалом 30—45 днів, оголошують неблагополучними щодо лейкозу і вводять обмеження розпорядженням районної державної адміністрації. В неблагополучному господарстві розробляється план організаційно-господарських, ветеринарно-санітарних і спеціальних заходів по ліквідації лейкозу, який затверджується головним державним інспектором ветеринарної медицини району або області і додається до розпорядження районної державної адміністрації. У разі встановлення в окремих тварин тільки патоморфо-логічних змін, характерних для хвороби, проводять двократне серологічне дослідження з інтервалом 30—45 днів поголів'я старше 4—6-місячного віку. Якщо при цьому в тварин не виявлені антитіла до вірусу лейкозу, господарство вважається благополучним. В такому господарстві проводиться аналіз епізоотичного стану за результатами діагностичних досліджень на лейкоз, вивчення джерела і шляхів занесення інфекції та конкретних умов, які сприяли виникненню захворювання в окремої тварини. Результат цієї роботи оформляють в акті спеціалістів за участю представника державної ветеринарної медицини. 4.2. Виявлених при дослідженні РІД-позитивних тварин таврують літерою "Л" на лівому масетері або мітять іншим способом та ізолюють в окремі приміщення або ферми. 4.3. В неблагополучному стаді, фермі забороняється: 4.3.1. Використовувати без попереднього знезараження молоко для громадського харчування і згодовування тваринам, продавати його державі та на ринках. 4.3.2. Реалізовувати тварин для племінних та користувальних цілей, крім випадків, передбачених п. 4.4.8 та п. 4.4.8.1. 4.3.3. Використовувати бугаїв-плідників для парування корів і телиць. 4.3.4. Використовувати сперму від серопозитивних бугаїв-плідників. Запаси сперми, одержані від інфікованих бугаїв за 6 міс до встановлення діагнозу на лейкоз, підлягають знищенню. 4.3.5. Перегруповувати тварин без відома ветеринарного спеціаліста господарства. 4.3.6. Заготовляти кров і молозиво для виготовлення ветеринарних і медичних лікувально-профілактичних препаратів, проводити гемотерапію. 4.3.7. Вивозити тварин з гематологічними та клінічними ознаками лейкозу у спецгоспи по вирощуванню та відгодівлі великої рогатої худоби. 4.3.8. Використовувати нестерильні інструменти, прилади, апарати при проведенні лікувально-профілактичних, зоотехнічних і технологічних заходів. 4.3.9. Доїти в одному доїльному залі одними доїльними апаратами корів, заражених й незаражених вірусом лейкозу. 4.3.10. Використовувати одне родильне приміщення для корів, заражених й незаражених вірусом лейкозу. 4.3.11. Використовувати молозиво корів, заражених вірусом лейкозу, для напування телят від здорових корів. 4.3.12. Запліднювати серопозитивних телиць для відтворення стада. 4.3.13. Постачати телят у спецгоспи по вирощуванню нетелей. 4.4. Оздоровлення неблагополучних щодо лейкозу стад, ферм проводять: 4.4.1. При інфікованості корів до 6% — шляхом здачі всіх серопозитивних тварин на забій. 4.4.2. При інфікованості корів більше 6% — шляхом розділення стада на серонегативних і серопозитивних тварин, вирощування вільних від вірусу лейкозу теличок, нетелей і первісток для подальшої заміни інфікованих тварин (по корівниках, фермах). 4.4.3. В окремих господарствах оздоровлення може проводитися шляхом одночасної повної заміни неблагополуч-ного стада, ферми тваринами, завезеними з благополучних ферм, господарств. 4.4.4. Серологічні дослідження серонегативних тварин, старших 4—6-місячного віку, проводять систематично з інтервалом 30—45 днів. Серопозитивних тварин, старших 2-х років, досліджують клініко-гематологічно протягом 15 днів після розділення стада, а надалі один раз на рік; тварин з гематологічними або клінічними ознаками лейкозу не пізніше 15 днів після їх виявлення здають на забій. Серопозитивних тварин утримують і експлуатують в окремому приміщенні, стаді, фермі з урахуванням ступеня ураженості стада не довше 2—4 років: при інфікованості корів до 30% — не довше 2-х років; при інфікованості корів більше 30% — не довше 4-х років. Тварини, у яких встановлено позитивну на лейкоз серологічну реакцію (РЩ), повторному серологічному дослідженню не підлягають. 4.4.5. Молоко від серопозитивних тварин, яких утримують ізольовано від серонегативного стада, пастеризують у господарстві при температурі не нижче 80°С (тільки при такому режимі можна здійснювати контроль якості пастеризації за допомогою реакції на пероксидазу), після чого його можна використовувати для згодовування телятам або здавати на молокозавод. Молоко від корів серонегативного стада можна продавати державі без попередньої пастеризації. У випадку, коли серопозитивні на лейкоз тварини не відділені від загального стада, молоко від всього поголів'я ферми підлягає пастеризації в зазначених режимах. В окремих випадках (при виконанні організаційно-господарських і спеціальних оздоровчих протилейкозних заходів та відсутності пастеризаторів у господарствах) допускається, з письмового дозволу Головного державного інспектора ветеринарної медицини Республіки Крим, областей, тимчасовий вивіз сирого молока окремим транспортом на молокозавод для технологічної пастеризації і подальшої переробки. Допускається також на підставі розпорядження державної адміністрації організовувати госпрозрахункові міжгосподарські пастеризаційні пункти на базі підприємств молочної промисловості або використовувати для цієї мети окремі лінії по переробці молока. Молоко від серопозитивних тварин, яких утримують ізольовано від серонегативного стада, може піддаватися сепарації в господарстві. При цьому на молокопереробне підприємство вивозять тільки пастеризовані вершки; перегін кип'ятять і згодовують тваринам. 4.4.5.1. Молоко від корів з клінічними (гематологічними) ознаками лейкозу забороняється використовувати на харчові цілі та згодовувати тваринам. Таке молоко денатурують шляхом додавання до нього 5%-ного формальдегіду, креоліну або іншої дезінфікуючої речовини. 4.4.6. Телят до 7-денного віку випоюють материнським молоком, а надалі — пастеризованим молоком. 4.4.7. Неблагополучні щодо лейкозу племінні господарства або ферми за поданням Головного державного інспектора ветеринарної медицини району, області, Республіки Крим та України позбавляються статусу племінних до їх повного оздоровлення. 4.4.8. У спецгоспи або ферми по вирощуванню нетелей поставляють телят не старше 20 днів тільки із благополучних щодо лейкозу господарств, ферм. При виявленні в спецгоспах або фермах по вирощуванню нетелей інфікованих тварин весь серопозитивний молодняк передають на відгодівлю, а серопозитивних нетелей і первісток — у неблагополучні щодо лейкозу господарства для утримання в серопозитивному стаді. Серо-негативних первісток і нетелей передають у неблагополучні господарства для утримання в серонегативному стаді. 4.4.8.1. При комплектуванні господарства, ферми, які оздоровлюють від туберкульозу шляхом повної заміни неблагопо-лучного поголів'я, з письмової згоди керівника господарства і після погодження з Кримським республіканським, обласними управліннями державної ветеринарної медицини, дозволяється завезення телиць для користувальних цілей з благополучних ферм, приміщень неблагополучного щодо лейкозу господарства при умові, що тварини досліджені на лейкоз серологічним методом з негативним результатом. 4.4.9. В індивідуальних, фермерських господарствах заражені вірусом лейкозу тварини підлягають здачі на забій. Забороняється їх випас у загальних стадах і продаж від них молока державі та на ринках. Одержане до здачі корів на забій молоко підлягає пастеризації або кип'ятінню з використанням його лише в цьому господарстві. 4.4.10. З метою недопущення поширення хвороби та забезпечення оздоровлення від лейкозу худоби особистих господарств рекомендується колгоспам і радгоспам приймати від громадян, що проживають на їх території, для здачі на забій заражену худобу і на взаємних розрахунках продавати їм з благополучних щодо лейкозу відділків, ферм, приміщень здорових телиць, нетелей або корів. 4.4.11. Після кожного дослідження та ізоляції хворих тварин проводять дезінфекцію приміщень і обладнання відповідно до діючої інструкції по проведенню ветеринарної дезінфекції об'єктів тваринництва. Застосовують звичайні дезінфікуючі засоби: 2%-ний розчин їдкого натрію, 2%-ний розчин хлорного вапна (по АДР), 20%-ну суспензію свіжога-шеного вапна, 5%-ний розчин кальцинованої соди, 2%-ний розчин формаліну, параформальдегіду. 4.4.12. Тварини з гематологічними та клінічними ознаками лейкозу підлягають забою на санітарній бойні. При її відсутності дозволяється таку худобу забивати на загальному конвеєрі після завершення забою здорових тварин і видалення із цеху одержаних від цього туш та інших продуктів. При цьому забороняється використовувати кров, ендокринні та інші органи на харчові цілі та для виготовлення ветеринарних та медичних препаратів. Приміщення та обладнання цеху після забою хворих тварин підлягають старанному прибиранню і дезінфекції. Всі випадки виявлення лейкозу, а також пухлин різного походження підлягають реєстрації в журналі обліку ветеринарно-санітарної експертизи м'яса і субпродуктів в цеху первинної переробки худоби і на санітарній бойні м'ясокомбінату та подаються у звіт (форма № 6-вет). 4.4.13. При ветеринарно-санітарній оцінці туш, внутрішніх органів та інших продуктів, одержаних від забою хворих на лейкоз тварин, керуються діючими правилами ветеринарного огляду забійних тварин і ветеринарно-санітарної експертизи м'ясних продуктів, доповненнями до них. 4.4.14. Гній та очисні води утилізують на загальних підставах. 4.4.15. Господарство, ферму, стадо вважають оздоровленими після вивезення усіх серопозитивних тварин та одержання двох підряд негативних результатів серологічного дослідження (з інтервалом 30—45 днів) худоби старше 4—6-місячного віку. В перший рік після оздоровлення серологічні дослідження проводять через 6 місяців, а надалі — згідно з пп. 3.2. та 3.2.1. 5. Обов'язки і відповідальність керівників господарств, фермерів, громадян — власників тварин, ветеринарних працівників 5.1. Керівники господарств (підприємств), фермери, громадяни — власники тварин згідно із Статутом ветеринарної медицини України зобов'язані забезпечити проведення передбачених діючою інструкцією організаційно-господарських, спеціальних і санітарних заходів по запобіганню захворювання тварин лейкозом, а також по ліквідації вогнища інфекції у разі його виникнення. 5.2. Ветеринарні фахівці державної адміністрації районів, міст, установ, організацій і підприємств відповідають за своєчасну діагностику хвороби і розробку протилейкозних заходів у тваринництві, а також організовують їх виконання на місцях. 5.3. Спеціалісти обласних управлінь державної ветеринарної медицини зобов'язані здійснювати постійне керівництво і контроль за виконанням заходів по профілактиці та ліквідації лейкозу великої рогатої худоби в господарствах (підприємствах) і населених пунктах. Інформувати про стан цієї роботи місцеву державну адміністрацію, господарські та вищестоящі ветеринарні органи. 5.4. За порушення заходів, передбачених цією інструкцією, невиконання розпорядження місцевої державної адміністрації винні особи підлягають штрафу або притягаються до іншої відповідальності. З виходом цієї інструкції відміняється "Инструкция по ликвидации лейкоза крупного рогатого скота в хозяйствах Украинской ССР от 24 августа 1990 года № 043-1" та відповідні зміни і доповнення до неї. Інструкція розроблена спеціалістами Головного управління ветеринарної медицини з держветінспекцією Міністерства сільського господарства і продовольства України (П.П.Достоєвський, А.Т.Борзяк), Інституту експериментальної і клінічної ветеринарної медицини Української академії аграрних наук (В.О. Бусол, М.С.Мандигра), Білоцерківського сільськогосподарського інституту (Б.М.Ярчук), Центральної державної лабораторії ветеринарної медицини (В.С.Ковалюшко) та розглянута 3 липня 1992 року на науково-технічній раді секції "Ветеринарія" Головного управління ветеринарної медицини з державною ветеринарною інспекцією Міністерства сільського господарства і продовольства України. |
