Заразные болезни. Сибирская язва (Anthrax) остропротекающая инфекционная болезнь, характеризующаяся признаками септицемии и тяжелой интоксикации, а также образованием карбункулов
 Скачать 3.52 Mb. Скачать 3.52 Mb.
|
Лечение запрещено. Иммунитет. Выжившие свиньи остаются долгое время вирусоноси-телями. В их организме обнаруживаются комплементсвязывающие, преципитирующие, типоспецифические и задерживающие гемадсорбцию антитела. Вируснейтрализующие (защитные) антитела не вырабатываются. В связи с этим многочисленные попытки получить инактивированные или живые иммуногенные вакцины не дали положительных результатов. Живые вакцины из ослабленных штаммов вируса вызывают у привитых животных хроническое течение болезни и длительное вирусоносительство, что опасно в эпизоотическом отношении. Профилактика и меры борьбы. Профилактика включает общие мероприятия, направленные прежде всего на предотвращение заноса вируса в страну. С этой целью запрещают ввоз свиней (в том числе диких) и продуктов их убоя из стран, неблагополучных и угрожаемых по АЧС. Осуществляют строгий надзор в международных и воздушных портах, на пограничных, железнодорожных и шоссейных пунктах за ввозом животных, продуктов и сырья животного происхождения. Уничтожают пищевые отходы и мусор, собираемые из различных средств транспорта, прибывающего из-за рубежа. Во всех свиноводческих хозяйствах должны соблюдаться ветеринарно-санитарные правила по предупреждению заноса возбудителей инфекционных болезней. В случае возникновения чумы неблагополучный пункт (хозяйство) карантинируют. При необходимости допускается карантиниро-вание группы хозяйств, района или группы районов, области, края, республики. Вокруг очага африканской чумы определяют угрожаемую зону на глубину 5 — 20 км от границ эпизоотического очага и зону возможного заноса вируса, непосредственно опоясывающую угрожаемую зону, глубиной до 100—150 км. Всех свиней в эпизоотическом очаге уничтожают бескровным методом. Убитых и павших свиней, навоз, остатки кормов, тару и малоценный инвентарь сжигают. Несгоревшие остатки можно перемешать с хлорной известью и зарыть на глубину не менее 2 м. Проводят трехкратно с интервалом 3 — 5 дней дезинфекцию помещений, загонов и других мест, где содержались свиньи. Для дезинфекции используют раствор хлорной извести, содержащий 4% активного хлора; гипохлорит натрия или кальция, содержащий 2 — 3% активного хлора; 5%-ный р-р однохлористого йода; формолсодержащие препараты. Одновременно проводят дезинсекцию и дератизацию. В угрожаемой зоне убивают всех свиней во всех категориях хозяйств на специально оборудованных убойных площадках или на ближайшем мясокомбинате. Мясо и другие продукты убоя свиней перерабатывают на вареные колбасы или консервы. В хозяйствах зоны возможного заноса вируса все свинопоголовье содержат под ветеринарным наблюдением и систематически вакцинируют против классической чумы и рожи. В случае появления заболевания с признаками чумы среди поголовья, вакцинированного против классической чумы, срочно принимают меры против африканской чумы. Карантин с неблагополучного пункта снимают через 30 дней после уничтожения всех свиней в очаге чумы и убоя свиней в угрожаемой зоне Ввод свиней в помещения, где была африканская чума, разрешают через 6 мес после снятия карантина и постановки биологического контроля. Ограничения в хозяйствах угрожаемой зоны и зоны возможного заноса вируса отменяют через 6 мес после снятия карантина с неблагополучного по африканской чуме свиней пункта. В последующем свинофермы, ранее располагавшиеся в угрожаемой зоне, комплектуют только свинопоголовьем, вакцинированным против классической чумы и рожи. Вывозить свиней из этих хозяйств в другие в течение 6 мес запрещено. 2. Гастрофилезы непарнокопытных Хронически протекающие болезни непарнокопытных (лошадей, ослов и мулов), вызываемые личинками желудочно-кишечных оводов семейства Gastrophilidae, рода Gastrophilus. Возбудители. Наиболее распространены следующие виды: G. intestinalis — большой желудочный овод, крючок; G. veterinus —овод — якорек; G. nigri-cornis — черноус. Большой желудочный овод — имаго (рис. 168) — желтовато-бурого цвета, длиной 10—15 мм. Голова большая, с расположенными фасеточными глазами по бокам и тремя простыми — на темени. Среднеспинка темная, покрыта светло-желтыми или буроватыми волосками. Крылья с темными пятнами. Брюшко овальное, яйцеклад резко подогнут под брюшко. Яйца желтоватые, клиновидные, поперечно исчерчены, длиной до 1,25 мм. Личинка 1-й стадии веретенообразной формы, длиной около 1 мм, белого цвета, состоит из 13 сегментов. На голове два подвижных изогнутых крючка, между ними ротовое отверстие. Личинка 3-й стадии овально-цилиндрическая, длиной до 20 мм. Приротовые крючья мощные, изогнутые. Сегменты со 2-го по 10-й несут по два ряда шипов: в первом ряду крупные, во втором мелкие (рис. 169). Двенадцатиперстник — черно-коричневого цвета, длиной 12— 684 13 мм. Голова уже среднеспинки. Грудь и ноги черные. Крылья прозрачные, без пятен. Брюшко темное, покрыто густыми волосками. Личинка 3-й стадии длиной до 20 мм, шипы на сегментах расположены в один ряд. Усоклей — имаго темно-бурого цвета, длиной 9—11 мм. Голова крупная. Крылья прозрачные, ноги коричневато-желтые, покрыты волосками. Брюшко удлиненное, темно-коричневое. Личинка 3-й стадии длиной до 18,5 мм, мелкие шипы на сегментах расположены в два ряда, последние 3 сегмента без вооружения. Травняк — самки темно-бурого цвета, длиной 16 мм, самцы немного светлее, длиной до 13 мм. Голова уже груди. Лоб узкий. Грудь коричневая, среднеспинка черная с двумя продольными светлыми полосами. Крылья дымчатые. Личинки 3-й стадии длиной до 20 мм, от остальных отличаются наличием срединной группы шипов на псевдоцефале. Шипы первого ряда на члениках в 2 раза крупнее шипов второго ряда. Якорек — имаго похоже на большого желудочного овода, но меньше его по размерам, длина тела 9—11 мм, серого цвета, крылья пятнистые. Личинка 3-й стадии длиной до 16 мм, с сильно загнутыми назад ротовыми крючками. Черноус — имаго серовато-желтого цвета, длиной 10—11 мм. Грудь и брюшко черные, покрыты волосками серо-желтого цвета. Задний край брюшка округленный. Личинка 3-й стадии длиной до 22 мм, первый грудной членик цилиндрической формы, что отличает ее от других видов рода. Биология развития. Желудочные оводы развиваются с полным метаморфозом. Плодовитость самок в зависимости от вида 300— 2500 яиц. Самки крючка откладывают яйца на лету, приклеивая их к волосу чаще на конечности, плечи, бока; усоклея — на тонкие волоски губ; двенадцатиперстника — на волосы межчелюстного пространства, малого желудочного овода — в области массетеров; черноуса — на волосы вокруг рта; травняка — на растения. Личинки в яйцах развиваются в течение 7—16 сут, однако их вылупления сразу не происходит. Они могут сохранять жизнеспособность в яйце 1,5—3 мес. Чтобы личинки вышли из яйца, необходимы определенные условия (влажная среда, температура 37—42 °С, прикосновение постороннего предмета), которые создаются при расчесывании зубами мест прикрепления их или при водопое. Вышедшие из яиц личинки попадают в ротовую полость, прикрепляются к слизистой оболочке различных ее разделов и паразитируют в течение 21— 28 сут, после чего линяют и переходят во 2-ю стадию. Развитие личинок 2-й и 3-й стадий большинства видов происходит в кардиаль-ной части желудка, a G. veterinus — в двенадцатиперстной кишке. Весной следующего года личинки 3-й стадии покидают желудок и вместе с фекалиями выходят наружу. Окукливание происходит в поверхностном слое почвы. Фаза куколки длится 16—54 сут, после его из нее вылупляется имаго. В южных районах оводы могут давать два поколения в год. Эпизоотологические данные. В умеренном климате лёт оводов отмечен в июле—августе, на юге сроки лёта более растянуты. Источником инвазии служат больные гастрофилезом животные, которые рассеивают личинки по территории хозяйств, на пастбищах и т. п. Наиболее благоприятные условия для развития имаго и заражения лошадей представляет жаркая сухая погода. На лошадь может быть отложено до 3—5 тыс. яиц. Патогенез. Болезнь сопровождается значительным воспалением слизистой оболочки ротовой полости, желудка, нативной части и двенадцатиперстной кишки. В желудке и кишечнике образуются язвы, возникает желудочное и кишечное кровотечение. В прямой кишке личинки усоклея и травняка вызывают катаральное воспаление, значительное скопление личинок может привести к ее выпадению. Симптомы болезни. Животные, больные гастрофилезом, часто истощены, шерсть их взъерошена, без блеска, слизистые оболочки анемичны, аппетит понижен. Отмечают понос, колики. При локализации личинок в глотке и области мягкого неба появляется кашель, во время водопоя из носа таких животных вытекает вода, затрудняются пережевывание и глотание корма. Личинки черноуса и якорька, мигрирующие в коже щек, вызывают дерматит, складки и язвы на губах. Диагностика. При обследовании кожно-волосяного покрова обнаруживают яйца оводов, в ротовой полости — личинок 1-й стадии. Во время осмотра корня языка и глотки рот лошади раскрывают с помощью зевника, а ротовую полость освещают рефлектором, язык предельно вытягивают или прижимают шпателем. Наиболее удобно использовать гибкий эндоскоп Мачида ФГС-БЛ. Зимой и ранней весной диагноз можно поставить по обнаружении в кале личинок после дачи внутрь 40—60 мг/кг кристаллического хлорофоса в водном растворе, пасты эквалана и других препаратов, вызывающих гибель личинок и их массовое выделение. Предложены аллергический и серологический (РНГА) методы диагностики гастрофилеза. Лечение. Основополагающим мероприятием в системе мер борьбы с гастрофилезом является ранняя химиотерапия, проводимая в конце сентября—ноябре. Для ранней химиотерапии применяют хлорофос, амидофос, эстрозоль, эквалан и др. Хлорофос используют только кристаллический из расчета 40 мг/кг и применяют следующими методами: орошают 5%-ным раствором хлорофоса зернофураж или сено и скармливают по 1 кг на животное; используют кормовые гранулы с хлорофосом. Молодняку их скармливают 0,5 кг, взрослым животным — 1—1,2 кг гранул на голову; эффективно групповое вольное выпаивание 0,1%-ного 686 раствора хлорофоса, а также скармливание его со снегом в течение 10—12 ч. Амидофос применяют таким же образом, что и хлорофос. Фасковерм используют внутримышечно в дозе 1 мл на 20 кг массы тела; эквалан применяют внутрь в дозе 0,2 мг/кг массы тела. Препаратом эстрозоль лошадей обрабатывают в закрытых помещениях при норме расхода 60 мг/м3 при экспозиции 1 ч. В зонах с двумя генерациями овода химиотерапию проводят в конце июля—августе и октябре—ноябре. Профилактика. Для предупреждения нападения имаго желудочных оводов в период их массового лёта лошадей опрыскивают 0,05%-ной водной эмульсией перметрина с нормой расхода 500 мл на взрослое животное и 250 мл на жеребенка или 0,25%-ной эмульсией с нормой расхода соответственно 100 и 50 мл. Эффективна также 10%-ная водная эмульсия ТСН из расчета 0,5—1,0 л на лошадь, 3%-ная водная эмульсия оксамата — 1,5—2,0 л на лошадь. Весной личинок, выпадающих на окукливание, собирают и уничтожают путем биотермического обеззараживания фекалий. 3. Серологические реакции Микробные клетки несут на своей поверхности разнообразные антигены, среди которых имеются детерминанты, общие нескольким микроорганизмам или даже идентичные животным клеткам и уникальные, присущие только данному виду или варианту микроскопических существ. Токсигенные штаммы обычно содержат эти специфичные детерминанты и в экзопродуктах. Для успешного проведения иммунохи-мического анализа очень важно получить антисыворотку (то есть иммунную сыворотку) на максимально очищенные специфичные для вида или варианта антигены. Достигается это предварительной дезинтеграцией микробных структур, выделением и очисткой необходимых антигенных комплексов, а также путем специфической адсорбции антисыворотки, полученной на взвесь целых микробных клеток к их оболочкам или на раствор экзотоксина. Пользуются и разведением антисыворотки, чтобы избавиться от неспецифических реакций. Специфичную антисыворотку используют для иммунохимической идентификации антигенов в нативном виде или в виде конъюгатов с видимыми под обычным световым микроскопом ферментами, обнаруживаемыми под люминесцентным микроскопом флуорохромами или видимыми под электронным микроскопом контрастерами. В ветеринарной практике приходится также анализировать растворимые антигены микроорганизмов. Иммунохимической идентификации обычно подвергают клостридии, эшерихии, стафилококки и некоторые другие продуценты экзотоксинов, а также органы и ткани животных, инфицированных сибиреязвенным микробом. Причем в первом случае экзотоксины накапливают обычно культивированием бактерий на специальных средах, во втором — преципитиноген экстрагируют изотоническим раствором хлорида натрия. В лабораториях чаще идентифицируют взвесь микробных клеток, то есть корпускулярный антиген. Для обнаружения и идентификации растворимых антигенов применяют целый ряд методов, основанных на феномене преципитации. Наиболее популярной в ветеринарной практике является кольцевая реакция преципитации (РП), предложенная Асколи в 1902/. для обнаружения сибиреязвенного антигена в кожевенном сырье. Ставят ее в специальных узких пробирках и при появлении помутнения на границе между антисывороткой и антигеном можно идентифицировать гомологичный антисыворотке антиген в течение нескольких минут. Простота и доступность пробирочной РП обеспечили широкое применение ее в ветеринарно-санитарной экспертизе и криминалистике для определения видовой принадлежности мяса или идентификации крови. При постановке РП с меченным радиоактивным йодом антигеном, не превышающим молекулярную массу альбумина (то есть не выпадающим в осадок при 50%-ном насыщении сульфатом аммония), можно установить общее количество, образовавшихся антител. Этой методикой Фарра экспериментаторы пользуются для определения антигенсвя-зывающёй способности антител. На принципе преципитации основана также реакция нейтрализации, сущность которой сводится к предннкубации токсинов, ферментов или реже вирусов с гомологичными антисыворотками с последующим воздействием смеси ингредиентов на живую систему (организм, культуру тканей или клеток). В результате предварительного выдерживания смеси антител с растворимым антигеном в пробирке последний обезвреживается, что подтверждается реакцией живой системы. Реакцию впервые продемонстрировали Беринг и Китазато в 1890 г. на модели столбнячных токсина и антитоксина. В настоящее время ее используют для видовой и особенно внутривидовой идентификации токсигенных Cl. perfringens, Cl.botulinum и некоторых других микроорганизмов. Применение реакции преципитации в жидкой среде не позволяет, однако, характеризовать гетерогенность антигенов, то есть количество и концентрацию антигенов в препарате. Данные сведения можно получить, если поставить РП в геле (чаще в агаровом) или реакцию диффузионной преципитации (РДП). Обладая разной скоростью передвижения, различные антигены препарата неодинаково диффундируют, образуя в толще прозрачного геля на месте встречи с гомологичным антителом преципитаты Локализация и конфигурация линий преципитатов будут характерны для каждого компонента антигенного препарата, что служит критерием оценки его качества. Путем разведения препарата можно характеризовать относительное содержание в нем антигенов. Если в среде геля диффундирует один реагент (обычно антиген), реакцию называют простой или одномерной диффузии, а если навстречу друг другу одновременно диффундируют оба реагента (антиген и антитело), ее называют реакцией двумерной или двойной диффузии. Реакцию одномерной диффузии можно поставить в пробирке и на стеклянной пластинке. Пробирочный вариант РДП был впервые разработан в 1946 г. Оудином. На дно узкой пробирки помещали антисыворотку, смешанную с агаровым гелем и сверху заливали раствором антигена, покрытым слоем вазелинового масла. Антиген диффундировал в подлежащий слой геля и, вступая в реакцию с антителами, образовывал в нем линии преципитации. По их количеству и локализации судили о качестве антигенного препарата. Манчини в 1965 г. предложил пластинчатый вариант одномерной РДП, который получил название реакции радиальной имму-нодиффузии (РИД) из-за того, что антиген диффундирует из лунок радиально в гель, смешанный с антисывороткой, в результате чего вокруг лунок образуются кольца преципитации. Диаметр этих колец прямо пропорционален концентрации антигена. На этом основании РИД используют для определения содержания растворимых антигенов (иммуноглобулинов всех классов, токсинов, ферментов, антигенных гормонов). Но еще в 1948 г. Оухтерлони разработал метод двойной и м-мунодиффузии в агаровый гель. Для этого в пластинке агара вырезалось несколько лунок — центральная и периферические. В центральную лунку помещали антисыворотку, в периферические — растворы различных антигенов или раствор одного антигена в разных разведениях. Диффундирующие реагенты взаимодействуют, образуя линии преципитации в промежутке геля между центральной и периферическими лунками. Таким образом устанавливают количество антигенов в препарате, примерную их концентрацию и степень родства. В последнем случае обращают внимание на совпадение локализации и конфигурации линий преципитации сравниваемых антигенов (реакция идентичности), пересечение этих линий (реакция неидентичности) и наличие шпор у скрещивающихся линий преципитации. Реакция идентичности свидетельствует о тождественности сравниваемых антигенов, неидентичности— об их различиях, а наличие шпор — о содержании в сравниваемых разных препаратах общих антигенных детерминант. Данная реакция является самым распространенным методом тестирования антигенных свойств растворимых препаратов в экспериментальной работе и широко внедряется в практику диагностических лабораторий из-за своей простоты и высокой чувствительности. В 1953 г. Оакли и Фултроп предложили более четко воспроизводимый вариант метода Оудина. Он заключается в том, что в стандартные пробирки оба реагента помещают в смеси с агаром и встреча их происходит в пограничном слое геля такой же концентрации. По чувствительности он превосходит метод Оухтерлони. В 1953 г. Грабар и Вильяме предложили комбинированный метод анализа растворимых антигенов, включающий в себя электрофорез антигена (центральная лунка) в агаровом геле с последующим взаимодействием его с антисывороткой (в боковых канавках) по типу реакции Оухтерлони. Этот метод называется иммуноэлектрофорезсм (ИЭФ) и позволяет более четко разделят^, антигены в испытуемом препарате, то есть более полно характеризовать набор антигенов в препарате. Однако для постановки ИЭФ требуется довольно высокая концентрация реагентов, особенно антигенов (табл. 5). ИЭФ можно ставить с меченными радиоактивными веществами реагентами, тогда получится радиоиммуноэлектрофорез. С помощью фотоэмульсии он позволяет выявлять самые незначительные количества иммунных глобулинов. 5. Минимальное количество препаратов растворимых антигенов Е. coli 078: К-80, необходимое для образования видимого преципитата при взаимодействии с препаратом IgG крупного рогатого скота (мг/мл)
Растворимые антигены можно также анализировать специфическими реагентами и на довольно высоком уровне чувствительности путем нагружения ими неспецифических носителей — частиц латекса, эритроцитов барана как наиболее резистентных к перепадам осмотического давления. В таких случаях, правда, будет уже не реакция преципитации, а реакции непрямой агглютинации или торможения непрямой гемагглютинации. Для индикации и идентификации корпускулярных антигенов применяют серологические реакции, основанные на феномене агглютинации, а также иммунохимические методы, сочетающие принципы серологического и микроскопического анализов и представляющие, по существу, феномен микропреципитации меченых антител. К последним относят антитела, меченные ферментами (для светопольной микроскопии), флуорохромами (для люминесцентной микроскопии) и конт-растёрами (для электронной микроскопии). Антигенный анализ с помощью реакций агглютинации производится со взвесью микроорганизмов, содержащей тысячи и миллионы микробных тел, то есть на уровне популяции, а иммунохимический анализ с использованием меченых антител — на уровне отдельных клеток. Причем д^я применения агглютинационного теста обязательно выделение микроба в чистую культуру, иммунохимический анализ на уровне отдельной клегки может производиться и в смешанной культуре или взвеси микробов. Реакция агглютинации (РА) пробирочная или пластинчатая выявляет только поверхностные антигенные детерминанты K-.J3- и Н-антигенов микробной клетки. Поскольку К-антиген бактерий покрывает" детерминанты О-антигена, РА ставят с гретой и нативной взвесью идентифицируемой культуры. При этом культуру берут в стационарной фазе роста, когда все поверхностные антигены полностью экспрессированы. Для выявления Н-антигена культуру исследуют раньше. РА широко используют в ветеринарии для идентификации эшери-хий, сальмонелл и ряда других бактерий. Однако необходимость в выделении микробов в чистую культуру и накопления бактериальной массы снижают чувствительность данного теста и требуют много времени для его осуществления. К тому же при постановке РА не учитываются индивидуальные антигенные свойства бактерий исследуемой популяции, исключается возможность визуальной характеристики антигенов. Указанных недостатков лишен метод флуоресцирующих антител (МФА), основанный на микропреципитации меченных флуорохромами антител нг фиксированном антигене. Оседая на гомологичной частице, меченые антитела специфически взаимодействуют с отдельными клетками, будь то в чистой или смешанной культуре. Поскольку преципитирующие на частице антитела мечены, они избирательно высвечивают индицируемые объекты. Поэтому даже единичные клетки будут видны в поле зрения микроскопа подобно тому, как свер кают звезды на темном небосклоне. Отсюда более высокая чувствительность МФА по сравнению с РА и возможность использования иммунохимического анализа смешанных антигенов. Последнее делает возможным применение МФА для обнаружения антигенов непосредственно в патологическом материале, что не позволяет ни один серологический метод. -  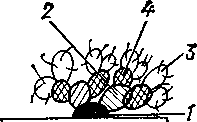 Рис. 52. Основные варианты метода флуоресцирующих антител (схема): а-—прямой одноступенчатый; б— непрямой двухступенчатый; в — непрямой трехступенчатый (ан-. тикочплементарный) /—антиген, 2 — немеченая сыворотка I ступени (б, в); 3 — меченая сыворотка против искомого антигена (а), антиглобулиновая II (б) и антикомплементарная III (в) ступеней; 4— комплемент сыворотки крови морской свинки. Из-за того, что отпадает необходимость выделять микроорганизмы в чистую культуру и сокращается время на постановку реакции примерно в 20 раз, метод флуоресцирующих антител считается экспрессным. Принципиально важным преимуществом МФА является также возможность дополнительно характеризовать морфологию исследуемых корпускул, что невозможно сделать при использовании серологических методов. Наконец, в отличие от РП и РА метод флуоресцирующих антител выявляет антигенные детерминанты, взаимодействующие с иммуноглобулинами не отдельных (IgM или IgG), а всех классов, причем с функцией как полных, так и неполных антител. В лабораторной практике наибольшее распространение получили три варианта МФА: прямой, непрямой двухступенчатый и непрямой трухступенчатый (рис.52). Прямой „вариант заключается в том, что на фиксированный на стекле антигел_наносят меченою _а^ггисыворотку и инкубируют при температуре тела животного^ 20—г 45_мщи МазокГотмывают от несвязавшихся антител, покрывают нефлуоресцирующей жидкостью (например, диметилфталатом) и просматривают под люминесцентным микроскопом. В положительном случае в поле зрения микроскопа видны ярко сверкающие клетки микроорганизмов. При этом микробы с развитым ригидным веществом по периферии светятся более ярко из-за суммации света от флуоресцирующих молекул, зафиксировавшихся по боковым участкам стенки клеток. Микроорганизмы с неразвитым ригидным слоем в стенке (например, вибрионы, лептоспиры, микоплазмы) обычно уплощаются при фиксации на стекле и поэтому светятся всей поверхностью равномерно. Прямой вариант достаточно чувствителен, специфичен, прост в исполнении и требует мало времени. Но экономически не выгоден, так как на каждый антиген нужно иметь меченую сыворотку. К тому же он пригоден лишь для обнаружения антигенов, то есть для прямой индикации. Непрямой двухступенчатый вариант сводится к тому, что на фиксированный антиген вначале наносят антисыворотку в немеченом виде (сывороткаТступени), а затем уже антивидовую меченую сыворотку (сыворотка II ступени). В положительном случае между антигеном и сывороткой I ступени образуется иммунный комплекс, для выявления которого мы наносим меченую сыворотку II ступени, содержащую антитела, к иммуноглобулинам сыворотки I ступени. Таким образом, иммуноглобулины сыворотки I ступени будут антителами для индицируемого антигена и одновременно антигенами для сыворотки II ступени. Сыворотка I ступени физически увеличивает размеры светящегося комплекса, поэтому данный вариант чувствительнее прямого и пригоден для обнаружения даже самых мелких микроорганизмов (например, вирусов). Так как сыворотка I ступени применяется в немеченом виде, непрямой вариант можно использовать не только для прямой, но и для обратной индикации, то есть для обнаружения антител. Кроме того, данный вариант экономичнее прямого, так как для его осуществления надо иметь столько меченых антивидовых сывороток, сколько имеется продуцентов сыворотки I ступени. Сыворотку I ступени обычно получают на кроликах, лошадях, волах, баранах, свиньях и курах. Следовательно," располагая набором из 5 — 7 антивидовых меченых сывороток, производственная лаборатория в состоянии выявлять все интересующие ее антигены и антитела. Непрямой трехступенчатый, или антикомплементарный, вариант заключается в последовательной обработке фиксированного на стекле антигена немеченой антисывороткой (сыворотка I ступени), немеченым комплементом (сыворотка II ступени) и, наконец, меченой антикомплементарной—антивидовой сывороткой (сыворотка III ступени). При наличии в препарате гомологичного сыворотке I ступени антигена между ними образуется иммунный комплекс, на который фиксируется комплемент (сыворотка II ступени). Для выявления последнего мы и наносим антикомплементарную сыворотку (III ступени) в меченом виде. В качестве источника комплемента (сыворотки II ступени) может служить сыворотка любого животного, но наиболее активен комплемент морской свинки. Поэтому обычно на II ступени применяют сыворотку крови морской свинки, а на III ступени — меченую кроличькмсьь— воротку 'против белков крови морской свинки. Таким образом, при наличии лишь одного меченого реагента можно выявлять любой антиген или любое антитело. В качестве флуорохромов для метки антител чаще используют флуо-ресцеинтиоизоционат (ФИТЦ), светящийся изумрудно-зеленым цветом. Но в арсенале пригодных для метки антител флуорохромов имеются красители, светящиеся желтым, оранжевым, синим и другими цветами. Если каждым из них пометить антисыворотки различной специфичности, в одном и том же препарате можно наблюдать одновременно совершенно разные антигены или антигенные детерминанты, что также выгодно отличает МФА от серологических методов антигенного анализа. В случае метки антител светорассеивающими ферментами (например, пероксидаза хрена) иммунные комплексы можно выявлять под обычным светопольным микроскопом, что расширяет возможности и делает более доступным иммунохимический анализ с применением меченых антител. Данный метод обладает многими достоинствами МФА. Однако и он не позволяет рассмотреть детали антигенного строения поверхности микробной клетки и тем более ее внутренних структур. Это удается сделать с помощью иммунохимического анализа, основанного на использовании антител, меченных контрастирующими, то есть рассеивающими электроны веществами на уровне электронной микроскопии. С этой целью антитела конъюгируют с железосодержащим белком печени лошадей или других животных ферритином, ртутьсодержащим соединением—диазофенилмеркуриацетатом или с йодом. Благодаря непроницаемости контрастирующих веществ можно определить количество и локализацию антигенных детерминант на клеточном и субклеточном уровне. Ситуационное задание У гражданки Петренко заболел подсвинок семимесячного возраста. При исследовании установлено повышение температуры тела до 40,50С, угнетенное состояние, вялость, отсутствие аппетита, запор. На коже спины и боков хорошо заметны красные пятна преимущественно прямоугольной формы, которые бледнеют при надавливании. Установите диагноз. Проведите лечение и порекомендуйте мероприятия по профилактике болезни в дальнейшем. РОЖА СВИНЕЙ Рожа свиней (Erysipelas suum) — инфекционная болезнь, характеризующаяся при остром течении септицемией и воспалительной эритемой кожи, а при хроническом — эндокардитом и артритами. Историческая справка. Возбудителя рожи свиней идентифицировали и описали Р. Кох (1878), Лёффлер (1881, 1885), Л. Пастер и Л. Тюилье (1882), вакцины из ослабленных штаммов возбудителя рожи получили Л, Пастер (1883), а противорожис-тую сыворотку — Лоренц и Лекланш (1885—1896). Позднее вакцинные штаммы изготовили Д. Ф. Конев и Виноградник (ВР-2), которые в настоящее время в СССР используются для изготовления противорожистых вакцин. Возбудитель — бактерия Erysipelothrix insidiosa — единственный представитель рода Erysipelothrix из семейства Lactobacillaceae. Возбудителя рожи относят к убиквитарным (повсеместно встречающимся) микроорганизмам. В зависимости от условий обитания Е. insidiosa имеют неодинаковые морфологические, вирулентные, антигенные и им-муногенные свойства. Микроб нетребователен к питательным средам. Хорошо растет в аэробных и анаэробных условиях на МПБ, среде Хоттингера при температуре 36 — 38 °С и рН среды 7,4 — 7,8 (добавление 0,5% глюкозы и 5 — 10% лошадиной сыворотки стимулирует рост). Бактерии неподвижны, не образуют спор и капсул, окрашиваются растворами основных анилиновых красок и по Граму (рис. IV) На твердых питательных средах образуют гладкие (S), шероховатые (R) и переходные (О) колонии. В мазках, приготовленных из свежих жидких культур, S-колоний и opiaHOB животных, павших при остром течении болезни, выявляются прямые или слегка изогнутые бактерии рожи размером 0,2 — 0,3 х 0,5 — 1,5 мкм, располагающиеся единично или попарно В мазках из старых бульонных культур, R-колоний и в отпечатках из пораженных органов при хроническом течении рожи, обнаруживают удлиненные до 6 — 8 мкм бактерии, расположенные в виде длинных цепочек (нитевидная форма). Возбудитель рожи имеет три антигенных типа — А, В и N. Болезнь вызывает преимущественно тип А, реже тип В и очень редко тип N (его часто выделяют от здоровых животных) Тип В обладает высокими иммуногенными свойствами и его используют для производства вакцин. Из лабораторных животных к бактериям рожи наиболее восприимчивы мыши и голуби. Устойчивость возбудителя рожи во внешней среде высокая; в почве и воде, в трупах и навозной жиже он сохраняется многие месяцы Соление и копчение свиных продуктов его не убивают. Бактерии рожи чувствительны к высокой температуре, некоторым антибиотикам и дезинфицирующим средствам, включая растворы едкого натра и формальдегида (2 %-ные), хлорной извести (10 %-ный), фенола (3 %-ный) и другие в общепринятых концентрациях. Эпизоотологические данные. Рожа — это наиболее распространенная во всем мире инфекционная болезнь свиней. Ее регистрируют почти повсеместно в виде спорадических случаев или эпизоо-шческих вспышек. Чаще заболевают свиньи в возрасте 3—12 мес. Устойчивость сосунов до 40 дней связана с пассивным иммунитетом, а у взрослых животных — с возрастной естественной резистентностью и латентным переболеванием. Помимо свиней, рожа спорадически встречается среди лошадей, крупного рогатого скота, овец, северных оленей, собак и многих диких млекопитающих и птиц зоопарков. Среди ягнят, индеек и уток, а также среди грызунов рожа может проявиться значительной эпизоотической вспышкой. Болеет рожей и человек. Среди многих видов домашних и диких животных, в особенности среди свиней, грызунов и птиц, широко распространено микробоно-сительство. Возбудителя рожи нередко можно выделить из организма морских и речных рыб, насекомых и членистоногих. Высокая устойчивость возбудителя во внешней среде и перманентная его циркуляция в природе обеспечивают широкий и постоянный резервуар возбудителя рожи и энзоотичность болезни. Это позволило отнести рожу к при-родно-очаговым болезням. Источником возбудителя рожи являются явно больные свиньи, выделяющие микробы с мочой и калом, и клинически здоровые свиньи — бактерионосители. При латентной форме бактерии рожи, обычно локализующиеся в миндалинах и кишечных фолликулах, могут при стрессе, особенно под влиянием высокой температуры и при белковой недостаточности, вызвать клиническое проявление болезни. В результате этого эпизоотические вспышки рожи в хозяйствах чаще возникают эндогенно, без заноса возбудителя извне. Факторами передачи возбудителя рожи служат инфицированные предметы ухода, корм и вода, продукты убоя животных, трупы, почва и т. д. Переносят возбудителя чаще грызуны, мухи-жигалки и птицы. Основной путь распространения возбудителя — кормовой, реже — трансмиссивный и контактный. Особо важное значение в распространении рожи имеет почва. Рожа, являясь почвенной инфекцией, имеет выраженную весенне-летнюю сезонность и чаще возникает среди ремонтного и откормочного молодняка. Высокая температура в сочетании с повышенной влажностью, содержание свиней в душных, плохо вентилируемых помещениях, солнечный стресс, транспортировка, недостаток в рационе протеина, минеральных веществ и витаминов снижают устойчивость к роже и одновременно способствуют возникновению, широкому распространению, тяжести клинического проявления и интенсивности эпизоотического процесса. Эпизоотологической особенностью рожи является ее стационарность, проявляющаяся повторными вспышками преимущественно в теплое время года. Длительность эпизоотической вспышки, заболеваемость и летальность зависят от технологии разведения свиней, своевременной и точной диагностики болезни, вирулентности и типовой принадлежности возбудителя, иммунологической структуры стада и тщательного проведения оздоровительных мероприятий. Эпизоотические вспышки, как правило, не имеют тенденции к широкому распространению : заболеваемость обычно не превышает 20 — 30 /„ летальность — 55 —80 %. Патогенез. Попавшие в организм бактерии рожи вначале размножаются в местах первичной локализации (миндалины, солитарные фолликулы, места повреждения кожи), вызывая нарастающую сенсибилизацию организма (аллергию). Если возбудитель рожи попадает в организм с высокой естественной резистентностью, то первичный процесс может ограничиться местной инфекцией, протекающей бессимптомно или со слабовыраженными клиническими признаками, заканчиваясь образованием иммунитета. При неблагоприятных условиях внешней среды и стрессе бактерии рожи преодолевают местные защитные барьеры, проникают в кровь и паренхиматозные органы, вызывая септицемию. Интенсивное размножение бактерий и накопление токсических продуктов приводит к воспалительным явлениям и глубоким дистрофическим изменениям в органах и тканях. Генерализованная инфекция сопровождается развитием тромбов, отеков, застойных явлений во внутренних органах и коже, нарушением тканевого обмена. При остром течении болезни ярко выражены тяжелые клинические признаки септицемии (гипертермия, сердечная недостаточность, отек легких), заканчивающейся летальным исходом. У животных с остаточным иммунитетом, а также при внедрении слабовирулентного возбудителя инфекционный процесс носит более доброкачественное течение. Болезнь в таких случаях протекает подостро и хронически и проявляется преимущественно гиперемией и местным воспалением кожи в виде ромбовидных рожистых пятен, веррукозным эндокардитом и артритами. Заметно проявляются защитно-иммунологические реакции в местах преимущественной локализации бактерий. Исход болезни зависит от глубины поражения органов и тканей и степени функциональных нарушений. Течение и симптомы. Инкубационный период 2 — 5 дней, но может быть и более продолжительным. В зависимости от количества и вирулентности возбудителя, ворот инфекции, восприимчивости животных и факторов внешней среды рожа может протекать молниеносно, остро, по достро и хронически. Различают также септическую, кожную (крапивница) и латентную формы. Молниеносное течение регистрируют сравнительно редко, преимущественно у откармливаемых подсвинков в возрасте 7—10 мес, содержащихся в плохих зоогигиенических условиях или во время транспортировки. Рожа проявляется резким угнетением, гипертермией и быстро прогрессирующей сердечной слабостью без появления на коже красных пятен (белая форма рожи). Болезнь в течение нескольких часов заканчивается летальным исходом. Острое течение наиболее типично для септической формы рожи, его часто регистрируют в начале эпизоотической вспышки. Болезнь начинается угнетением общего состояния и внезапным повышением температуры тела до 42 °С и выше. Заболевшие животные обосабливаются из общей группы и больше лежат; перемещаются неохотно, отмечается напряженная, болезненная, ходульная походка. Животные отказываются от корма, у них появляются запоры, озноб и сердечная недостаточность. Иногда наблюдают рвоту, а у поросят-отъемышей и диарею. Ослабление сердечной деятельности приводит к отеку легких, затрудненному дыханию и цианозу кожи в подчелюстной области, а также шеи и брюшной стенки. Эритематозные пятна бледно-розового, а в последующем темно-красного цвета различной величины и формы появляются на 1 — 2-й день после начала заболевания лишь у отдельных животных. Заболевание продолжается 2—4 дня и без лечебной помощи часто заканчивается гибелью животного. Подострое течение рожи проявляется сравнительно легче в кожной форме (крапивница), для которой свойственны повышение температуры до 41 °С и выше, слабость, снижение аппетита и жажда. Для крапивницы характерным признаком служат образование через 1—2 дня на коже головы' и туловища, реже на других участках тела, плотных воспаленных припухлостей квадратной, ромбической и реже округлой формы (рис. 27). Количество и размеры эрите-матозных пятен сильно варьируют между собой, захватывая обширные участки кожи. В большинстве случаев крапивница протекает доброкачественно, и при выздоровлении животного пятна постепенно бледнеют и исчезают. На их месте в легких случаях эпителий кожи десквамируется, а при тяжелых — наступает омертвление кожи и ее отторжение с заполнением дефектов рубцовой тканью. Болезнь длится 7—12 дней и в большинстве случаев, особенно при своевременном лечении, заканчивается выздоровлением. Лишь иногда она обостряется и переходит в обычную септицемическую форму. Хроническое течение рожи в редких случаях представляет самостоятельное проявление болезни. Большей частью это лишь продолжение септической формы или крапивницы с осложнениями, проявляющимися разлитым (рожистым) некрозом кожи, веррукозным эндокардитом и хроническим поражением других органов. При сильном некрозе большие участки кожи превращаются в сплошное темно-красное возвышение с черноватым оттенком в форме плотной и сухой, похожей на панцирь, некротической корки. Рожистый процесс длится месяцами, пока некротическая ткань не отторгнется путем нагноения Животные плохо откармливаются, что вызывает необходимость их убоя. Веррукозный эндокардит проявляется нарушением сердечной деятельности, прогрессирующей слабостью, одышкой, застойными явлениями, анемией и исхуданием. Исход болезни зависит от тяжести поражения сердечных клапанов. Полиартриты рожистого происхождения вначале проявляются горячей припухлостью и болезненностью чаще скакательных и бедренных, реже карпальных и путовых суставов; животные передвигаются с трудом; позже признаки острого воспаления исчезают и возникает деформация суставов, что вызывает хромоту и ограничивает движение животных. Патологоанатомические изменения при роже свиней разнообразны, что определяется течением и формой болезни. У свиней, павших при остром течении болезни, находят изменения, свойственные септическому процессу. Кожные покровы неистощенного трупа в области подгрудка и промежности цианотичны, на спине и боках при крапивнице находят различной величины темно-красные участки. Серозные покровы внутренних полостей и органов покрыты нитями фибрина и нередко усеяны мелкими кровоизлияниями. Лимфоузлы увеличены, резко ги-перемированы с четко выступающими фолликулами. Селезенка увеличена, печень кровенаполнена и паренхиматозно перерождена, почки набухшие, темно-вишневой окраски, с мелкими кровоизлияниями в корковом слое (геморрагический гломерулонефрит), в легких — нередко выраженный отек и иногда очаги бронхопневмонии Сердечная мышца бледновата и размягчена. Слизистая оболочка дна желудка и тонких кишок, как правило, отечна и гиперемирована, с множеством точечных и полосчатых кровоизлияний. При хроническом течении рожи находят изменения, свойственные веррукозному эндокардиту (бородавчатые разращения на клапанах), а при воспалении суставов — фиброзные разращения синовиальных оболочек. Диагноз. Прижизненный клинический диагноз при остром течении рожи и крапивнице основываегся преимущественно на характерных поражениях кожи, которые проявляются на фоне общих нарушений Необходимо учитывать эпизоотологические данные и высокую лечебную эффективность противорожистой сыворотки и антибиотиков. Для посмертного диагноза наиболее характерны: увеличение селезенки, острый катаральный гастроэнтерит, геморрагический лимфоденит и гломерулонефрит. Точный диагноз ставят по результатам бактериологического исследования, для чего в лабораторию пересылают кусочки селезенки, печени, почки и трубчатую кость. В лаборатории проводят микроскопию мазков, окрашенных по Граму, и выделяют возбудителя путем посевов на питательные среды. В необходимых случаях эмульсией из паренхиматозных органов заражают белых мышей или голубей. Для диагностики рожи также рекомендована реакция иммунофлуоресценции. Дифференциальный диагноз. Острую септическую форму рожи и крапивницу необходимо дифференцировать от чумы, пастереллеза, сальмонеллеза, листериоза, сибирской язвы, солнечного и теплового ударов. При хроническом течении необходимо исключить хроническое течение чумы, микоплазмозный полисерозит, полиартрит, стрептококковую и коринебактериальную инфекции, рахит и остеомаляцию. Лечение. Эффективными лечебными препаратами являются про-тиворожистая сыворотка и антибиотики. Сыворотку вводят подкожно или внутримышечно в дозе 1 — 1,5 мл на 1 кг живой массы животного. При тяжелом состоянии животного лучший лечебный эффект достигается, если половину дозы сыворотки вводят в ушную вену. При роже эффективны также многие антибиотики — пенициллин, стрептомицин, окситетрациклин, экмоновоцилин, эритромицин и др. Предпочтительнее применять пенициллин в дозе 2 — 3 тыс. ЕД на 1 кг живой массы животного с промежутками в 6 — 8 ч. Лучшие результаты получают при совместном применении сыворотки с антибиотиками. Если после 8—12 ч лечения состояние больных не улучшается, сыворотку и антибиотики вводят повторно. Специфическую терапию необходимо сочетать с симптоматическим лечением. Иммунитет. Переболевшие рожей свиньи приобретают напряженный и длительный иммунитет, сопряженно связанный со специфическим фагоцитозом и сывороточными антителами. Для иммунизации свиней против рожд в СССР в основном применяют живые вакцины (вакцину из румынского штамма ВР-2 и депонированную вакцину из штамма Д. Ф. Конева), а также концентрированную гидроокисьалю-миниевую формолвакцину. Прививают свиней старше 2-месячного возраста (поросят обычно спустя 2 недели после отъема). Вакцину из штамма ВР-2 применяют однократно, а депонированную и инакти-вированную вакцины — двукратно с интервалом 12—14 дней. Животных ревакцинируют через 4—5 мес. Профилактика и меры борьбы. Эффективная борьба с этой болезнью возможна лишь путем проведения плановых повсеместных, общих и специфических профилактических мероприятий. Общая профилактика заключается в строгом соблюдении ветеринарно-санитарных правил и технологических требований по размещению, уходу и кормлению свиней с целью получения и выращивания устойчивого молодняка. Особое внимание обращают на сбалансированность рационов по протеину, микроэлементам и витаминам, а также на профилактику теплового стресса. Систематически проводят уборку навоза, очистку помещений и территорию свинофермы, плановую дезинфекцию и борьбу с грызунами и мухами. Важнейшим методом специфической профилактики являются предохранительные прививки вакцинами. Вакцинацию следует проводить планово и систематически со 100 %-ным охватом всего подлежащего прививкам свинопоголовья общественных и индивидуальных хозяйств. Если в хозяйствах проводят предохранительные прививки против других инфекционных болезней (чумы, болезни Ауески, сальмонеллеза). | ||||||||||
