Разложение .. Содержание Введение 6 История развития процесса 1 Теоретические основы процесса 9 2 Сырье и продукты процесса 11 3 Химизм и механизм процесса 15 4 Основные факторы,
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
0,9 млн. тонн ацетона, т.е. возрастёт примерно на 20%. Подавляющая часть фенола и ацетона производится с использованием кумольной технологии - 97%. С учётом того, что значительная часть производимого фенола и ацетона расходуется на производство карбонатных пластиков, где на 2 моль потребляемого фенола требуется только 1 моль ацетона.Не менее важные проблемы - снижение капитальных затрат при строительстве новых фенольных производств, снижение себестоимости производства рассматриваемых продуктов и, разумеется, вопросы экологии. Соответственно разработчики фенольных технологий уже на протяжении многих лет ищут альтернативные пути, которые могли бы разрешить проблему дисбаланса и все указанные выше проблемы. Из этих путей можно выделить следующие: - прямое окисление бензола в фенол; - окисление бензола с помощью N2O в фенол; - совместное получение фенола и метилэтилкетона (МЭК); - увеличение селективности доминирующего на рынке кумольного процесса с целью увеличения выхода фенола и ацетона и др. Фенол принадлежит к числу наиболее крупнотоннажных продуктов нефтехимической промышленности. Применение фенола как промежуточного продукта органического синтеза очень разнообразно, особенно большие количества фенола расходуются на производство фенолоальдегидных полимеров, синтетических волокон, капрона и нейлона, эпоксидных полимеров и поликарбонатов, а также используют в производстве красителей, лекарственных и взрывчатых веществ, алкилированием фенола получают антиокислительные присадки и промежуточные продукты для синтеза неионогенных поверхностно- активных веществ. В данной выпускной квалификационной работе рассмотрен процесс разложения ГП ИПБ на фенол и ацетон; спроектирован реакторный узел установки разложения ГП ИПБ и рассмотрена актуальная технологическая схема установки. 1. История развития процесса 1.1 Теоретические основы процесса Гетеролитический распад гидроперекисей, или так называемого реакция кислотного распад, в отличие от гомолитического распада, до недавнего времени не привлекала внимания исследователей. К изучению этой весьма интересной реакции послужило открытие и широкое распространение нового способа совместного получения фенола и ацетона через гидроперекись изопропилбензола [1]. Впервые изучая в 1943 г. свойства полученной ими гидроперекиси изопропилбензола, П. Г. Сергеев Р. Ю. Удрис и Б. Д. Кружалов, обнаружили, что данная гидроперекись в присутствии незначительных количеств серной кислоты практически количественно и с большой скоростью распадается на фенол и ацетон, выделяя при этом значительное количество тепла. В 1943—1946 гг. П. Г. Сергеев с сотрудниками детально изучил описанную реакцию, и несколько позднее этот процесс был реализован в промышленном масштабе. Спустя 20 лет, в 1950 году, когда в СССР процесс получения фенола и ацетона через гидроперекись изопропилбензола уже был осуществлен в промышленности [2]. Реакция разложения ГП ИПБ чрезвычайно экзотермична и протекает с заметной скоростью даже при –80 оС и для того чтобы свести к минимуму нежелательные побочные процессы, разложение проводилось в среде уксусной кислоты (в которой гидроперекись стабильна при комнатной температуре) в присутствии 0,1 мол. % хлорной кислоты. В этих условиях гидроперекись изопропилбензола количественно разлагалась на фенол и ацетон. Для объяснения этой реакции Караш предложил цепной механизм: + A С6Н5(СН3)2СООН → [С6Н5(СН3)2СО]+ + (АОН)— (а) [С6Н6(СН3)2СО]+ → [СвН6-О-(СН3)2С]+ (б) С6Н5(СН3)2СООН + [С6Н5–О– (СН3)2С]+ → → [С6Н6(СН3)2СО]+ + С6Н5ОН + (СН3)2СО (в) В описанной схеме— сильная кислота по теории Льюиса в результате бимолекулярной реакции гидроперекиси с кислотой образуется осколок молекулы, несущий положительный заряд на кислородном атоме «а», который перегруппировывается затем в катион, несущий положительный заряд на углеродном атоме (ион карбония) «б», далее этот ион, взаимодействуя с молекулой гидроперекиси, превращается в фенол и ацетон, регенерируя кислородный катион, который в свою очередь перегруппировывается в ион карбония «в» и т. д. Тот факт, что только сильные кислоты могут быть причиной гетеролитического распада гидроперекиси изопропилбензола, авторы доказывают следующим образом. Хлористый водород, растворенный в уксусной кислоте, не является сильной кислотой и в этом случае не пригоден для разложения гидроперекиси, тогда как в других условиях следы хлористого водорода вызывают бурный ее распад на фенол и ацетон. С другой стороны, хлорное железо, которое в спиртовом растворе представляет собой слабую кислоту, в данных условиях не разлагает гидроперекись. В то же время раствор хлорного железа в бензоле является сильной кислотой и быстро превращает гидроперекись изопропилбензола в фенол и ацетон. Аналогичные результаты были получены с другими растворителями (диоксан, бензол) и кислотами (растворы фтористого бора, хлористого алюминия, серная кислота). Это указывает на отсутствие специфического влияния растворителя или аниона [3]. Караш с сотрудниками наблюдали также, что присутствие в гидроперекиси диметилфенилкарбинола вызывает в условиях кислотного разложения образование димера α-метилстирола наряду с заметно уменьшающимися количествами фенола и ацетона. Если в реакцию вступали относительно большие количества этого карбинола (2 – 3 мольна 1 мольгидроперекиси), образование фенола и ацетона полностью прекращалось; основными продуктами при этом были димер а-метилстирола и перекись водорода. Караш на основании описанного эксперимента сделал вывод о том, что разложение гидроперекиси изопропилбензола может по существу измениться в присутствии вещества, способного конкурировать с гидроперекисью по отношению к кислоте «а». В данном случае, очевидно, диметилфенилкарбинол является более сильным основанием, чем гидроперекись изопропилбензола; следовательно, реакция (а) не может протекать [3]. Хоку с сотрудниками сравнительно недавно удалось синтезировать бензоильное производное гидроперекиси изопропилбензола, которое безуспешно пытались получить Виланд и Мейер для гидроперекиси трифенилметана. Детально изучив механизм превращений гидроперекиси изопропилбензола, Хок предложил схему распада, в основе которой лежит перегруппировка иона оксония в ион карбония. При рассмотрении реакции кислотного разложения гидроперекиси изопропилбензола с точки зрения, механизма, предложенного Карашем, становится очевидной аналогия с бекмановской перегруппировкой: Несмотря на то, что схема, предложенная Карашем, наиболее полно объясняет процесс кислотного разложения гидроперекисей, следует отметить, что точный механизм первичного гетеролитического распада гидроперекисей в деталях не известен и трудно сказать что-либо определенное относительно продолжительности существования предполагаемого кислородного катиона и того, является ли он в действительности «свободным». Таким образом, можно сделать вывод о том, что процесс кислотного разложения гидроперекиси изопропилбензола является оптимальным процессом получения ацетона и фенола. 1.2 Сырье и продукты процесса Характеристика сырья. Гидроперекись изопропилбензола представляет собой бесцветную маслянистую жидкость, немного вязкую, с характерным запахом, напоминающим запах озона. При попадании на кожу вызывают ожоги. Молекулярный вес -152,1 Вязкость, Н. с /м2 -0,176 При 200 С -0,105 При 300 С -0,068 Показатель преломления - п20 +1, 5245 Плотность по воде d 148 -1,0639 При перегонке под атмосферным давлением ГП ИПБ бурно разлагается. Температура начала разложения чистой гидроперекиси-145ос, технической- 120..125оС. При очень низких температурах ГП застывает в стекло. Растворимость в воде при 19оС-15г/л [4]. Гидроперекись хорошо растворима в обычных органических растворителях (спирты, эфире, бензоле, ацетоне и др.) Растворяется в едких щелочах и дает кристаллогидрат, состава C6H5-C-(CH3)2-O-ONa. 6H2O с температурой плавления 45оС . Характеристика получаемых продуктов Фенол – в чистом виде представляет собой бесцветную кристаллическую массу. На свету при длительном хранении часто принимает розовато-красную окраску. Обладает специфическим запахом. При попадании на кожу вызывает по беление побеленных мест и ожоги. Вязкость, Н сек/м2 : - при 20оС-11610-4 ; при 50оС-342.10-5 ; при 120оС-76.10-5; критические константы: давление атм. - 60,5; температура; 0С - 419,2; показатель преломления п 40,6Д - 1,5425 ; плотность d 254 -1,077; удельная теплоемкость, Дж/кг.град - 2349 [4]. Технический синтетический фенол предназначен для применения в производстве капролактама, дифенилолпропана, медицинских препаратов, фенолоформальдегидных смол 3 - ортокрезола, присадок к маслам, для селективной очистки масел и других целей. Фенол ядовит. Пыль и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Обладает слабокислотными свойствами, при действии щелочей образует соли - феноляты. При действии брома образуется трибромфенол, который используют для получения антисептика - ксероформа. Бензольное ядро и ОН -группа, объединённые в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Особое значение имеют реакции конденсации фенолов с альдегидами и кетонами в результате которых получаются полимерные продукты. Ацетон - подвижная, бесцветная, летучая жидкость с характерным запахом. Смешивается с водой в любых соотношениях. Он весьма огнеопасен и даёт воздухом взрывоопасные смеси. Вязкость, н.сек/м2 : при 100С-361,10-6 ; при 300С – 296,10-6 ; при 600С - 228.10-6; критические константы: давление, ат. - 46,6; температура, оС-235,5; молекулярная масса -58,08; показатель преломления n20D-1,3571; плотность, d204-0,792; пределы взрываемости, % : нижний -2,15 и верхний – 13; температура, оС : вспышки - 20; кипения-56,5; плавления- 94,6; самовоспламенения-500; теплоемкость: молекулярная, Дж/ кмоль.град-749; удельная, Дж/кг.град-2211; теплота, кДж/моль: испарения –32,3 и сгорания -1787. Ацетон в настоящее время применяется как растворитель в производстве автомобильных, авиационных, кабельных кожевенных и других лаков и эмалей, кинопленок, фотореагентов, целлулоида, ацетонного шелка, а также применяется в качестве промежуточного продукта органического синтеза. Из него получают дифенилпропан (для производства эпоксидных полимеров карбонатов), диацетоновый спирт, изобутилметилкетон, метилметакрилат, винилметилкетон и другие ценные вещества. Характеристика побочных продуктов - диметилфенилкарбинол - представляет собой тонкие бесцветные иглы, обладает слабым ароматическим запахом. Молекулярная масса -136 Плотность d204 - 0,998 Теплота, кДж/моль: сгорания-5043,103 , образования-231. - α – Метилстилстирол в чистом виде представляет собой подвижную, бесцветную, сильно преломляющую жидкость со своеобразным запахом. При сильном охлаждении застывает в бесцветную кристаллическую массу, плавящуюся при 23,2оС. Температура кипения α – МС при 760 мм. рт. ст. составляет 165,4оС; плотность d17,44-0,9134; показатель преломления n17.44-1,5384. α-Метилстирола (α-мс) также широко используется в производстве низкотемпературного каучука марки СК СМ –30А и каучуков специального назначения ( морозостойкого каучука марки СКСМ –10 и каучука с высоким содержанием α-метилстирола (α-мс) марки СКСМ –50), а также использовании α-метилстирола (α-мс) является получение высокополимеров, подобных полимерам стирола, применяемым в радио- и электротехнической промышленности [5,6]. - ацетофенон или метилфенилкетон простейший жирноароматический кетон, в обычных условиях представляющий собой бесцветную маслянистую жидкость, застывающую в легкоплавкие кристаллы, также обладает сильным своеобразным запахом цветов черемухи. Растворимость ацетофенона в виде незначительна: 0,55%вес. при 20оС составляет 1,65вес%. Температура плавления ацетона, равная 19,7оС, сильно зависит от содержания в нем влаги. Молекулярный вес- 120,15; показатель преломления n20D - 1,534; плотность d204 - 1,0238; температура кипения, оС – 202. Значительно большое количество ацетофенона применяется в фармацевтической промышленности, в парфюмерной промышленности, а также служит сырьем для производства одного из противоподагрических препаратов -атофана. Весьма перспективным направлением применения ацетофенона в химической промышленности является переработка его в стирол, может служить сырьем для получения бензойной кислоты непосредственным окислением кислородом в присутствии металлических катализаторов при повышенных температурах ( 150 0С) или путем обработки гипохлоритом натрия или кальция. 2,3 - Дифенил-2,3-диметилбутан бесцветные, с перламутровым блеском тонкие легкие листочки, обладающие слабым запахом, напоминающим запах пригоревшей канифоли. Температура плавления -119 до 120оС; молекулярная масса – 239. Углеводород нерастворим в воде, концентрированной серной кислоте, легко растворим в эфире. Чрезвычайно прочен по отношению к окислителям. - кумилфенол или диметилбензилфенол - представляет собой бесцветные игольчатые кристаллы с температурой плавления 73оС, практически нерастворим в воде, легко растворяется в эфире, этиловом спирте и бензоле. В чистом виде кумилфенол перегоняется при высокой температуре почти без разложения. Его также называют сложным фенолом легко конденсируется с формальдегидом, образуя малорастворимые смолы, идущие для лаковых покрытий металлических и других изделий. Кумилфенол может полостью заменить п- третичный бутилфенол, являющийся полупродуктом для изготовления указанных маслорастворимых смол. 1.3 Химизм и механизм процесса Химизм процесса. Основная реакция - разложение ГП ИПБ на фенол и ацетон под действием катализаторов кислотного типа (серной кислоты): СН3 I C  6H5 – С - ООН + H2SO4 C6H5OH+ СН3- С -СН3 6H5 – С - ООН + H2SO4 C6H5OH+ СН3- С -СН31 11 СН3 O Побочные реакции : 1) Конденсация фенола с ДМФК. При этом образуются кумилофенол, или (диметилфенилбензол) диметилбензилфенол. СН3 СН3 1 1 С  6Н5ОН + C6H5 – С - ОН C6H5 – С - С6Н5ОН + Н2О 6Н5ОН + C6H5 – С - ОН C6H5 – С - С6Н5ОН + Н2О1 1 СН3 СН3 В среде серной кислоты взаимодействие фенола с ДМФК протекает с очень большой скоростью. Однако при разбавлении фенола эквимолекулярным количеством фенола и ацетона реакция протекает значительно медленнее. Выход ДМФК при этом снижается с 97…98% до 12%. Остальной ДМФК превращается главным образом в мономер α-Метилстирол и частично остается неизменным. В отсутствие серной кислоты ДМФК с фенолом реагируют медленно [6,7]. ДМФК и фенол могут реагировать по другой схеме: С  6Н5ОН + С6Н5 – С(СН3)2-ОН С6Н5- О – С(СН3)2- С6Н5 + Н2О 6Н5ОН + С6Н5 – С(СН3)2-ОН С6Н5- О – С(СН3)2- С6Н5 + Н2О При этом получают фениловый эфир ДМФК. В кислой среде преобладает реакция, идущая с образованием кумилфенола, в нейтральной - реакция образования эфира. 2) Термическое разложение ГП ИПБ при температуре 145..155оС. При этом с основными продуктами являются ДМФК и ацеофенон (суммарный выход составляет 90..92% от теории): С 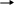 6Н5 – С(СН3)2-О- ОН С6Н5 – С(СН3)2-ОН + ½ О2 6Н5 – С(СН3)2-О- ОН С6Н5 – С(СН3)2-ОН + ½ О2С 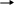 6Н5 – С(СН3)2-О- ОН С6Н5 – СО -СН3 + СН3-ОН 6Н5 – С(СН3)2-О- ОН С6Н5 – СО -СН3 + СН3-ОНпричем большая часть метанола окисляется в формальдегид, муравьиную кислоту и т. д. Образуются также небольшие количества фенола, ацетона и бензойной кислоты. 3) Дегидратация ДМФК с образованием α-метилстирола (α-мс) СН3 1 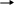 C6H5- С - ОН + Н+ C6H5 - С = СН2 + Н2О C6H5- С - ОН + Н+ C6H5 - С = СН2 + Н2О1 1 СН3 СН3 Такое отщепление воды происходит при перегонке под атмосферным давлением. Даже при перегонке под вакуумом, если температура повышается до 150оС, образуется заметное количество α-метилстирола (α- мс) и воды. 4) Образование димера α- МС СН2 СН2 СН3 11 11 1  C6H5- С + С - C6H5 СН3 - С - СН = С – СН3 C6H5- С + С - C6H5 СН3 - С - СН = С – СН31 1 1 1 СН3 СН3 С6Н5 С6Н5 5) Присоединение α- МС к фенолу. При этом образуется кумилфенол. СН3 1 C  6H5 - С = СН2 + С6Н5ОН C6H5 - С - С6Н4ОН 6H5 - С = СН2 + С6Н5ОН C6H5 - С - С6Н4ОН 1 1 СН3 СН2 В присутствии серной кислоты α- МС реагирует с фенолом значительно медленнее, чем ДМФК. В отсутствии серной кислоты реакция протекает медленно (даже при повышенной температуре). Образование окиси мезитила. В присутствии серной кислоты ацетон, образующийся в результате разложения ГП ИПБ, превращается в окись мезитила. 2  СН3 - С – СН3 (СН3)2 -С = СН – С –СН3 + Н2О СН3 - С – СН3 (СН3)2 -С = СН – С –СН3 + Н2О11 11 О О При разложении концентрированной ГП ИПБ в присутствии H2SO4 окись мезитила почти не образуется. 7) Конденсация фенола с ацетоном. В присутствии сильной кислоты две молекулы фенола могут конденсироваться с одной молекулой ацетона по реакции Дианина, давая дифенилпропан: при разложении ГП серной кислоты в оптимальных условиях дифенилпропан образуется в незначительной степени. Механизм процесса . Процесс идет по ионному механизму через следующие стадии: Отщепление протона 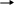 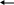 H2SO4 Н++HSO4- H2SO4 Н++HSO4-2) Образование оксониевого иона и его дегидратации за счет протонирования атома кислорода, содержащего неподеленную электронную пару с последующим отщеплением воды СН3 СН3 1 1 + C     6H5 – СО - ОН + H+ C6H5 - С - O - ОН 6H5 – СО - ОН + H+ C6H5 - С - O - ОН1 . . 1 .. СН3 СН3 Н СН3  1 1  C6H5 – С - О+ + Н2О C6H5 – С - О+ + Н2О 1 СН3 Перегруппировка образовавшегося иона с миграцией фенильной группы к кислородному атому: СН3 СН3 1 1    C6H5 – С - О+ C6H5 О – С + C6H5 – С - О+ C6H5 О – С +  1 1 1 1СН3 СН3 СН3 СН3    1 1 1 1  C6H5 –О - С - О+ + Н2О C6H5 – О-С - ОН2+ C6H5 –О - С - О+ + Н2О C6H5 – О-С - ОН2+ 1 1 СН3 СН3 СН3   1 1  C6H5- О– С - ОН + Н+ C6H5- О– С - ОН + Н+ 1 СН3 полукеталь В присутствии кислоты и воды протекает гидролиз полукетали с образованием фенола и ацетона СН3 1 C6H5 – С - ОН Н+, Н2О С6Н5ОН + СН3 - С – СН3 1 11 СН3 О При кислотном разложении технической ГП ИПБ образуется смесь, состоящая из фенола и ацетона, значительно меньших количеств диметилфенилкарбинола (ДМФК), ацетофенона, а также небольших количеств серной кислоты. Естественно, что такие реакционноспособные вещества в кислой среде при температуре 50…60оС способны взаимно действовать друг с другом [6,7]. |
