Разложение .. Содержание Введение 6 История развития процесса 1 Теоретические основы процесса 9 2 Сырье и продукты процесса 11 3 Химизм и механизм процесса 15 4 Основные факторы,
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
1.4 Основные факторы, влияющие на процесс Влияние температуры. Реакция разложения ГП ИПБ на фенол и ацетон является необратимой, поэтому температура влияет только на скорость реакции. С повышением температуры растет скорость реакции, увеличивается концентрация фенола и ацетона, проходит через максимум, а затем происходит распад с образованием больших количеств побочных продуктов. При повышении температуры с 50 до 80оС выход ацетона снижается с 98…99% до 89%, а фенола с 98 до 80…82% от теоретического. При более низких температурах (например,30оС) резко возрастает продолжительность реакции, и остается неразложившийся ГП ИПБ. Оптимальная температура 50- 60оС при времени контакта 3,5 мин. [3]. Влияние времени контактирования. При малом времени контактирования происходит проскок распада ГП ИПБ. Выход фенола и ацетона сначала проходит через максимум 2…3,5 мин, а затем уменьшается за счет образования смол. Оптимальное время контактирования 2,5 – 3 мин. Влияние концентрации ГП ИПБ в исходной смеси. С увеличением концентрации ГПИПБ в исходной смеси с 10% до 25% снижается степень превращения ГПИПБ со 100 до 95,5 % мас. При этом в исходной смеси создаются условия для протекания реакций смолообразования, поэтому выход фенола и выход α -метистирола падает. Оптимальной концентрацией ГП ИПБ в исходной смеси, обеспечивающей высокий выход фенола, является концентрация 10…15% масс. Влияние концентрации серной кислоты. В промышленных условиях применяют 98%-ную серную кислоту в виде раствора в ацетоне. Максимальный выход целевых продуктов достигается при концентрации 0,07…0,1% серной кислоты от массы ГП ИПБ. После максимума выход фенола снижается за счет реакции конденсации и полимеризации α -метистирола и других веществ. При высокой концентрации серной кислоты происходит неконтролируемый распад ГП ИПБ, что приводит к взрыву. Реакция протекает по сложному механизму ионного типа. Оптимальные условия процесса: концентрация катализатора серной кислоты 0,05…0,10% масс. от ГП ИПБ; температура 50…60оС; время контактирования 3,5 мин. Скорость реакции находится в сложной зависимости от концентрации кислоты при ее значениях меньше 0,01%. При концентрациях кислоты выше 0,01% константа скорости пропорциональна содержанию кислоты. Скорость реакции разложения увеличивается также с ростом температуры. При кислотном разложении ГП ИПБ очень важно поддерживать определенный температурный режим, выше определенной температуры выход фенола и ацетона снижается. Существенным является также протекание вторичных реакций при кислотном разложении ГП. Для понижения выхода побочных продуктов необходимо понижать концентрации фенола и ДМФК в смеси, а также уменьшать время их пребывания в присутствии серной кислоты в реакционной зоне. Понижение концентрации ГП позволяет также обеспечить полный распад его за один проход. Поэтому концентрированный ГП разбавляют в зоне реакции каким-либо циркулирующим разбавителем. Разбавление ГП самим изопропилбензолом нецелесообразно, так как его потом необходимо тщательно очистить от α –метилстирола, имеющую близкую температуру кипения, что усложнило бы систему ректификации. 1.5 Катализаторы процесса и оптимальные условия реакции Катализаторами процесса разложения ГПК являются сильные кислоты . Слабые кислоты вызывают разложение только при длительном нагревании до температуры порядка 100°С и значительной концентрации кислоты. В промышленности России в основном используют в качестве катализатора серную кислоту, которая является доступным, не требующим регенерации катализатором, легко выводится из системы нейтрализацией щелочью и обеспечивает высокий выход фенола [6]. В ряде патентов и работ указывается на возможность применения в качестве катализаторов кислотного разложения гидропероксидов ароматических сульфокислот, борсодержащих соединений, комплексных соединений различных металлов, фосфорной и хлорной кислот. Общим недостатком, присущим указанным выше катализаторам, является необходимость нейтрализации реакционной массы и выделения из нее минеральных солей. Кроме того, на нейтрализацию необходимо расходовать щелочь, воздействие которой может вызвать щелочное осмоление продуктов. При нейтрализации и промывке реакционной массы образуются сточные воды, в которых растворяется и часть фенола. Разложение гидроперекиси кумола можно осуществлять и на пористом материале, пропитанном серной кислотой, а также с помощью катализаторов алкилирования (А1С13, FeCl3). В ряде работ имеется указание на возможность проведения реакции кислотного разложения гидропероксидов с использование катионообменных смол КУ-2, КУ-2-8, КУ-23. Исследование разложения ГП ИПБ различными кислотами показало, что эффективность кислот зависит от их силы. Так, слабые кислоты (щавелевая, метафосфорная) в количестве 2…3 % от массы ГП действуют лишь при температуре 100…120оС и дают низкий выход фенола и ацетона. В промышленных условиях принимают 98%-ную серную кислоту в виде раствора в ацетоне. В присутствии даже небольших количеств серной кислоты реакция идет с очень высокой скоростью. Однако эта реакция является гомогенно - каталитической, поэтому после реакции все ее продукты и серная кислота находятся в жидкой фазе. В связи с этим серная кислота как катализатор имеет следующие недостатки: вызывает коррозию оборудования, и необходимость в связи с этим нейтрализации продуктов разложения раствором щелочи или соды и, как следствие - большое количество сточных вод, с которыми теряется фенол и загрязняется окружающая среда. Поэтому более перспективно каталитическое разложение ГП ИПБ на твердых катализаторах - кислотах органического и неорганического происхождения. Применение твердых катализаторов исключает стадии нейтрализации и промывки, позволяет подавать на ректификацию практически безвыходную реакционную массу. В числе таких катализаторов называют компоненты: смолы типа КУ-2 при 50…60оС разлагают ИПБ. Однако при длительной работе происходит быстрое падение каталитической активности таких смол в результате окислительной деструкции, а также конденсации фенола и ацетона в порах катализатора. Поэтому трудно ожидать широкого использования ионообменных смол в качестве катализатора. В настоящее время проведено систематическое исследование реакции разложения ГП ИПБ на алюмосиликатных силлиманит цеолитсодержащих катализаторах. На опытной установке определили катализатор, представляющий интерес как по выходу фенола и ацетона, так и по выходу α- мс: аморфные АСКх-30, АСКх-15 и силлиманит содержащие ССК-5, ССК-10, ССК-20. По результатам исследования был предложен для промышленного использования в процессе разложения ГП ИПБ на фенол и ацетон катализатор АСКх- 30. Его применение позволяет увеличить выход фенола на 1…2%; α- мс- на 30% при снижении выхода фенольной смолы в 1,5 раза. В настоящее время как за рубежом, так и в СНГ в качестве катализатора используется концентрированная серная кислота. 1.6 Методы получения продуктов Приведено краткое описания промышленных процессов, которые в то или иное время использовались для получения фенола и ацетона. Методы получения фенола. В настоящее время подавляющее количество фенола получают синтетическим путем. Производство его из каменноугольного дёгтя, образующегося при коксовании угля, сравнительно невелико. Сульфонатный метод. Сульфонатный процесс был первым фенольным процессом, реализованным в промышленном масштабе фирмой «BASF» в 1899 г. Этот метод основан на сульфировании бензола серной кислотой с последующим щелочным плавлением сульфокислоты:  Несмотря на применение агрессивных реагентов и образование большого количества отходов сульфита натрия, данный метод использовался в течение почти 80 лет. В США это производство было закрыто лишь в 1978 году. Метод Рашига. В 1924 г. фирмой «Dow Chemical)) был разработан процесс получения фенола, включающий реакцию хлорирования бензола и последующий гидролиз монохлорбензола (процесс каталитического гидролиза галогензамещенных бензолов). Независимо аналогичная технология была разработана немецкой фирмой «I.G. Farbenindustrie Со». Впоследствии стадия получения монохлорбензола и стадия его гидролиза были усовершенствованы, и процесс получил название «процесс Рашига». Суммарный выход фенола по двум стадиям составляет 70 - 85%. Метод Рашига характеризуется использованием в процессе больших количеств хлористого водорода, коррозией, жесткими условиями проведения реакции и низкой конверсией за один проход, что обуславливает высокие энергозатраты [5]. Данный процесс был основным методом получения фенола в течение нескольких десятилетий. Циклогексановый процесс. Циклогексановый процесс разработанный фирмой «Scientific Design Со.», основан на окислении циклогексана в смесь циклогексанона и циклогексанола, которая далее дегидрируется с образованием фенола:  В 60-е годы фирма «Monsanto» в течение нескольких лет использовала этот метод на одном из своих заводов в Австралии, однако в дальнейшем перевела его на кумольный способ получения фенола [6]. Процесс разложение бензойной кислоты. В 1961 г. фирмой «Dow Chemical of Canada» был реализован процесс через разложение бензойной кислоты, это единственный способ синтеза фенола, основанный на использовании не бензольного сырья:  Обе реакции протекают в жидкой фазе. Первая реакция окисления толуола использовалась в Германии уже в период второй мировой войны для получения бензойной кислоты. Реакция протекает в довольно мягких условиях с высоким выходом. Вторая стадия является более трудной вследствие дезактивации катализатора и низкой селективности по фенолу. Полагают, что проведение этой стадии в газовой фазе может сделать процесс более эффективным . При получении фенола через бензолсульфокислоту необходимо расходовать большие количества таких веществ, как серная кислота, едкий натр, сернистый газ; а аппаратура подвергается интенсивной коррозии, целый ряд процессов оформляется периодически, условия проведения отдельных стадий процесса весьма жестки [6]. В настоящее время этот метод используется на практике, хотя его доля в мировом производстве фенола составляет лишь около 5%. Остальные 95% приходятся на кумольный метод. Методы получения ацетона. Ацетон широко применяют в качестве растворителя и промежуточного продукта органического синтеза, а также из него получают дифенилолпропан, который используется в производстве эпоксидных полимеров и поликарбонатов; диацетоновый спирт, изобутилметилкетон, метилметакрилат, винилметилкетон и другие ценные продукты. 1. Брожение крахмала. Метод ферментативного брожения является самым старым методом получения ацетона, используемым в промышленных масштабах. В результате жизнедеятельности некоторых видов бактерий крахмал превращается в ацетон и н-бутиловый спирт. В качестве сырья для этого процесса чаще всего применяют кукурузную муку. 2. Производство ацетона из изопропилового спирта. а). каталитическое дегидрирование изопропилового спирта. Метод каталитического дегидрирования изопропилового спирта в ацетон осуществляется в промышленности США с 1923 г. и получил широкое распространение в дрегих странах [5,7]. Процесс протекает в одну стадию по реакции:  В качестве катализатора используется главным образом окись цинка, осаждённая на пемзе. Выход ацетона составляет около 90%. На 1т ацетона расходуется 1,1 – 1,2т изопропилового спирта или около 0,9т пропилена. б). Неполное окисление изопропилового спирта в паровой фазе. Реакция неполного окисления изопропилового спирта:  Она протекает в присутствии металлических катализаторов – меди, серебра, никеля и т д. Высокий выход ацетона достигается при использовании серебра, осаждённого на пемзе, или серебряной сетки. Температура реакции может изменяться в широких пределах (450-650 0C ) и выбирается в зависимости от применяемого катализатора, объёмной скорости паров спирта и воздуха и других факторов. в). Неполное окисление изопропилового спирта в жидкой фазе. Этот метод, применяемый для производства перекиси водорода, осуществляется с 1957 года на заводе фирмы «Shell Chemical Co.» в США. Процесс протекает по схеме:  Протекает автокаталитически при 90-140 0C под давлением, позволяющим удерживать смесь в жидкой фазе. В качестве окислителя можно применять как воздух, так и кислород. Выход ацетона составляет 95% от теоретического, выход перекиси водорода около 87%. 3. Производство ацетона из уксусной кислоты. Процесс проводят путём пропускания паров уксусной кислоты над окисью церия при 400-450 0C и атмосферном давлении:  Выход ацетона достигает 95% от теоретического. Метод совместного получения фенола и ацетона (кумольный метод). Кумольный метод получения фенола совместно с ацетоном включает три стадии: алкилирование бензола в кумол (ИПБ), окисление кумола в Гидропероксид кумола (ГПИПБ) и последующее его разложение на фенол и ацетон:  Впервые этот метод был открыт и разработан в СССР, группой химиков, в которую входили П.Г. Сергеев, Р.Ю. Удрис и Б.Д. Кружалов. На Западе кумольный метод был разработан в конце 40-х годов и известен как процесс Хока по имени немецкого учёного, независимо открывшего кумольный метод синтеза фенола-ацетона. В промышленном масштабе этот метод стал впервые использоваться в США в начале 50-х годов [6,7]. Метод совместного синтеза фенола и ацетона через гидроперекись изопропилбензола имеет ряд очевидных преимуществ перед другими методами. Кумольный метод выгодно отличается от перечисленных методов мягкими условиями проведения всех стадий процесса, применением значительно меньших количеств серной кислоты и щелочи, отсутствием хлора и соляной кислоты. Большое значение для экономики процесса производства фенола кумольным методом имеет использование побочных продуктов и их реконверсия в фенол. Особенно это относится к фенольной смоле. Сложной проблемой является переработка сточных вод, содержащих фенол. Сброс фенольных вод в водоемы недопустим. Предложено извлекать фенол из сточных вод в специальном экстракторе. Поскольку кумольный метод представляет собой как метод совместного получения фенола и ацетона, то окончательный вывод о его экономичности может быть сделан лишь при сравнении этого метода с другими методами производства. Таким образом, метод совместного получения фенола и ацетона через изопропилбензол является наиболее экономичным из применяемых в настоящее время в промышленности методов синтеза фенола и ацетона. 1.7 Технологическое оформление процесса Кислотное разложение ГП ИПБ протекает с выделением тепла в количестве 2080 кДж на 1 кг ГП. Поэтому в реакторе должен быть интенсивный отвод тепла для поддержания оптимальной температуры. Более совершенный вид реактора изотермический. В этом реакторе разложение ГП ИПБ осуществляется в избытке ацетона с отводом тела реакции за счет испарения ацетона. Эта схема отвода тепла очень эффективна. Для разложения ГП ИПБ применяют сильные кислоты. Общим недостатком, присущим разложению с помощью любых растворимых кислот, является необходимость нейтрализации реакционной массы и выведения из нее солей, чтобы исключить коррозию и выпадение осадков в ректификационной аппаратуре. Поэтому в технологической схеме присутствует узел нейтрализации и обводнения реакционной массы. Щелочной водой производится обводнение реакционной массы с целью растворения солей и частично ее нейтрализация. Для полной нейтрализации применяют также 8…10% раствор кальцинированной соды. Реакционная масса после разложения ГП ИПБ представляет сложную смесь ацетона, фенолов, побочных продуктов превращения ГП, главным из которых являются соответствующие карбинолы, кетоны, непредельные углеводороды и, наконец, непрореагировавший и неотделенный от ГП ИПБ исходный углеводород [6]. В связи с этим ректификация проводится в системе ректификационных колонн, непрерывно действующих. В первой из них отгоняется наиболее летучий ацетон, который для дополнительной очистки. Затем в вакууме отделяют α-метилстирольную фракцию. Кроме того, получается тяжелый остаток - смолосодержащие высококипящие компоненты. Недостатком технологической схемы является проблема переработки сточных вод, содержащих фенол. Сброс фенольных вод в водоемы недопустим. Предложено извлекать фенол из сточных вод в специальном экстракторе. Процесс получения фенола и ацетона состоит из следующих стадий: разложение ГП ИПБ; нейтрализация и обводнение кислой реакционной массы, раскисление фенолята натрия; выделение ацетона; выделение фенола; переработка фенольной смолы; переработка углеводородной фракции и фенольной воды. Технологическая схема процесса приведена на рисунке 1.2. 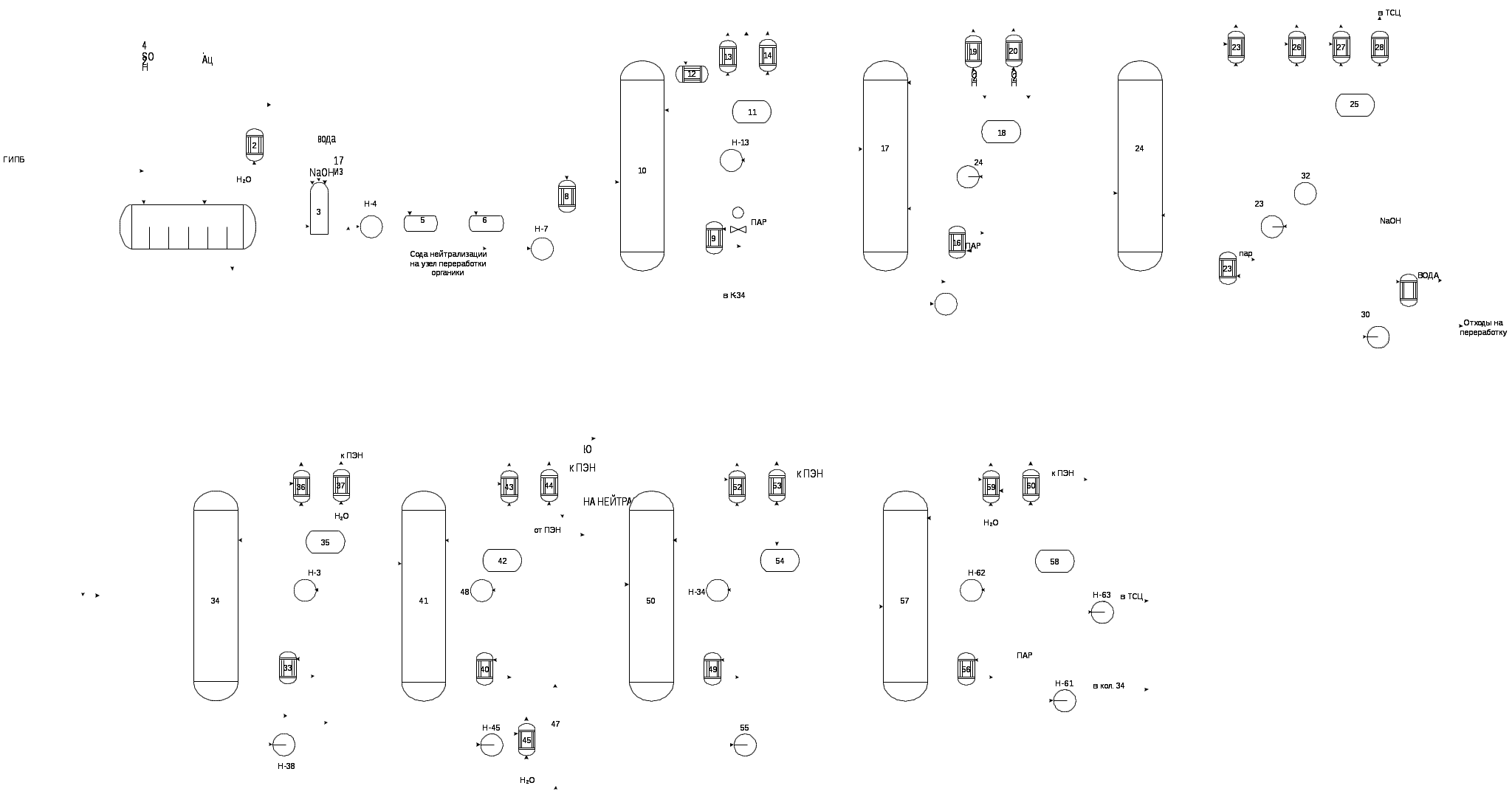 Рисунок 1.2 – Принципиальная технологическая схема разложения ГП ИПБ |
