СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ ПЕРВИЧНОЙ И ВТОРИЧНОЙ ПРОФИЛАКТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ. СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ ПЕРВИЧНОЙ И ВТОРИЧНОЙ ПРОФИЛАКТИКИ РАКА. Современные возможности первичной и вторичной профилактики рака молочной железы
 Скачать 261.27 Kb. Скачать 261.27 Kb.
|
|
Современные возможности первичной и вторичной профилактики рака молочной железы Ноговицина Екатерина Михайловна, кандидат биологических наук, ФГБОУ ВО Пермский государственный университет им. академика Е.А. Вагнера Минздрава России, доцент кафедры нормальной физиологии, 614000, Россия, г. Пермь, ул. Петропавловская, 26; еmail: nogov81@list.ru Аннотация Профилактика рака молочной железы подразделяется на первичную и вторичную. Первая подразумевает генетические и скрининговые исследования, вторая – предотвращение развития повторного рака. Наблюдается усовершенствование оценки систем риска развития рака у женщин с необнаруженными на данный момент злокачественными новообразованиями и повторного их развития после лечения. Постоянно возрастает числом выполнения профилактических хирургических вмешательств (профилактическая мастэктомия, профилактическая аднексэктомия) у пациентов-носителей BRCA-мутации. Однако пока нет определенного ответа на вопрос о причине возникновения рака молочной железы, так как это системное и многофакторное заболевание. Ключевые слова: рак молочной железы, РМЖ, профилактика, первичная, вторичная, маммография, ММГ, химиотерапия, мастэктомия. MODERN OPPORTUNITIES FOR PRIMARY AND SECONDARY PREVENTION OF BREAST CANCER Nogovitsina Ekaterina Mikhailovna, Candidate of Biological Sciences, Perm State University named after Academician E.A. Wagner of the Ministry of Health of Russia, Associate Professor of the Normal Physiology Department, 614000, Russia, Perm, Petropavlovskaya st., 26; email: nogov81@list.ru Annotation Prevention of breast cancer is divided into primary and secondary. The first involves genetic and screening studies, the second is the prevention of the development of recurrent cancer. There is an improvement in the assessment of cancer risk systems in women with currently undetected malignant neoplasms and their re-development after treatment. The number of preventive surgical interventions (prophylactic mastectomy, prophylactic adnexectomy) in patients with BRCA mutations is constantly increasing. However, there is still no definite answer to the question about the cause of breast cancer, since it is a systemic and multifactorial disease. Key words: breast cancer, prevention, primary, secondary, mammography, MMG, chemotherapy, mastectomy. Несмотря на десятилетия лабораторных, эпидемиологических и клинических исследований, заболеваемость раком молочной железы (РМЖ) продолжает расти. По данной мировой статистики онкологическая патология обнаруживается у каждой 20 женщины [1]. Возросло число выполнения профилактических хирургических вмешательств в связи их высокой эффективностью у пациентов-носителей BRCA-мутации. Исследование профилактических возможностей для предотвращения РМЖ возрастает. В настоящее время нет определенного ответа на вопрос о причине возникновения РМЖ, так как это системное и многофакторное заболевание [2]. Цель работы – анализ современных возможностей и направлений развития первичной и вторичной профилактики РМЖ. Обнаружено, что многие клинические и генетические факторы повышают риск развития РМЖ. Современные стратегии снижения риска развития патологии у женщин включают первичную профилактику: отказ от курения, использования экзогенных гормонов и чрезмерного воздействия ионизирующего излучения; поддержание нормального веса, физические упражнения, грудное вскармливание, здоровое питание и сведение к минимуму употребления алкоголя. Препараты химиопрофилактики доступны для лиц с высоким риском, хотя они недостаточно используются у таких женщин. Мастэктомия и/или двусторонняя овариэктомия являются разумными стратегиями для женщин с вредными мутациями в генах, резко повышающих риск развития РМЖ. В разработке находится множество стратегий профилактики РМЖ. Разрабатываемые персонализированные подходы сосредоточены на достижениях точной медицины, знаниях об иммунной системе и микроокружении опухоли, а также их роли в развитии рака. Успехи в понимании рисков и развития РМЖ позволяют исследователям целенаправленно ориентироваться на группы населения с конкретным анамнезом. Предпринимаются профилактические клинические испытания для оценки подходов к профилактике рака с использованием нескольких агентов в надежде на повышение эффективности по сравнению с отдельными препаратами. Наблюдается также тенденция к расширению использования химиопрофилактики РМЖ с доказанной эффективностью, в частности тамоксифена и ралоксифена [3]. Около 70% злокачественных новообразований (ЗНО) провоцируются экзогенными факторами, в частности для РМЖ – образ жизни женщины, ее питание и физическая активность. Чрезмерное употребление пищи с высоким содержанием жиров, алкоголя, недостаток физической нагрузки, избыточный вес – все это относят к факторам риска (табл. 1) РМЖ [4]. Таблица 1. Влияние на профилактику РМЖ устранения факторов риска образа жизни
У женщин менопаузального периода увеличение индекса массы тела на каждые 5 кг/м2 увеличивает риск развития РМЖ в постменопаузе на 12% [10]. Известно, что этанол влияет на концентрацию эстрогена с помощью нескольких механизмов (рисунок) [11]. В результате наблюдается увеличение сывороточных концентраций эстрогенов в связи с повреждением гепатоцитов ацетальдегидом. Отмечено, накопление гидроксиметаболитов эстрагенов, незавершение реакций их метилирования. Повышается уровень генотоксичных катехолэстрогенов [12]. 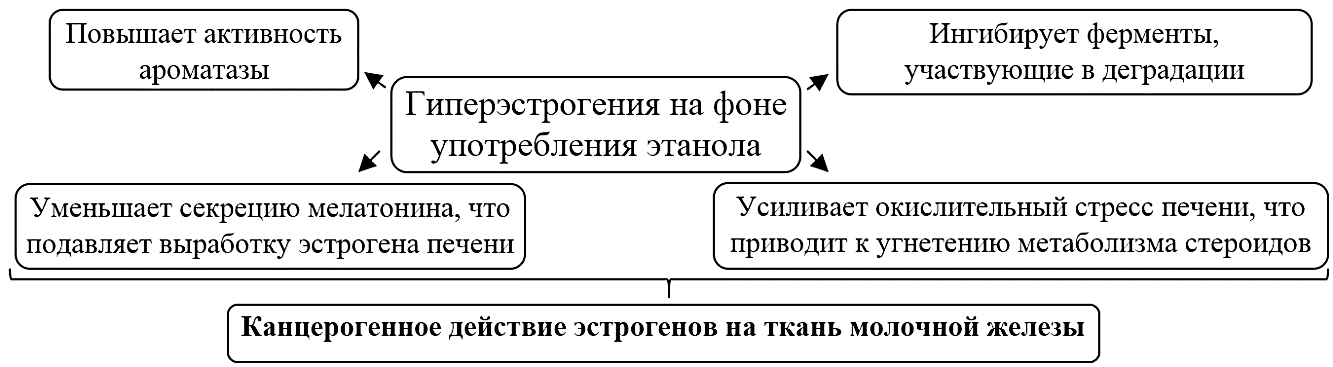 Рисунок. Влияние этанола на метаболизм эстрогенов. Составлено по данным [11]. Ожирение связано с РМЖ в постменопаузе, а физические упражнения, эквивалентные бегу продолжительностью до 8 ч в неделю, снижают риск РМЖ непосредственно и за счет снижения ожирения. В Австралии употребление алкоголя может быть причиной 5,8% случаев РМЖ. Курение также относят к факторам риска развития РМЖ [2]. Избыточная масса тела является установленной причиной РМЖ в постменопаузе. По сравнению с женщинами со стабильным весом (±2 кг) женщины с устойчивой потерей веса ≥9 кг даже с небольшим обратным возвратом килограммов имели более низкий риск РМЖ. Устойчивая потеря веса, даже в небольших количествах, связана с более низким риском РМЖ у женщин в возрасте ≥50 лет [13]. Физическая активность может также снизить частоту рецидивов и увеличить выживаемость пациентов с РМЖ [14]. Выявлено, что большинство женщин имеет недостаточный уровень знаний о факторах риска РМЖ [15]. Необходимо повышать уровень осведомленности населения о возможностях первичной профилактики РМЖ, в том числе посредством коррекции питания, физической активности, вредных привычек [16]. Заболеваемость РМЖ увеличивается, несмотря на разработку и использование современных технологий диагностики и лечения, поэтому нужно повышать уровень осведомленности населения о причинах, течении, клинических проявлениях, необратимых последствиях заболевания [17]. Выявлено влияние факторов питания на профилактический эффект и уровень риска развития РМЖ (табл. 2). Таблица 2. Влияние факторов питания на профилактику РМЖ
Примечание: Составлено по данным [19, 20]. Выявлено, что поглощение железа было защитным, в то время как потребление сурьмы – фактором риска РМЖ у женщин с мутацией BRCA1 [19]. Выделяют также медицинские и профессиональные факторы риска РМЖ: длительное применение комбинированной заместительной гормональной терапии эстрогенами/прогестероном и оральных контрацептивов, ионизирующее излучение (диагностическое, терапевтическое, профессиональное, в некоторых случаях их воздействие должно быть уменьшено) [2]. Мастопатия как фактор риска развития РМЖ в связи с общей этиологией нуждается в лечении. Установлено, что риск РМЖ минимален при непролиферативных формах мастопатии и существенно (в 2 и 4 раза) повышается при пролиферативной форме без атипии и с атипией, а также (до 12 раз) при предраковых изменениях (атипическая гиперплазия, карцинома in situ). Для профилактики РМЖ и лечения мастопатии рекомендуют препарат Мамоклам® – негормональный лекарственный препарат с органически связанным йодом [21, 22]. Важность доброкачественных заболеваний МЖ как маркера повышенного риска РМЖ остается недооцененной [23]. Профилактика РМЖ должна включать мероприятия, направленные не только на снижение риска рака, но и на выявление заболевания на ранней стадии (первичная и вторичная профилактика). Сегодня можно выявить женщин с высокими риском РМЖ и маммографической плотностью. Им следует предложить индивидуальный скрининг, а для первых – еще и первичные профилактические инициативы [24]. Маммография (ММГ) является наиболее информативным методом обследования молочных желез (МЖ) [25]. ММГ применяется для получения изображений МЖ с высоким разрешением (низкоэнергетические рентгеновские лучи, всего 20 мин. тестирования, не требуется контрастирования). У женщин в возрасте 50-70 лет наблюдалось значительное снижение смертности от РМЖ после скрининга с помощью ММГ, для возраста 40-49 лет показатель был незначительным. Гипердиагностика, несомненно, является серьезной проблемой ММГ, которую нельзя игнорировать во время профилактического скрининга РМЖ. Магниторезонансная томография (МРТ) более чувствительна, чем ММГ, у женщин из группы высокого риска, особенно при выявлении инвазивной протоковой карциномы. Эффективность применения МРТ не зависит от плотности МЖ и имеет преимущества в выявлении скрытого первичного РМЖ, подмышечных узловых метастазов, остаточных опухолей после неоадъювантной химиотерапии или других небольших опухолей. Современные МРТ-сканеры могут измерять ткани размером до 0,5 мм. Нет никаких выявленных преимуществ МРТ в отношении результатов лечения пациентов: частота выявления рецидива ипсилатеральной опухоли МЖ и заболеваемости контралатеральным раком МЖ. Специфичность МРТ намного хуже, чем у ММГ, с частотой выявления 37-100%. Чувствительность МРТ может быть полезным выбором в группах высокого риска, когда результаты маммографии в норме [26]. Посредством ММГ и ультразвукового исследования (УЗИ) можно обнаружить опухоли размером от 3 мм и 5-6 мм соответственно. Метод микроволновой радиотермометрии (РТМ) позволяет выявить зоны риска развития ЗНО за 2-3 года до их появления на ММГ/УЗИ. Тепловые изменения обнаруживаются на стадии, предшествующей злокачественному росту, поэтому метод имеет большой потенциал для онкопрофилактики [25]. Метод используется в качестве дополнительного для визуализации скрытых поражений в пораженной и/или незатронутой контралатеральной МЖ [27]. Хотя традиционная пленочная ММГ имеет ограничения в обнаружении плотных молочных желез, цифровая ММГ может преодолеть этот недостаток. Выявлено, что метод обладает лучшими диагностическими показателями, чем пленочная ММГ, у женщин в пре- и перименопаузе с плотной грудью моложе 50 лет. УЗИ намного точнее, если оператор квалифицирован и опытен [26]. Более интенсивное наблюдение, включая ежегодную ММГ и МРТ МЖ (обычно чередуются каждые 6 месяцев), начиная с 25 лет или индивидуально, исходя из самого раннего возраста начала заболевания в семье, значительно улучшило раннее выявление РМЖ у пациенток с вредными мутациями BRCA1 [28]. Вторичная профилактика включает самообследование МЖ, а также современные и более точные методы визуализации и профилактическое фармакологическое лечение [29]. Профилактика рецидивов РМЖ у женщин после аугментационной маммопластики с применением имплантов имеет свои трудности по причине наличия силиконового имплантата, приводящего к ухудшению возможностей применения традиционных методов лучевой (снижение уровня визуализации) и инструментальной диагностик [30]. Учитывая тот факт, что количество эстетических операций на МЖ с использованием эндопротезов увеличивается, а выявление новых случаев ЗНО не снижается, некоторые исследователи предполагают наличие связи аугментационной маммопластики с последующим появлением ЗНО по причине неполноценного клинико-инструментального обследования [2]. Основной объем МЖ при выполнении ММГ перекрывает интенсивная тень от имплантата. Наиболее высокая (98,1%) точность для таких женщин отмечалась при исследовании МЖ посредством МРТ [30]. Разработаны препараты для вторичной профилактики, снижающие риск РМЖ, однако при разработке/тестирования новых профилактических средств необходимо учитывать барьеры, препятствующие принятию и соблюдению существующих лекарств для женщин с мутациями зародышевой линии высокого риска и без них [1, 29]. Профилактическая терапия селективными модуляторами рецепторов эстрогена (СМРЭ): тамоксифеном и ингибиторами ароматазы (ИА) существенно снижает риск РМЖ дольше периода активного лечения [21]. В отличие от хорошо зарекомендовавших себя и клинически реализованных программ снижения риска для носителей мутаций BCRA 1 и 2, аналогичные программы для женщин с другими причинами высокого риска затруднительны отчасти из-за менее точных оценок [31]. При выполнении химиопрофилактики рецептор эстрогена (РЭ) является основной мишенью, так как более 70% случаев РМЖ являются РЭ-позитивными формами. СМРЭ являются основным классом антиэстрогенных препаратов и действуют как агонисты, так и антагонисты РЭ [26]. При уровне прогнозируемого пятилетнего абсолютного риска ≥1,66% по инструменту оценки Национального института рака (BCRAT) в связи рекомендациями ASCO (Американское общество клинической онкологии) медицинским работникам рекомендуется обсудить химиопрофилактику РМЖ [31]. Химиопрофилактика тамоксифеном может снизить частоту рака, положительного на рецептор эстрогена (у 51% с высоким риском РМЖ), однако выявлены побочные эффекты применения препарата [2]. В исследовании влияния приема тамоксифена в дозе 20 мг/сут. у женщин с высоким риском развития рака (>1,7%) в течение 5 лет выявлено, что при приеме препарата частота случаев рака была в 1,7 раз ниже по сравнению с плацебо (24,8 и 42,5 случаев на 1 тыс. женщин в год соответственно) со снижением риска на 0,57 для инвазивного рака. Для женщин ≥50 лет статистически значимо при приеме препарата возрастают риски развития рака эндометрия и тромэмболических осложнений. В другое исследование были включены здоровые женщины с приемом тамоксифена на протяжении 8 лет. Установлено, что слабый эстрогенный эффект препарата влияет на эндометрий, вызывая гиперплазию, полипы, рак эндометрия [32]. Тамоксифен имеет самые обильные клинические данные среди СМРЭ, может снизить риск инвазивного и неинвазивного РМЖ, снижает риск РЭ-положительного РМЖ более чем на 30% после 5 лет лечения, однако не наблюдалось значительного снижения РЭ-негативных опухолей. Риск рака эндометрия, инсульта, тромбоэмболии легочной артерии и тромбоза глубоких вен повышается у пациенток, получающих тамоксифен, особенно среди женщин старше 50 лет. Поэтому препарат следует применять индивидуально, балансируя между его токсичностью и пользой [26]. Ралоксифен, который наряду с тамоксифеном также может уменьшать остеопороз, может использоваться у женщин в постменопаузе для снижения риска РМЖ, но не связан с развитием рака матки [2]. Ралоксифен (СМРЭ второго поколения) с меньшим количеством побочных эффектов был одобрен для лечения инвазивного рака РМЖ у женщин в постменопаузе. Однако препарат не оказывает влияния на протоковую и лобулярную карциномы in situ. Исследование испытаний тамоксифена и ралоксифена показало, что последний менее эффективен, чем первый. Также было обнаружено несколько СМРЭ третьего поколения (оспемифен, арзоксифен, лазофоксифен, базедоксифен), но только исследования последнего агента достигла клинической стадии [26]. Исследование профилактического действия ИА у женщин в постменопаузе на примере экземестана (25 мг/сут), принимаемого в течение 5 лет показало снижение риска только в отношении эстроген-положительного РМЖ. При исследовании анастрозола (1 мг/сут) в аналогичные сроки приема обнаружено снижение вероятности заболевания эстроген-положительных ЗНО МЖ на 50% [31]. ИА (стероидные и нестероидные ингибиторы) снижают уровни эстрогенов в плазме путем ингибирования ароматазы, катализирующей биосинтез эстрогена из андрогена. По сравнению с экземестаном (стероидным ингибитором) нестероидные (анастрозол, летрозол) могут обратимо связываться с активным сайтом фермента. Однако данные ИА не имеют существенных различий с точки зрения эффективности в профилактике РМЖ. В условиях адъювантной терапии ИА более эффективны, чем тамоксифен. Анастрозол вызывает меньше серьезных побочных эффектов, чем тамоксифен, у женщин в постменопаузе с ранним РМЖ. Ограничения ИА заключаются в ингибировании биосинтеза эстрогена, поэтому препараты используются только у женщин в постменопаузе и могут увеличить риск развития остеопороза. Приобретение резистентности раковых клеток к ИА наблюдалось после длительного лечения. Выявлено, что только 4,1% женщин из группы высокого риска готовы принимать препараты для химиопрофилактики [26]. Польза химиопрофилактики для снижения риска недостаточно четко определена, ее стратегии сосредоточены исключительно на профилактике у женщин из группы высокого риска [28]. Большинство наследственных опухолей МЖ чаще (в 1/3 случаев) возникают из-за мутаций в генах BRCA1 и BRCA2. Средний совокупный пожизненный риск РМЖ составляет примерно 72/69% у BRCA1/2 к 80 годам [28]. В связи с высокой эффективностью и возросшим числом выполнения профилактических хирургических вмешательств (мастэктомии и аднексэктомии) у пациентов-носителей BRCA-мутации, применение профилактических мастэктомий (ПМ) в группе с умеренным и высоким риском привело к снижению риска РМЖ на 89,5 и 96% [28, 32]. Хирургический метод сопровождался снижением смертности от РМЖ минимум на 90% у пациентов с мутацией BRCA [28, 29]. ПМ технически выполняется различными способами. Сейчас «золотым стандартом», по-видимому, является мастэктомия, способная оптимизировать онкологические и эстетические результаты, с сохранением кожной оболочки и комплекса «сосок-ареола» [28]. По сравнению с тактикой наблюдения хирургические методы профилактики РМЖ позволят дополнительно сохранить 9-88 лет жизни для 100 женщин с мутацией BRCA1/2. Предпочтительной тактикой ведения по клиникоэкономическим параметрам является выполнение двусторонней ПМ (по сравнению с аднексэктомией) в возрасте 40 лет, так как позволяет к 70 годам достичь лучших исходов при меньших затратах [33]. РМЖ часто бывает двусторонним и мультицентрическим у носителей мутации BRCA [28]. Двусторонняя ПМ снижает риск развития РМЖ на 90% у женщин из группы высокого риска [2, 34]. Двусторонняя сальпингоофорэктомия может снизить риск у носителей BRCA 2 в пременопаузе [34], рекомендуется для носителей мутации в возрасте 35-40 лет или после завершения деторождения, а также индивидуально в зависимости от возраста начала рака яичников в семье. Метод, по-видимому, обеспечивает относительное снижение риска РМЖ приблизительно на 50% [28]. Сообщалось, что у женщин с ранней РМЖ, перенесших одностороннюю мастэктомию, риск контралатерального РМЖ составляет 4% в течение 10 лет. Несмотря на заметное снижение заболеваемости контралатеральным раком молочной железы в США, женщины все чаще предпочитают проводить контралатеральную ПМ при одностороннем РМЖ с меньшим риском на ранних стадиях. Женщины с мутацией BRCA1/2 имеют повышенный пожизненный риск развития РМЖ в пределах 56-87%, а также повышенную вероятность развития второго контралатерального или ипсилатерального первичного РМЖ [27]. ПМ контрлатеральной МЖ с одномоментной реконструкцией уменьшает риск развития РМЖ до 96%. Для женщин с мутацией BRCA2 риск развития РМЖ к 80 годам составляет 69 (в целом) и 26% (для контрлатеральной МЖ) [35]. За последние двадцать лет число случаев контралатеральной ПМ неуклонно росло у женщин всех возрастных групп и стадий РМЖ [36]. Недавно для улучшения качества жизни пациентов с РМЖ была разработана биологическая профилактика (моноклональные антитела к ЗНО МЖ) в основном в отношении HER2 как мишени. Примерно в 20-30% всех случаев РМЖ наблюдается сверхэкспрессия белка HER2 или амплификация его гена. Трастузумаб (Герцептин) и Пертузумаб – гуманизированные моноклональные антитела, которые могут связываться с внеклеточной частью HER2. Однако для при их использовании были обнаружены побочные эффекты: застойная сердечная недостаточность и снижение фракции выброса левого желудочка, диарея и фебрильная нейтропения соответственно [26]. Заключение В современной медицине достигнуты ключевые успехи в персонализированной терапии РМЖ: доступность генетического тестирования, широкое использование медицинских изображений высокой четкости, программное обеспечение для получения трехмерных изображений. Оценка риска РМЖ у отдельной женщины проводится с использованием проверенных алгоритмов, и их, вероятно, будут продолжать улучшать с учетом новых факторов риска. Достигнуты большие успехи в клинических и теоретических исследованиях РМЖ. Смертность от заболевания снизилась, но патология является ведущей причиной смерти от рака среди женщин в возрасте 20-59 лет. Если РМЖ диагностирован как первичная опухоль или на ранней стадии метастазирования, то хирургическое удаление и химиотерапия эффективны. Раннее выявление является краеугольным камнем профилактики РМЖ. Биологическая профилактика и лечение РМЖ пока изучены недостаточно, однако могут быть многообещающими стратегиями в будущем. РМЖ развивается в результате многоступенчатого процесса, и патогенез этого заболевания полностью не выяснен. В последнее десятилетие было выявлено, что на РМЖ влияют генетические факторы и факторы окружающей среды. Адекватные медицинские ресурсы, которые могут защитить от этого заболевания, включают ежегодный маммографический скрининг и применение химиопрепаратов. Если женщины осведомлены о РМЖ, то самообследование груди может быть простым, экономичным и мотивированным методом профилактики заболевания. Благодаря снижению стоимости секвенирования ДНК, исследование может быть доступным для представителей среднего класса. Если у женщины есть семейная история РМЖ, целесообразно провести скрининг, особенно на наследственные гены предрасположенности к раку, такие как BRCA1 или BRCA2. Для минимизации риска РМЖ следует избегать таких факторов окружающей среды, как потребление экзогенных эстрогенов, злоупотребление алкоголем и избыточное потребление пищевых жиров. У физически активных женщин риск развития РМЖ в среднем на 25% ниже, чем у менее активных женщин. Регулярные физические упражнения могут быть удобным и недорогим способом профилактики РМЖ. Библиографический список Britt, K.L., Cuzick, J., Phillips, K.A. Key steps for effective breast cancer prevention // Nature reviews. Cancer. – 2020. – V. 20(8). – P. 417-436. – DOI: 10.1038/s41568-020-0266-x. Olver I.N. Prevention of breast cancer // The Medical journal of Australia. – 2016. – V. 205(10). – P. 475-479. – DOI: 10.5694/mja16.01007. Sauter E.R. Breast Cancer Prevention: Current Approaches and Future Directions // European journal of breast health. – 2018. – V. 14(2). – P. 64-71. – DOI: 10.5152/ejbh.2018.3978. Выхристюк Ю.В., Ройтберг Г.Е., Дорош Ж.В., Карасёва Н.В., Акобова Р.А. Профилактика развития рака молочной железы // Южно-российский онкологический журнал. – 2021. – № 1. – С. 50-56. Wu Y., Zhang D., Kang S. Physical activity and risk of breast cancer: a meta-analysis of prospective studies // Breast Cancer Res. Treat. – 2013. – V. 137(3). – P. 869-882. – DOI: 10.1007/s10549-012-2396-7. Hildebrand J.S., Gapstur S.M., Campbell P.T., et al. Recreational physical activity and leisure-time sitting in relation to postmenopausal breast cancer risk // Cancer Epidemiol Biomarkers Prev. – 2013. – V. 22(10). – P. 1906-1912. – DOI: 10.1158/1055-9965.EPI-13-0407. Eliassen A.H., Colditz G.A., Rosner B., et al. Adult weight change and risk of postmenopausal breast cancer // JAMA. – 2006. – V. 296(2). – P. 193-201. – DOI: 10.1001/jama.296.2.193. Teras L.R., Patel A.V., Wang M., et al. Sustained Weight Loss and Risk of Breast Cancer in Women 50 Years and Older: A Pooled Analysis of Prospective Data // J. Natl. Cancer Inst. – 2020. – V. 112(9). P. 929-937. – DOI: 10.1093/jnci/djz226. Key T.J., Appleby P.N., Reeves G.K., et al. Body mass index, serum sex hormones, and breast cancer risk in postmenopausal women // J. Natl. Cancer Inst. – 2003. – V. 95(16). – P. 1218-1226. – DOI: 10.1093/jnci/djg022. Renehan A.G., Tyson M., Egger M., et al. Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies // Lancet. – 2008. – V. 371(9612). – P. 569-578. – DOI: 10.1016/S0140-6736(08)60269-X. Liu Y., Nguyen N., Colditz G.A. Links between alcohol consumption and breast cancer: a look at the evidence // Womens Health (Lond). – 2015. – V. 11(1). – P. 65-77. – DOI: 10.2217/whe.14.62 Чагай Н.Б., Мкртумян А.М. Метаболизм эстрогенов, прижизненные нарушения процессов метилирования и рак молочной железы // Проблемы эндокринологии. – 2019. – № 65(3). – С. 161-173. Teras L.R., Patel A.V., Wang M., et al. Sustained Weight Loss and Risk of Breast Cancer in Women 50 Years and Older: A Pooled Analysis of Prospective Data. J Natl Cancer Inst. – 2020. – V. 112(9). – P. 929-937. DOI: 10.1093/jnci/djz226. de Boer M.C., Wörner E.A., Verlaan D., van Leeuwen P.A.M. The Mechanisms and Effects of Physical Activity on Breast Cancer // Clin Breast Cancer. – 2017. – V. 17(4). – P. 272-278. – doi: 10.1016/j.clbc.2017.01.006. Шертаева А.Б., Оспанова Д.А., Гржибовский А.М., Аубакирова А.С., Фазылов Т.Р. Факторы риска развития рака молочной железы // Вестник КазНМУ. – 2022. – №1. – С. 192-200. Чураков И.В., Кудрина Е.А. Эффективность мероприятий по первичной профилактике рака молочной железы на территории Удмуртской Республики // Современные проблемы здравоохранения и медицинской статистики. – 2019. – № 4. – С. 1-13 Юдинцева А.О., Мильчаков Д.Е. Экономическая целесообразность профилактики рака молочной железы // МНИЖ. – 2018. – № 4(70). – С. 89-91. Таракова Б.К., Култаев А.С., Есентаева С.Е., Жакенова Ж.К. Витамин Д3 в профилактике рака молочной железы: миф или реальность (обзор литературы) // Вестник КазНМУ. – 2021. – № 3. – С. 285-290. Sellami M., Bragazzi N.L. Nutrigenomics and Breast Cancer: State-of-Art, Future Perspectives and Insights for Prevention // Nutrients. – 2020. – V. 12(2). – P. 512. – DOI: 10.3390/nu12020512. Pirouzpanah S., Taleban F.A., Mehdipour P., Atri M. Association of folate and other one-carbon related nutrients with hypermethylation status and expression of RARB, BRCA1, and RASSF1A genes in breast cancer patients // J Mol Med (Berl). – 2015. – V. 93(8). – P. 917-934. DOI: 10.1007/s00109-015-1268-0. Беспалов В.Г. Патогенетическое лечение мастопатии и профилактика рака молочной железы // РМЖ. Мать и дитя. 2018. № 2. C. 141-147. Халикова Ф.Ш., Мукхидова Г.Х. Мастопатия и профилактика рака молочной железы как междисциплинарна проблема // ORIENSS. – 2022. – № 5‑2. – С. 114-127. Kolak A., Kamińska M., Sygit K., et al. Primary and secondary prevention of breast cancer // Ann. Agric. Environ. Med. – 2017. – V. 24(4). – P. 549-553. – DOI: 10.26444/aaem/75943. Hall P., Hammarström M., Hellgren R. Det är dags att skräddarsy bröstcancerpreventionen [It is time for individual breast cancer prevention] // Lakartidningen. – 2021. – V. 118. – P. 21092. Трифонова С.А., Куценко Г.А. Комплексная диагностика и профилактика рака молочной железы // Research'n Practical Medicine Journal. – 2018. – № Спецвыпуск 1. – C.81. Sun Y.S., Zhao Z., Yang Z.N., et al. Risk Factors and Preventions of Breast Cancer // Int. J. Biol. Sci. – 2017. – V. 13(11). – P. 1387-1397. – DOI: 10.7150/ijbs.21635. Santosa K.B., Oliver J.D., Momoh A.O. Contralateral prophylactic mastectomy and implications for breast reconstruction // Gland Surg. 2021. – V. 10(1). – P. 498-506. – DOI: 10.21037/gs.2020.03.15. Franceschini G, Di Leone A, Terribile D, Sanchez MA, Masetti R. Bilateral prophylactic mastectomy in BRCA mutation carriers: what surgeons need to know // Ann. Ital. Chir. – 2019. – V. 90. – P. 1-2. Britt K.L., Cuzick J., Phillips K.A. Key steps for effective breast cancer prevention. Nat Rev Cancer. – 2020. – V. 20(8). – P. 417-436. – DOI: 10.1038/s41568-020-0266-x. Ходорович О.С., Солодкий В.А., Калинина-Масри А.А., и др. Рак молочной железы у пациенток после аугментации имплантами // Вопросы онкологии. – 2021. – Т. 67. – № 4. – С. 518-524. – DOI 10.37469/0507-3758-2021-67-4-518-524. Borgquist S., Hall P., Lipkus I., Garber J.E. Towards Prevention of Breast Cancer: What Are the Clinical Challenges? // Cancer. Prev. Res (Phila). – 2018. – V. 11(5). – P. 255-264. – DOI: 10.1158/1940-6207.CAPR-16-0254. Портной С.М. Основные риски развития рака молочной железы и предложения по его профилактике // Опухоли женской репродуктивной системы. – 2018. – № 3. – С. 25-39. Ходорович О.С., Солодкий В.А., Деркач Е.В. Клинико-экономический анализ методов профилактики рака молочной железы у женщин-носителей мутации BRCA1/2 // Медицинские технологии. Оценка и выбор. – 2016. – № 3(25). – С. 68-77. Thorat M.A., Balasubramanian R. Breast cancer prevention in high-risk women // Best. Pract. Res. Clin. Obstet. Gynaecol. – 2020. – V. 65. – P. 18-31. – DOI: 10.1016/j.bpobgyn.2019.11.006. Трегубова А.В., Сухотько А.С., Масри А.А. Необходимость выполнения профилактической мастэктомии у больных с генетически обусловленным раком молочной железы // Research'n Practical Medicine Journal. 2018. – № Спецвыпуск 1. – C. 79-80. Scheepens J.C.C., Veer L.V., Esserman L., et al. Contralateral prophylactic mastectomy: A narrative review of the evidence and acceptability. Breast. – 2021. – V. 56. – P. 61-69. DOI: 10.1016/j.breast.2021.02.003. |
