Спецификация суммативного оценивания за четверть по предмету Химия 10 класс
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
5.Распределение проверяемых целей по уровням мыслительных навыков в разрезечетвертей
6.Правила проведения суммативного оцениванияСуммативное оценивание проводится в учебном кабинете, где закрыты любые наглядные материалы: диаграммы, схемы, постеры, плакаты или карты, которые могут быть подсказкой. Перед началом суммативного оценивания зачитывается инструкция и сообщается учащимся, сколько времени выделено для выполнения работы. Учащимся нельзя разговаривать друг с другом во время выполнения работы. Учащиеся имеют право задать вопросы по инструктажу, прежде чем приступят к выполнению работы. Учащиеся должны работать самостоятельно и не имеют право помогать друг другу. Во время проведения суммативного оценивания учащиеся не должны иметь доступа к дополнительным ресурсам, которые могут помочь им, например, словарям или справочной литературе (кроме тех случаев, когда по спецификации этот ресурс разрешается). Записи решений должны быть выполнены аккуратно. Учащимся рекомендуется зачёркивать карандашом неправильные ответы вместо того, чтобы стирать их ластиком. После окончания времени, отведенного на суммативное оценивание, учащиеся должны вовремя прекратить работу и положить свои ручки/ карандаши на парту. 7.Модерация и выставление балловВсе учителя используют одинаковую схему выставления баллов. В процессе модерации необходимо проверять образцы работ с выставленными баллами для того, чтобы не допускать отклонения от единой схемы выставления баллов. СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА ЧЕТВЕРТЬОбзор суммативного оценивания за 1 четверть Продолжительность – 40 минут Количество баллов – 30Типы заданий: МВО – задания с множественным выбором ответов; КО – задания, требующие краткого ответа; РО – задания, требующие развернутого ответа. Структура суммативного оцениванияДанный вариант состоит из 12 заданий, включающие вопросы, требующие краткого и развернутого ответов. В 3 вопросах с множественным выбором ответов обучающийся выбирает правильный ответ из предложенных вариантов ответов. В 4 вопросах, требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения. В 5 вопросах, требующие развернутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла. Оценивается способность обучающегося выбирать и применять математические приемы в ряде математических контекстов. Задание может содержать несколько структурных частей/ вопросов. Характеристика заданий суммативного оценивания за 1 четверть
8 Образец заданий и схема выставления баллов Задания суммативного оценивания за 1 четверть по предмету «Химия»Определите верное(-ые) утверждения для описания s – орбитали. s-орбитали имеют шарообразную форму у атома водорода электроны находятся только на s – орбиталях. s- и р- орбитали имеют одинаковую форму 1 1 и 2 2 1 и 3 [1] Напишите значения главного квантового и орбитального числа для атома с электронной конфигурацией 2,8,1 n = l = [2] Установите соответствие между электронной формулой и названиями элементов.
Ответ:
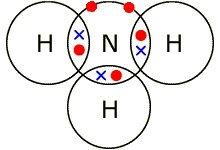
[3] Вычислите формулу соединения, в котором массовая доля калия составляет 56,5%, углерода – 8,7%, кислорода – 34,8%. [3] В результате распада атом смещается на 2 клетки к началу таблицу элементов, т.е. заряд ядра Z уменьшается на 2. (a) Назовите тип распада. _____________________________________________________ [1] (b) Напишите уравнение радиоактивного распада элемента 12150𝑆𝑆. ___________________________________________________________________________ [1] На примере элементов 2 группы покажите закономерность изменения следующих свойств: радиус атома: ___________________________________________________________________________ [1] число электронов на внешнем слое атома: ___________________________________________________________________________ [1] (с) энергия ионизации: ___________________________________________________________________________ [1] Кислотные свойства высших оксидов усиливаются в ряду цезий, цинк, кремний алюминий, бериллий, стронций фосфор, азот, мышьяк германий, цинк, калий [1] Литий (Li), натрий (Na), калий (К), рубидий (Rb), цезий (Cs) и франций (Fr) относятся к щелочным металлам, которые расположены в І группе периодической системы. Металлические свойства сверху вниз по группе увеличиваются. Спрогнозируйте физические и химические свойства цезия (укажите по два свойства). Физические свойства: ___________________________________________________________________________ [1] Химические свойства ___________________________________________________________________________ ___________________________________________________________________________ [2] Напишите подтверждающие уравнения реакции: ___________________________________________________________________________ ___________________________________________________________________________ [2] Нарисуйте диаграмму «точек и крестов», показывая внешние электроны и заряды аммиака. [2] Объясните, почему метан — это газ (при комнатной температуре), основываясь на электронном и пространственном строении молекулы.
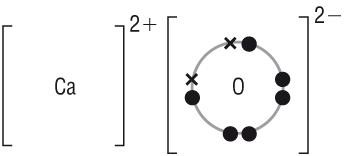
[1] ___________________________________________________________________________ [1] Нарисуйте диаграмму «точек и крестов» молекулы оксида кальция, показывая внешние электроны. [2] В таблице показаны некоторые физические константы веществ А - D.
Укажите, какое из веществ является железом. Объясните, как вы пришли к этому выводу. железо – это вещество _____________________________________________________ объяснение ______________________________________________________________ [2] Укажите, какое из веществ является хлороводородом. Объясните, как вы пришли к этому выводу. хлороводород – это вещество _______________________________________________ объяснение ______________________________________________________________ [2] Схема выставления баллов
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||