Спецификация суммативного оценивания за четверть по предмету Химия 10 класс
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 3 ЧЕТВЕРТЬОбзор суммативного оценивания за 3 четверть Продолжительность – 40 минут Количество баллов – 30Типы заданий: МВО – задания с множественным выбором ответов; КО – задания, требующие краткого ответа; РО – задания, требующие развернутого ответа. Структура суммативного оцениванияДанный вариант состоит из 9 заданий, включающие вопросы с множественным выбором ответов, требующие краткого и развернутого ответов. В вопросах с множественным выбором ответов обучающийся выбирает правильный ответ из предложенных вариантов ответов. В 5 вопросах, требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения. В 2 вопросах, требующие развернутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла. Оценивается способность обучающегося выбирать и применять математические приемы в ряде математических контекстов. Задание может содержать несколько структурных частей/вопросов. Характеристика заданий суммативного оценивания за 3 четверть
23
24 Образец заданий и схема выставления баллов Задания суммативного оценивания за 3 четверть по предмету «Химия»1. В таблице приведены температуры плавления и кипения элементов первой группы: лития, натрия и калия.
Используя информацию, определите температуру плавления и кипения рубидия.
Ответ: ________________________ Объясните ваш ответ. _________________________________________________________________________ _________________________________________________________________________ [2] Предположите сколько электронов находится на внешнем энергетическом уровне атома рубидия. ___________________________________________________________________________ [1] Расположите элементы 1 группы (цезий, литий, калий, рубидий и натрий) в порядке по взаимодействию с водой. Начните ряд с самого менее реакционного. ___________________________________________________________________________ [1] Составьте возможные сбалансированные уравнения химических реакций алюминия со следующими веществами: 1) Сульфат магния 2) Хлорид калия Нитрат меди (II) Соляная кислота Напишите сбалансированные уравнения реакции, подтверждающие ваш выбор. __________________________________________________________________________ __________________________________________________________________________ [2] Ежегодно во всём мире тысячи людей погибают от воздействия токсичных металлов. Назовите два токсичных тяжёлых металла: [1] Назовите два вредных воздействия тяжелых металлов на организм человека. _________________________________________________________________________ _________________________________________________________________________ [1] Назовите два способа попадания тяжелых металлов в организм человека. ________________________________________________________________________ ________________________________________________________________________ [2] Заполните наблюдения и запишите выводы по качественному определению ионов металлов.
[3] Одним из распространенных соединений водорода является вода. Вода в природе бывает жесткой и мягкой. Опишите, как в домашних условиях можно устранить временную жесткость воды. Напишите соответствующее уравнение химической реакции. __________________________________________________________________________ [1] (a) Даны формулы соединений железа: Fe(OH)2, Fe, FeSO4, FeO. Составьте генетический ряд железа. ___________________________________________________________________________ [1] Напишите уравнение реакции получения гидроксида железа (II) из сульфата железа (II). ___________________________________________________________________________ [1] Рассчитайте количества вещества и массу осадка, если в реакцию вступило 20 г раствора сульфата железа (II), с массовой долей 10% [3] Учащийся добавил гидроксид натрия в пробирки с неизвестными веществами № 1, 2, 3 и 4. В результате, в первой пробирке образовался осадок голубого цвета во второй – белый студенистый осадок, растворимый в избытке гидроксида натрия в третьей – бурый осадок в четвертой – осадок не образовался. Назовите, соли каких металлов находились в пробирках под номерами 1, 2, 3 и 4. ____________________________________, 2 - _______________________________ 3- ____________________________________, 4 - _______________________________ [4] На рисунке представлен эксперимент по коррозии железа. Объясните, в каком из стаканов коррозия протекает сильнее, а в каком слабее. 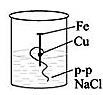 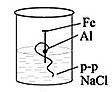 1 2 Сформулируйте вывод о влиянии металлов разной активности на коррозию железа. ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ [3] 12 кг оксида кремния с массовой долей примесей 8% восстанавливают магнием по уравнению реакции SiO2 + 2Mg →2MgO + Si. Какова масса полученного кремния, если выход кремния от теоретически возможного равен 65%? [4] Схема выставления баллов
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
