Спецификация суммативного оценивания за четверть по предмету Химия 10 класс
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 2 ЧЕТВЕРТЬОбзор суммативного оценивания за 2 четверть Продолжительность – 40 минут Количество баллов – 30Типы заданий: МВО – задания с множественным выбором ответов; КО – задания, требующие краткого ответа; РО – задания, требующие развернутого ответа. Структура суммативного оцениванияДанный вариант состоит из 9 заданий, включающие вопросы с множественным выбором ответов, требующие краткого и развернутого ответов. В вопросах с множественным выбором ответов обучающийся выбирает правильный ответ из предложенных вариантов ответов. В вопросах, требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения. В вопросах, требующие развернутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла. Оценивается способность обучающегося выбирать и применять математические приемы в ряде математических контекстов. Задание может содержать несколько структурных частей/вопросов. Характеристика заданий суммативного оценивания за 2 четверть
16 Образец заданий и схема выставления баллов Задания суммативного оценивания за 2 четверть по предмету «Химия»Используя метод электронного баланса, составьте уравнение реакции: KMnO4 + HCl = KCl + Cl2 + MnCl2 + H2O Определите окислитель и восстановитель, покажите переход электронов. ___________________________________________________________________________ ___________________________________________________________________________ [2] Установите соответствие между формулой вещества и продуктом, который образуется в результате электролиза.
Ответ: A - ___ B - ___ C - ___ D - ___ [4] На рисунке показана установка для электролиза растворов. Спрогнозируйте продукты электролиза раствора нитрата серебра. 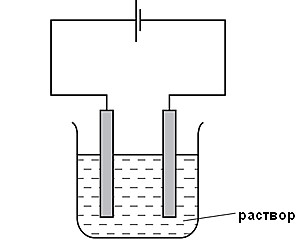 Запишите схемы процессов, протекающих на электродах: Катод (-): _______________________________________ Анод (+): _______________________________________ Молекулярное уравнение электролиза: ______________________________________________________________________ [2] Рассчитайте массу (г) и объем (л) выделившегося на аноде газообразного вещества при электролизе 85 г нитрата серебра. [3] (a) Выберите соли, подвергающиеся гидролизу в водных растворах: нитрат меди, сульфат натрия, карбонат калия, хлорид лития. ___________________________________________________________________________ [1] (b) Составьте уравнение гидролиза в молекулярной и ионной форме для любой соли из задания (a). ___________________________________________________________________________ ___________________________________________________________________________ [2] (с) Определите реакцию среды водного раствора данной соли. ___________________________________________________________________________ [1] Рассчитайте количество теплоты, которое требуется для получения 4 моль оксида кальция при обжиге известняка, протекающем в соответствии с уравнением CaCO3 → CaO + CO2 – 178,96 кДж. [2] Ученик провел реакцию разбавленной кислоты и металла и измерил скорость реакции. По результатам составил график (кривая Х). Эксперимент повторили, но изменили условия (кривая Y). 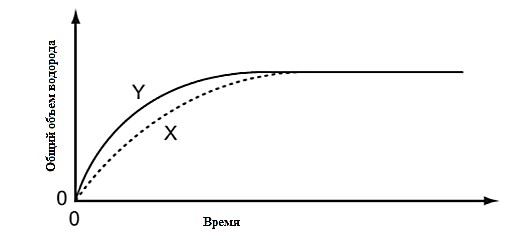 Какое изменение в условиях реакции дает такой результат (кривая Y)?
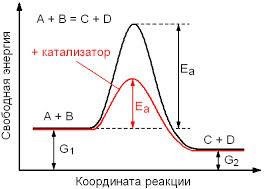
[1] Рассчитайте, как изменится скорость реакции 2СО(г) + О2 → 2СО(г) при одновременном увеличении концентрации в 2 раза и понижении температуры от 60 до 0 градусов, если температурный коэффициент равен 2. Кинетическое уравнение υ = k[A]2*[B]. Подтвердите свой ответ расчётами. уменьшилась в 4 раза уменьшилась в 8 раз увеличилась в 8 раз увеличилась в 4 раза [3] Одним из лабораторных способов получения кислорода является разложение пероксида водорода: 2Н2О2 + MnO2 = 2Н2О + O2 + MnO2. Назовите катализатор данной реакции. Объясните протекание реакции гетерогенного катализа с точки зрения теории частиц. ___________________________________________________________________________ ___________________________________________________________________________ [4] На графике приведено значение энергии активации для реакции, протекающей в отсутствии катализатора. Покажите на данном графике изменение энергии активации для данной реакции, иллюстрирующее «работу» катализатора. 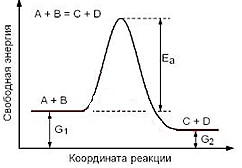 [1] (a) Окисление диоксида серы в триоксид серы протекает в контактном аппарате при производстве серной кислоты по реакции 2SO2 (г) + O2 (г) ↔2SO3 (г) + Q. Укажите, как будут влиять температура и давление на выход продукта реакции. ___________________________________________________________________________ ___________________________________________________________________________ [2] (b) Определите смещение химического равновесия и заполните таблицу.
[2] Схема выставления баллов
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||