Спецификация суммативного оценивания за четверть по предмету Химия 10 класс
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
Образец заданий и схема выставления баллов Задания суммативного оценивания за 4 четверть по предмету «Химия»Оксид алюминия реагирует с веществами: а) соляная кислота, б) оксид натрия, в) хлорид калия, г) гидроксид калия. A) а, б, в, г а, б, г а, г D) а [1] Назовите основную причину и последствия процесса эвтрофикации. Охарактеризуйте данный процесс. ___________________________________________________________________________ ___________________________________________________________________________ [3] Установите соответствие между исходными веществами и продуктами, которые образуются в ходе реакции.
[2] В таблице даны температуры плавления и кипения галогенов.
Объясните изменение температуры плавления и кипения галогенов в группе. ___________________________________________________________________________ ___________________________________________________________________________ [3] В таблице приведены утверждения, с которыми Вы можете согласиться или нет. Если Вы согласны с утверждением, то в правом столбце поставьте букву Т (True), если не согласны F (False).
[2] Таблица показывает взаимодействие растворов бинарных солей калия и элементов X1, X2, X3 и X4, расположенных в одной группе периодической таблицы, с растворами нитратов серебра и свинца.
Определите соли элементов KX1 - ____, KX2 - _____, KX3 - _____ и KX4 -_______. [2] Напишите уравнения взаимодействия солей элементов X1 и X4 с нитратом серебра. В уравнениях обязательно укажите вещество, выпадающее в осадок. ___________________________________________________________________________ ___________________________________________________________________________ [3] Выплавку чугуна из железной руды производят в доменных печах. Назовите основное сырьё, используемое для производства чугуна. Напишите сбалансированное уравнение химической реакции восстановления железа монооксидом углерода из его оксида Сырье _______________________________________ [1] Уравнение реакции ___________________________ [1]Рисунок показывает три стадии производства серной кислоты. 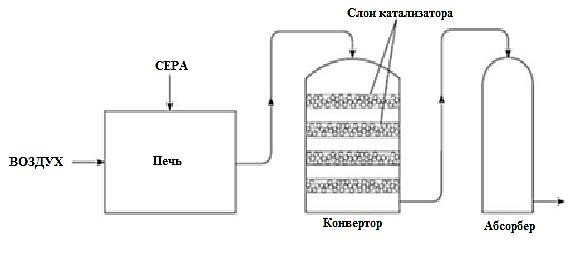 Опишите процесс, протекающий в конверторе. Укажите условия протекания данного процесса. _________________________________________________________________________ _________________________________________________________________________ [3] Водород необходим для получения аммиака в процессе Габера. Назовите сырье, из которого получают водород и азот. ___________________________________________________________________________ [2] Назовите условия (температуру, давление и катализатор), используемые в процессе Габера. ___________________________________________________________________________ [1] Перечислите три области применения аммиака. ___________________________________________________________________________ [2] Загрязнение окружающей среды отраслями промышленности остается наиболее острой экологической проблемой. (а) Объясните, в чём заключается негативное влияние получения негашёной извести из известняка на окружающую среду. ___________________________________________________________________________ [1] (b) Предложите способ устранения данного негативного влияния на окружающую среду. ___________________________________________________________________________ [1] (с) Приведите два примера воздействие отходов химического и металлургического производств на окружающую среду и способ устранения негативного влияния на окружающую среду. ___________________________________________________________________________ ___________________________________________________________________________ [2] Схема выставления баллов
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
