Фарш SBOR6-_novaya_red. Спектроскопические методы в анализе лекарственных средств
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
|
3.2. СПЕКТРОСКОПИЧЕСКИЕ МЕТОДЫ В АНАЛИЗЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ Спектроскопические методы анализа основаны на избирательном поглощении (абсорбции) электромагнитного излучения анализируемым веществом. В фармацевтическом анализе они используются для установления структуры, идентификации, оценки чистоты, количественного определения светопоглощающих веществ. Существующая в настоящее время аппаратура позволяет использовать для аналитических целей следующие диапазоны длин волн: ультрафиолетовый (190–380 нм), видимый (380–780 нм), инфракрасный (780–40000 нм или 0,78–400 мкм). В зависимости от используемой аппаратуры, регистрируемого физико-химического эффекта (поглощение или испускание электромагнитного излучения) и области спектра различаются следующие спектроскопические методы: ♦ спектрофотометрия в ультрафиолетовой (УФ) и видимой области; ♦ спектрофотометрия в инфракрасной (ИК) области; ♦ атомно-эмиссионная и атомно-адсорбционная спектроскопия (АЭС и ААС); ♦ флуориметрия; ♦ спектроскопия ядерного магнитного резонанса (ЯМР). Каждый из указанных методов имеет свои варианты использования в фармацевтическом анализе. В данном разделе будут рассмотрены варианты использования в фармацевтическом анализе методов спектрофотометрии в ультрафиолетовой (УФ) и видимой области, так называемые фотометрические методы. Фотометрические методы базируются на измерении собственного поглощения фармацевтических субстанций (ЛВ), обусловленного наличием в них хромофорных групп, или поглощения продуктов реакции фармацевтических субстанций с определенными реактивами, связанного с возникновением хромофорных групп в результате различных химических превращений. В группе фотометрических методов различаются: – спектрофотометрия (анализ по поглощению монохроматического излучения) в ультрафиолетовой (УФ) и видимой области; – колориметрия и фотоколориметрия (анализ по поглощению немонохроматического излучения) в видимой области. Поглощение света раствором того или иного ЛВ зависит от многих факторов: природы вещества, природы растворителя, концентрации вещества в растворе, длины волны падающего света. В то же время влияние всех этих факторов может быть упорядочено, сведено к ряду отдельных зависимостей и выражено определенной математической зависимостью: где I – интенсивность светового потока после прохождения через раствор; I0 – интенсивность падающего светового потока; l – толщина слоя, см; С – концентрация (% или моль/л); κ – показатель светопоглощения раствора при концентрации растворенного вещества, равной единице. Это соотношение известно как основой закон светопоглощения Бугера-Ламберта-Бера. Он лежит в основе большинства фотометрических методов анализа и формулируется следующим образом: "Интенсивность монохроматического светового потока, прошедшего через раствор, пропорциональна интенсивности падающего светового потока и зависит от концентрации окрашенного вещества и толщины слоя раствора". После преобразований и логарифмирования уравнение 3.19 выражается следующей математической зависимостью: где А – оптическая плотность раствора; l – толщина поглощающего слоя, см; С – концентрация раствора, % или моль/л. При соблюдении основного закона светопоглощения оптическая плотность раствора пропорциональна коэффициенту светопоглощения, концентрации поглощающего вещества и толщине слоя раствора. Отклонения от закона Бугера-Ламберта-Бера вызывают: • нелинейная зависимость показаний прибора от интенсивности светового потока; • немонохроматичность используемого светового потока; • непостоянство температуры в процессе измерений; • кислотно-основное взаимодействие, диссоциация, ассоциация, полимеризация, изменение рН среды с изменением концентрации определяемой фармацевтической субстанции и другие процессы, происходящие в анализируемой системе. Графически закон Бугера-Ламберта-Бера выражается прямой линией (рис.1, кривая 1), проходящей через начало координат при отсутствии светопоглощения растворителем и систематических ошибок. Графическая зависимость позволяет выявить пределы подчинения светопоглощения растворов исследуемых веществ закону Бугера-Ламберта-Бера. При несоблюдении закона прямолинейность нарушается на каком-либо участке или на всей прямой (рис. 1, кривые 2,3). 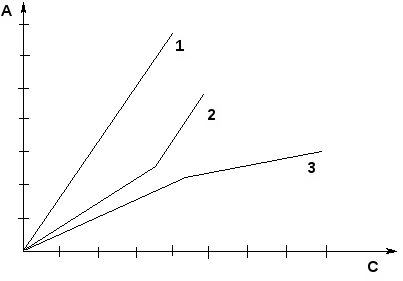 Рисунок 1 – Зависимость оптической плотности от концентрации раствора (градуировочный график) при соблюдении закона Бугера–Ламберта–Бера (1); при положительном (2) и отрицательном (3) отклонении от него Согласно данным литературы, относительная погрешность определения индивидуальных соединений методом спектрофотометрии не превышает 2%, фотоколориметрии – 3%. Более высокая точность спектрофотомерии по сравнению с фотоколориметрией обусловлена, в основном, монохроматичностью используемого электромагнитного излучения. Преобразования уравнения основного закона (3.19) позволяют вывести значение некоторых фотометрических величин. Отношение интенсивности светового потока, прошедшего через раствор, к интенсивности падающего светового потока называется пропусканием и обозначается Т (%): Величину Т, отнесенную к толщине слоя в 1 см, называют коэффициентом пропускания (1/Т). Логарифм величины, обратной пропусканию, называют погашением или оптической плотностью и обозначают буквой А (Аbsorbtion): где – коэффициент поглощения, физический смысл которого может быть выведен из уравнения: где – специфическая физическая константа для каждого индивидуального вещества при строго определенных условиях; используется для идентификации, оценки степени чистоты и количественного определения. Если концентрация исследуемого раствора (С) равна 1 М/л, а толщина поглощающего слоя (l) – 1 см, то: где – молярный коэффициент поглощения – оптическая плотность 1 молярного раствора, помещенного в кювету с толщиной слоя 1 см. Если концентрация исследуемого раствора (С) равна 1%, толщина поглощающего слоя (l) – 1 см, то: где Молярный и удельный показатели поглощения зависят от природы вещества, природы растворителя, длины волны проходящего света, температуры раствора. Удельный и молярный показатели поглощения определяют экспериментально. Оптическая плотность раствора зависит, наряду с указанными выше факторами, от концентрации раствора и толщины слоя растворенного вещества (толщины кюветы). Согласно указаниям ГФ оптическую плотность растворов следует измерять при температуре (20±1)0С. ПРИМЕР: Рассчитайте значение удельного показателя поглощения фурадонина (нитрофурантоина), если 0,1000 г субстанции растворили в 2,5 мл 1 М раствора натрия гидроксида в мерной колбе вместимостью 100 мл, довели водой до метки, перемешали (стандартный раствор). Из полученного раствора приготовили серию стандартных разведений: в мерную колбу вместимостью 100 мл вносили последовательно 0,6 мл стандартного раствора, доводили водой до метки, перемешивали. Оптические плотности (Аi) полученных растворов, измеренные на спектрофотометре (фотоколориметре) относительно воды при длине волны 445 нм в кювете с толщиной слоя 1,0 см, составили: 0,280; 0,276; 0,284; 0,282; 0,280; 0,278. РЕШЕНИЕ: Предварительно рассчитывают концентрацию (С,%) стандартного разведения. Для этого пользуются схемой приготовления стандартного разведения: 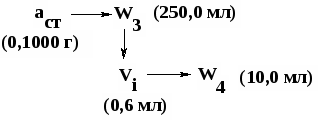 Удельный показатель поглощения рассчитывают по формуле 3.24. Значения удельного показателя поглощения для каждого стандартного разведения приведены в таблице 3.3. Таблица 3.3 - Значения удельного показателя поглощения фурадонина
ОТВЕТ: Удельный показатель поглощения фурадонина (нитрофурантоина) равен 466,7. Вещество поглощает электромагнитное излучение избирательно. Зависимость оптической плотности раствора или значений показателя поглощения (молярного или удельного) растворенного вещества от длины волны называют спектром поглощения (рис. 2). 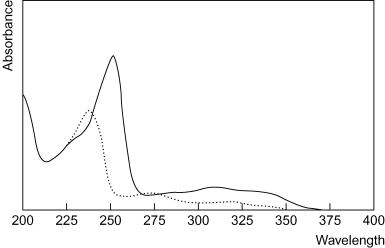 Рисунок 2 – Спектры поглощения 0,001% раствора папаверина гидрохлорида в 0,1М растворе хлористоводородной кислоты (сплошная линия) и 0,1М растворе гидроксида натрия (пунктирная линия) Спектр поглощения характеризуется областями экстремального поглощения (максимумы) при определенных длинах волн. Спектры поглощения применяют для идентификации, оценки чистоты (содержание примесей) и количественного анализа (выбор аналитических длин волн) лекарственных средств. Идентификацию (установление подлинности) фармацевтических субстанций индивидуально и в однокомпонентных лекарственных формах согласно российской и международным НД (ГФ, МФ, ФС, ФСП) осуществляют: ♦ путем сравнения спектров поглощения испытуемого и стандартного (ГСО) образцов, полученных в одних и тех же условиях (фуразолидон и др.); ♦ по известным параметрам спектров поглощения: – по положению максимумов при определенных длинах волн: анальгин (метамизол-натрия), аскорбиновая кислота, ацетилсалициловая кислота, гидрокортизона ацетат, кодеин, кофеин, парацетамол и др. Положение максимума поглощения анализируемой фармацевтической субстанции может отличаться от указанного в частной ФС на ± 2 нм. Этот способ идентификации наиболее прост, но недостаточно достоверен, поэтому применяется в качестве дополнительного критерия; – по положению максимумов и минимумов при определенных длинах волн: ацетилсалициловая кислота, верапамила гидрохлорид, димедрол (дифенгидрамина гидрохлорид), дротаверина гидрохлорид, изониазид, карбамазепин, левомицетин (хлорамфеникол), метилурацил, метронидазол и др.; – по положению максимумов, минимумов, плеч и точек перегиба при определенных длинах волн: клонидина гидрохлорид (клофелин), нитразепам, фенпивериния бромид и др.; – по положению максимумов и минимумов на дифференциальных спектрах поглощения, полученных измерением спектров кислотных растворов относительно щелочных и наоборот: сульфадиметоксин и др.; – по положению максимумов и минимумов и величине оптических плотностей в максимумах: тетрациклина гидрохлорид, окситетрациклина дигидрат, резерпин и др.. Этот способ идентификации надежнее предыдущих; – по положению максимумов при определенных длинах волн и отношению оптических плотностей в указанных максимумах: атенолол и др.; – по величине удельного показателя поглощения в максимуме поглощения: бензилпенициллина натриевая, калиевая, новокаиновая соль и др.. Применяется наиболее часто; – по величине отношения оптических плотностей при двух или более длинах волн: фолиевая кислота, метициллина натриевая соль, натрия пара-аминосалицилат и др.; – по разности оптических плотностей при двух длинах волн: феноксиметилпенициллин, бензилпенициллина натриевая соль и др.; – по отсутствию в определенной области спектра выраженных максимумов поглощения: пирацетам. При установлении подлинности (качественный анализ) некоторых фармацевтических субстанций перечисленные способы применяют в разных комбинациях. Эти же характеристики позволяют оценивать чистоту фармацевтических субстанций, т.к. при наличии примесей на спектре поглощения основного вещества могут смещаться или появляться дополнительные максимумы, перегибы, плечи, увеличиваться или уменьшаться значения удельного или молярного показателей поглощения и т.д. Чистоту (наличие поглощающих примесей) ряда фармацевтических субстанций определяют по величине отношения оптических плотностей в максимумах поглощения при двух или более длинах волн (атенолол, цианокобаламин, ретинола ацетат, рутин и др.). Методом спектрофотометрии в фармацевтическом анализе устанавливают подлинность фармацевтических субстанций индивидуально и в лекарственных формах, степень чистоты и количественное содержание, методом фотоколориметрии – количественное содержание. Количественное содержание фармацевтических субстанций при анализе методами спектрофотометрии и фотоколориметрии рассчитывают разными способами в зависимости от состава анализируемого объекта (индивидуально или в лекарственных формах: одно-, двух-, многокомпонентных). 3.2.1. Количественное определение фармацевтических субстанций индивидуально и в однокомпонентных лекарственных формах Для количественного определения фармацевтических субстанций индивидуально и в однокомпонентных лекарственных формах используют следующие способы расчета: ♦ по градуировочному (калибровочному) графику; ♦ по значению удельного или молярного показателя поглощения; ♦ по оптической плотности стандартного образца. 3.2.1.1. Расчет количественного содержания фармацевтической субстанции по градуировочному (калибровочному) графику Способ расчета основан на сравнении оптической плотности раствора анализируемого вещества с оптической плотностью раствора стандартного образца (СО) на градуировочном (калибровочном) графике. Градуировочный (калибровочный) график отражает зависимость оптической плотности раствора стандартного образца анализируемого вещества от его концентрации. Стандартные образцы (СО) – это вещества, применяемые для сравнения физико-химических характеристик испытуемых ЛС при проведении анализа согласно соответствующей спецификации (ФС, ФСП, ГФ, НД). Для построения градуировочных графиков в качестве стандартного образца используют государственные стандартные образцы (ГСО) или рабочие стандартные образцы (РСО). ГСО представляет собой фармацевтическую субстанцию (первичный стандарт), соответствующую требованиям ФС на указанный ГСО. Согласно НД (ГФ, ФС, ФСП) ГСО используют в анализе фармацевтических субстанций физико-химическими и биологическими методами РСО представляет собой фармацевтическую субстанцию, откалиброванную путем сравнения со вторичным стандартном (ФС или ФСП на субстанцию). В качестве РСО для анализа дозированных лекарственных форм разрешается использовать образец серийной субстанции, отвечающий требованиям НД (ГФ, ФС, ФСП). Для построения градуировочного (калибровочного) графика готовят стандартный раствор. Для этого отвешивают на аналитических весах точную навеску фармацевтической субстанции (ГСО или РСО) (а, г), вносят в мерную колбу вместимостью W, мл, растворяют, доводят растворителем до метки содержимое колбы, перемешивают (раствор А). Для приготовления разведений отмеривают калиброванной пипеткой определенные объемы (V, мл) раствора А, вносят в мерную колбу вместимостью Wi, мл, доводят объем мерных колб до метки растворителем, перемешивают (серия растворов В). Измеряют оптическую плотность полученных растворов серии В относительно растворителя на спектрофотометре (фотоэлектроколориметре) при аналитической длине волны, указанной в НД, в кюветах с оптимальной толщиной слоя. Полученные значения оптической плотности используют для построения градуировочного (калибровочного) графика. Раствор анализируемого вещества готовят так, чтобы его оптическая плотность находилась в интервале 0,2–0,8 (оптимальное значение, позволяющее с наибольшей точностью измерить светопоглощение). Измеряют в тех же условиях оптическую плотность (Ах) анализируемого раствора. По калибровочному графику определяют содержание действующего вещества в анализируемом растворе, а затем пересчитывают его на исходный образец, учитывая схему разведения (g). |
