лекция 02.11.2021 г. Степень превращения
 Скачать 140.5 Kb. Скачать 140.5 Kb.
|
|
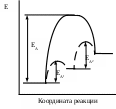
До настоящего времени не существует частной теории объяснения кинетики топохимических реакций. Рассмотрим подход, учитывающий рост размеров ядер с учетом перекрывания, однако, число ядер считает постоянным. Степень превращения где КРР – константа радиального роста ядер. nt – число ядер в момент времени t. Согласно данному подходу число ядер в момент времени t, будет рано числу ядер в момент времени nt=n0. Продифференцируем данное уравнение по времени, т.е. определим скорость топохимической реакции. Т.к. поверхность раздела не вся покрыта ядрами, а только ее часть, то необходимо учесть долю свободной поверхности (1-α). Проинтегрируем уравнение или Если учитывать перекрывание ядер по степенному или экспоненциальному закону, о показатель степени при времени увеличивается, т.е. в общем виде где b 3. Катализ Катализ имеет огромное значение в природе и современной жизни: каталитическими являются практически все биохимические процессы, большинство реакций, изучаемых в лаборатории, и технологических процессов, реализуемых в промышленности. Примерами каталитических процессов: глубокая переработка нефти с помощью крекинга, гидроочистки, гидрокрекинга и риформинга; синтез и окисление аммиака; производство метанола и винилхлорида; гидролиз сложных эфиров, гидрирование олефинов и т.д. Катализ является промежуточным звеном между теоретическими положениями в химии и практическим осуществлением большинства химических процессов. Катализом (от греч. «katalysis» – разрушение) называется инициирование химических реакция или изменение их скорости под влиянием веществ (катализаторов), многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих после каждого цикла промежуточного взаимодействия свой химический состав. Катализатор не находится в стехиометрическом отношении с продуктами реакции. В большинстве случаев количество катализатора много меньше количества реагентов. Например, 1 г платинового катализатора вызывает превращение 104 г SO2 при окислении в SO3 или 106 г NH3 при окислении в NO. Различают положительный катализ, когда катализатор ускоряет реакцию, и отрицательный катализ, когда катализатор замедляет реакцию. В большинстве случаев под термином «катализ» понимают положительный катализ. Отрицательные катализаторы называют также антикатализаторами или ингибиторами. Явление ускорения реакции при воздействии продукта реакции или одного из промежуточных веществ называют автокатализом. Различают гомогенный и гетерогенный катализ. При гомогенном катализе реагирующие вещества и катализатор находятся в одной фазе. В этом случае катализатор равномерно распределен по реакционному объему в атомно- или мономолекулярно-дисперсном состоянии. К процессам гомогенного катализа относят реакции гидратации, гидролиза, этерификации, реакция алкилирования бензола (катализатор – хлорид алюминия), конденсации и другие, а также жидкофазное окисление углеводородов в присутствии солей кобальта, марганца, железа, меди и др. К гомогенному катализу относится кислотно-основный и ферментативный катализ. Если катализатор и реагирующие вещества находятся в разных фазах, между которыми имеется граница раздела, катализ называется гетерогенным. Гетерогенно-каталитические процессы в промышленности используются шире, чем гомогенно-каталитические. Примерами гетерогенного катализа является реакция дегидрирования этана на платиновом катализаторе, синтез и окисление аммиака, крекинг, риформинг нефти и многие другие. Промоторами, или активаторами, называют вещества, добавление которых к катализатору увеличивает его активность, селективность, устойчивость. Большинство промышленных катализаторов являются промотированными. Например, железный катализатор синтеза аммиака содержит в качестве промоторов Al2O3, K2O, иногда также CaO. Функции этих промоторов различны: Al2O3 - структурообразующая добавка, увеличивающая удельную поверхность железа и препятствующая спеканию кристаллов железа; K2O – активирующая добавка, повышающая активность каталитических центров железа или создающая новые активные центры. Каталитические яды – это вещества воздействие которых на катализатор приводит к уменьшению его активности или к полному подавлению каталитического действия. Каталитическими ядами во многих реакциях на металлических катализаторах является кислород и его соединения (вода, СО и др.), а в синтезе аммиака – соединения серы. В реакциях органических соединений на твердых катализаторах их активность нередко снижается за счет образования на поверхности углеродистой пленки – кокса. Регенерация катализатора осуществляется периодической обработкой поверхности кислородом или выжиганием кокса. В гетерогенном катализе широко используют катализаторы на носителях. Носитель – это инертные вещества, нанесение на которых катализатора значительно повышает его активность. В простейшем случае действие носителя заключается в увеличении поверхности катализатора и в предохранении его от спекания. В качестве носителей применяют тела с высокоразвитой поверхностью – угла, SiO2, Al2O3, алюмосиликаты, природные глины, пемза и др. Особенности действия катализатора Каталитические реакции чувствительны к количеству катализатора. Для заметного каталитического действия достаточно очень малого количества катализатора. Скорость всех каталитических реакций зависит от количества катализатора, а именно, в гомогенных реакциях скорость химической реакции пропорциональна концентрации катализатора, а в гетерогенных – величине поверхности катализатора. Катализатор – это вещество, обладающее селективным действием по отношению к химическим реакциям. Его селективность заключается в том, что он способен оказывать влияние на одну из нескольких термодинамически возможных реакций. Например: 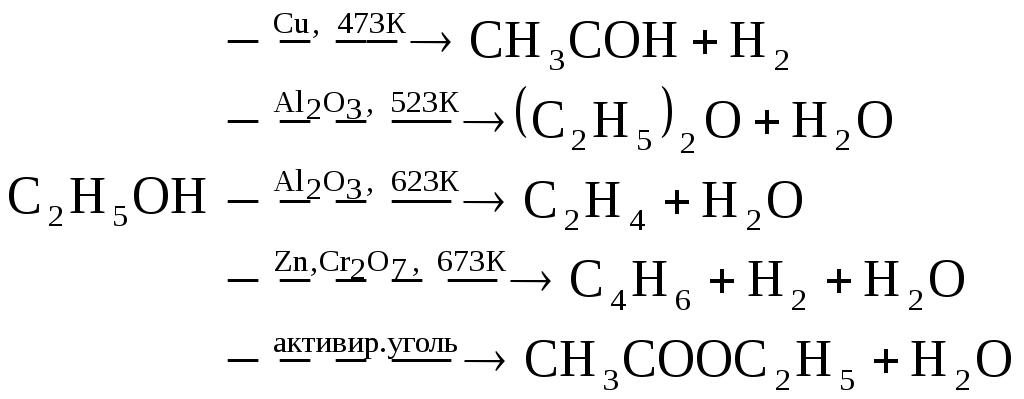 Катализатор не влияет на константу равновесия, а следовательно на влияет на равновесный выход продукта реакции. Это можно обосновать, если рассмотреть протекание реакции с катализатором и без катализатора. Все каталитические процессы в термодинамическом отношении – самопроизвольные процессы, т.е. сопровождаются уменьшением энергии Гиббса. Изменение энергии Гиббса в обоих случаях одинаково, так как эта величина является функцией состояния, т.е. зависит от начального и конечного состояния системы и не зависит от пути перехода. Согласно уравнению изотермы Вант-Гоффа На практике для прямой и обратной реакций часто применяют разные катализаторы. Так, каталитическое дегидрирование циклогексана и обратная ему гидрирование бензола С6Н12 С6Н6 + 3Н2 Протекают с близкими скоростями при 2500С на платиновом катализатор. Поэтому гидрирование бензола проводят при более низких температурах 100-2000С и на никелевом катализаторе, а дегидрирование – при более высокой температуре 350-4000С и на катализаторе Cr2O3, т.е. в условиях, когда можно обеспечить полное превращение. Механизм катализа Влияние катализатора на скорость химической реакции объясняется участием катализатора в образовании активированного комплекса. Как в гомогенном, так и в гетерогенном катализе роль катализатора сводится к образованию промежуточного соединения. Основное влияние на скорость химической реакции катализатор оказывает путем изменения энергии активации. Механизм протекания реакции без катализатора: Механизм протекания реакции с катализатором:
Введение в систему катализатора приводит не только к снижению энергии активации, но и к переориентации молекул в момент столкновения. Прогнозирование каталитического действия Важное значение для химической промышленности предвидение каталитического действия. Предсказать активность действия катализатора можно на основании оценки термодинамических функций образования активированных комплексов всех стадий каталитического процесса и на основании сведений о структуре реагирующих веществ и катализатора. Однако данный подход не позволяет получить хороших результатов, т.к. расчет всех величин и учет ряда параметров является сложной задачей. На практике широкое распространение получили соотношения Бренстеда-Поляни, которые показывают связь между изменением энергии активации и теплотой химических превращений в пределах ограниченных групп реакций или катализаторов. Соотношения Бренстеда –Поляни также известны, как соотношения линейности: где Строго теоретического обоснования соотношениям линейности до сих пор не существует. Однако широкий экспериментальный материал показывает справедливость их применения для отдельных групп реакций. Кинетика гомогенно-каталитических реакций Рассмотрим реакцию: Будем считать, что в присутствии катализатора реакция протекает по следующему механизму: 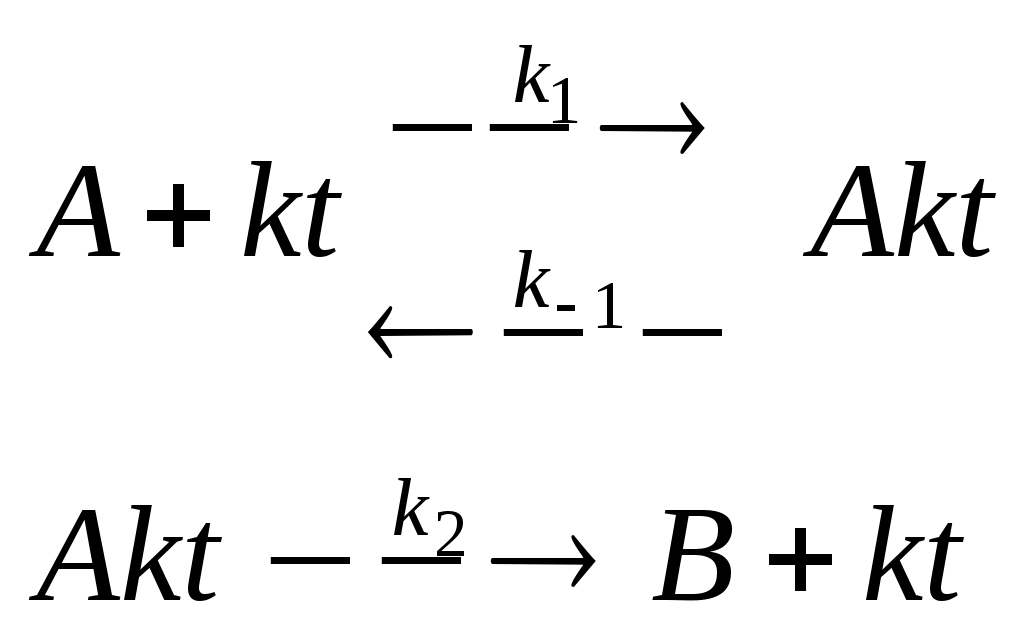 (3) (3)Скорость реакции определяется по второй реакции: Согласно методу квазистационарных концентраций: тогда Полученное уравнение позволяет рассчитать скорость гомогенно-каталитической реакции. Гетерогенный катализ При гетерогенном катализе катализатор представляет собой твердое веществ, а реагирующие вещества могут находится в газовой или жидкой фазе. Действие катализатора зависит от его физического состояния, присутствия посторонних веществ. Если вещества повышают активность катализатора, то они называются промоторами, если уменьшают, то каталитическими ядами. Так как при гетерогенном катализе скорость процесса пропорциональна величине площади катализатора, то необходимо иметь большую поверхность катализатора, т.е. катализатор при гетерогенном катализе должен обладать высокой пористостью и шероховатостью. Часто это достигается путем нанесения катализатора на подходящий носитель из инертного материала (уголь, силикагель). При этом достигается экономия катализатора, увеличивается его устойчивость к отравлению ядами. Гетерогенный катализ протекает через 5 стадий: подвод реагирующих веществ к поверхности катализатора, адсорбция реагирующих веществ на поверхности катализатора, химическая реакция на поверхности катализатора, десорбция продуктов реакции с поверхности катализатора, отвод продуктов реакции в объем фазы. В зависимости от условий проведения процесса и его особенностей наиболее медленной (лимитирующей) может быть любая из пяти стадий процесса. Если лимитирующей является первая или пятая стадии, то скорость процесса определяется на основании законов Фика. Если лимитирующей является третья стадия, то используют кинетические уравнения различных порядков. Если лимитирующей является 2 или 4 стадии, то для описания гетерогенного процесса используют уравнения моно- или полимолекулярных адсорбций. Формальным аналогом закона действующих масс в кинетике гетерогенно-каталитических реакций является закон действующих поверхностей. Этот теомин был предложен И. Ленгмюром в 1918 г. применительно к реакциям частиц на поверхности твердого тела, состоящей из определенного числа расположенных адсорбционных центров, каждый их которых удерживает в адсорбированном состоянии одну частицу. Каталитическая реакция протекает за счет превращения этой молекулы на данном центре или за счет взаимодействия с другой молекулой на соседнем центре. При этом частицы, адсорбированные на соседних центрах не взаимодействуют друг с другом. В общем случае в реакции участвуют как адсорбированные молекулы А, В и т.д., так и свободные центры Z Тогда скорость каталитической реакции можно записать где z – общее число адсорбированных молекул на единице поверхности; А, В – доля центров, заполненных адсорбированными веществами А и В, z – доля свободных центров. Ограничение на применение закона действующих поверхностей: адсорбционный слой не является идеальным и предположение о равноценности, статистическом беспорядке всех центров не подтверждается экспериментами; заполнения () экспериментально измерить трудно, лишь в последнее время появились спектральные методы определения числа адсорбированных молекул; в реальных реакциях на поверхности, кроме заполненной поверхности и концентрации свободных центров в уравнение часто входят также парциальные давления компонентов, когда молекула реагирует в газовой фазе. Механизм гетерогенного процесса несколько отличается от механизма гомогенного процесса, прежде всего тем, что включает стадию адсорбции. Адсорбцию разделяют на физическую и хемосорбцию Физическая адсорбция обратима, т.е. при изменении условий изменяется количество адсорбата на поверхности катализатора. Хемосорбция – необратима, она сопровождается химической реакцией с образованием продуктов реакции. Если все места на поверхности катализатора энергетически равноценны, то на одном активном центре адсорбируется одна молекула и взаимодействие между молекулами отсутствует. Такая адсорбция является мономолекулярной и описывается уравнением изотермы Ленгмюра. Если давление газа, который адсорбируется Р, то степень заполнения поверхности определяется отношением числа занятых мест к общему количеству мест на которые возможна адсорбция. где b – константа адсорбционного равновесия, k1 и k-1 – константы адсорбции и десорбции, соответственно. Если места на поверхности катализатора энергетически не равноценны, но используют уравнения БЭТ, Фрумкина, Фрейндлиха и т.п. Кинетика гетерогенно-каталитических реакций Так как реакция гетерогенная, то перенос реагирующих веществ осуществляется диффузией. Кроме внешней диффузии, которая доставляет реагирующие вещества к поверхности катализатора, протекает и внутренняя диффузия в порах катализатора. Обязательной стадией гетерогенно-каталитических реакций является адсорбция. Адсорбироваться может одно из реагирующих веществ, а молекулы адсорбированного вещества сталкиваются с исходным веществом, доставляемым из объема фазы (ударный механизм Ридила). В другом случае в начале адсорбируются молекулы обоих веществ на поверхности катализатора, которые затем диффундируют по поверхности катализатора (механизм Хиншельвуда-Ленгмюра). В качестве примера рассмотрим газовую гетерогенно-каталитическую реакцию. Будем считать, что подвод исходных веществ к поверхности катализатора и отвод продуктов реакции не лимитируют процесс. Реакция на поверхности раздела имеет первый порядок, адсорбция физическая и описывается изотермой Ленгмюра. Давление реагирующего газа Р. Скорость такой гетерогенной реакции будет пропорциональна степени заполнения поверхности где k – константа скорости. Можно выделить две области гетерогенно-каталитической реакции: Область Генри, имеет место при слабой адсорбции и невысоком давлении газа. В данном случае порядок реакции равен 1. Область насыщения. Сильная адсорбция и высокое давление газа. Порядок реакции равен 0. Таким образом, для гетерогенно-каталитической реакции порядок находится в пределе от 0 до 1. Теории гетерогенного катализа 1. Мультиплетная теория А.А. Баландина Согласно данной теории предполагается, что в образовании поверхностного соединения (мультиплетного комплекса) участвуют группы отдельных атомов поверхности – мультиплеты (дуплеты, триплеты, квадруплеты и т.п.), обладающие определенными и энергетическими свойствами. Мультиплетом называется небольшое число атомов на поверхности катализатора сохраняющих кристаллическую решетку твердого катализатора. В мультиплетной теории рассматриваются принципы геометрического и энергетического соответствия. Принцип геометрического соответствия утверждает, что твердое вещество может быть гетерогенным катализатором, если расстояние между атомами в мультиплетном комплексе больше расстояния между атомами в исходной молекуле и при образовании мультиплетного комплекса не происходило изменение валентных углов. Например, реакция гидрирования этилена на никелевом катализаторе При образовании мультиплетного комплекса двойная связь в молекуле этилена переходит в одинарную и свободными валентностями оба атома углерода присоединяются к двум атомам дуплета на поверхности никеля 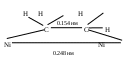 Углы между гибридными связями 1200, длина связи С-С 0,154 нм. Поверхность никеля удовлетворяет этому условию. На основе принципа геометрического соответствия рассматривается например вопрос о подборе катализатора для реакции дегидрирования циклогексана. Из принципа геометрического соответствия следует, что мультиплет для катализа этой реакции должен быть секстетом, т.е катализаторами могут являться – никель, кобальт, цинк, платина, палладий и др. Принцип энергетического соответствия утверждает, что кроме геометрического соответствия должно также быть определенное соответствие между энергией связи и в молекулах реагирующих веществ и в мультиплетном комплексе, чтобы твердое тело могло быть катализатором. Энергетические уровни мультиплетного комплекса должны быть расположены примерно посередине между энергетическими уровнями исходных молекул и продуктов реакции, а энергии активации его образования и распада должны быть минимальными. Мультиплетная теория неприменима к окислительно-восстановительным реакциям с участием простых молекул, так как процессы получения и отдачи электрона могут происходить в различных пространственных участках. 2.Теория активных ансамблей Н.И. Кобозева Теория Н.И. Кобозева применима к катализаторам на носителях. В данной теории предполагается, что активными центрами служат атомы, беспорядочно расположенные на поверхности кристаллического тела. Теория применима, если на поверхности находится небольшое число атомов металла (меньше 1 % от того количества, которое требуется для заполнения поверхности мономолекулярным монослоем). Согласно современным взглядам твердое кристаллическое тело (носитель) состоит из большого числа макроскопических участков – блоков или областей миграции, разделенных геометрическими или энергетическими барьерами. При нанесении на носитель небольшого числа атомов металла на каждую область миграции попадает несколько атомов металла. Под действием теплового движения атомы металла могут перемещаться внутри областей миграции, но переход из одной области миграции в другую затруднен наличием между ними геометрических и энергетических барьеров. Несколько атомов металла – катализатора внутри области называются ансамблем. В разных областях миграции может находится разное число атомов металла. Каталитическое действие проявляют только ансамбли с определенным числом атомов металла внутри области миграции. Такие ансамбли называются активными. Число атомов в активном ансамбле можно определить по зависимость активности катализатора от среднего числа атомов металла в одной области. Данная зависимость проходит через максимум, причем точка соответствующая максимальной активности по оси абсцисс соответствует числу атомов металла в активном ансамбле. |