Методички педфака на весенний семестр 2014. Структура и свойства белков. Методы выделения и очистки белков. Нарушения белкового состава сыворотки крови
 Скачать 1.9 Mb. Скачать 1.9 Mb.
|
|
Тема Общие пути катаболизма аминокислот. Специфические пути обмена некоторых аминокислот. Обезвреживание и выведение из организма аммиака. Цели занятия: Сформировать знание обобщих путях катаболизма аминокислот, декарбоксилировании аминокислот, ферментах, кофакторах, продуктах, биогенных аминах, их обезвреживании, механизме прямого окислительного дезаминирования глутаминовой кислоты (ГДГ), механизме опосредованного дезаминирования аминокислот, трансаминировании , диагностическом значении определения активности трансаминаз, о специфических путях обмена фенилаланина, тирозина и метионина и навыки по определению содержания мочевины и трактованию полученных результатов. Хронометраж практического занятия: 1. Вводная беседа. Тестирование исходного уровня знаний— 15 мин. 2. Практическая часть Собеседование по теме занятия – 45 мин Просмотр и обсуждение видеофрагмента и анимации- мин Разбор конкретной ситуации (ситуационных задач) – 45 мин 3. Контроль усвоения темы — 20 мин. 4. Подведение итогов и задание к следующему занятию — 10 мин. Продолжительность занятия — 4 часа (180 мин) Методическое и материально-техническое оснащение (таблицы, химическая посуда, биологический материал, видеофрагменты, анимации) Содержание темы: Общие пути катаболизма аминокислот. Декарбоксилирование аминокислот. Ферменты. Кофакторы. Продукты. Биогенные амины. Токсические амины. Обезвреживание. Дезаминирование. Механизм прямого окислительного дезаминирования глутаминовой кислоты (ГДГ). Механизм опосредованного дезаминирования аминокислот. Трансаминирование с α-кетоглутаровой кислотой как первый этап опосредованного дезаминирования аминокислот. Анаболическое значение процесса трансаминирования. Субстраты. Ферменты. Кофакторы. Продукты. Специфические пути обмена фенилаланина, тирозина и метионина. Метаболические нарушения. Нарушение биосинтеза мочевины. Гипераммониемия. Врожденные ферментные нарушения цикла мочевинообразования (цитрулинемия и аргининемия). Базисные знания: Из курса биорганической химии - химическое строение глутаминовой аминокислоты, фенилаланина, тирозина, образование амида глутаминовой кислоты. Студент должен уметь: Провести исследование по определению количества мочевины и трактовать полученные результаты. Учебная карта занятия: Вводная беседа Ознакомить студентов с общими путями катаболизма аминокислот, специфическими путями обмена некоторых аминокислот, остановиться на обезвреживании и выведении из организма аммиака, познакомить с методом определения мочевины . Тесты исходного уровня знаний 1.В КАКОМ ОРГАНЕ ПРОИСХОДИТ СИНТЕЗ МОЧЕВИНЫ? 1. Печень; 2. Почки; 3. Легкие; 4. Надпочечники; Ответ:1 2.КАКОЙ МЕТАБОЛИТ ПРИНИМАЕТ УЧАСТИЕ В ПРЕВРАЩЕНИЯХ СОЕДИНЕНИЙ В ОРНИТИНОВОМ ЦИКЛЕ КРЕБСА? 1. Цитрат; 2. Изоцитрат; 3. Сукцинат; 4. Цитруллин; Ответ: 4 3.В ПРОЦЕССЕ ТРАНСАМИНИРОВАНИЯ ПРОИСХОДИТ: 1.Синтез неааменимых аминокислот; 2.Синтез заменимых аминокислот; 3.Выделение свободного аммиака; 4.Синтез мочевины Ответ: 2. 4.ВЫБЕРИТЕ ПРАВИЛЬНЫЕ ОТВЕТЫ: ПОВЫШЕННОЕ СОДЕРЖАНИЕ МОЧЕВИНЫ В СЫВОРОТКЕ КРОВИ МОЖЕТ БЫТЬ 1.при поражении печени; 2.при усиленном распаде тканевых белков; 3.при значительных поступлениях белков с пищей; 4.при нарушении фильтрационной способности почек Ответ:2, 3, 4 5.СОДЕРЖАНИЕ МОЧЕВИНЫ В СЫВОРОТКЕ КРОВИ В НОРМЕ СОСТАВЛЯЕТ: 1.2,5 - 8,3 ммоль/л 2.3,3 - 5,5 ммоль/л; 3.1,2 – 2,5 ммоль/л 4.8,4 – 12,3 ммоль/л Ответ: 1 6.ПРИ ЦИРРОЗАХ ПЕЧЕНИ, ПОРАЖЕНИИ ГЕПАТОЦИТОВ ЧАСТО НАБЛЮДАЕТСЯ НАРУШЕНИЕ ФУНКЦИИ ЦНС. НАКОПЛЕНИЕ КАКОГО МЕТАБОЛИТА В НЕРВНОЙ ТКАНИ МОЖЕТ БЫТЬ ПРИЧИНОЙ ТАКИХ РАССТРОЙСТВ? 1.мочевая кислота; 2.креатин; 3.аммиак Ответ:3 7.ВЫБЕРИТЕ ПРАВИЛЬНЫЕ ОТВЕТЫ. АМИНОТРАНСФЕРАЗЫ: 1.локализованы в цитозоле и митохондриях клеток; 2.взаимодействуют с двумя субстратами; 3.используют АТФ как источник энергии; 4.используют пиридоксальфосфат в качестве кофермента Ответ:1, 2, 4 8. ВЫБЕРИТЕ ПРАВИЛЬНЫЕ ОТВЕТЫ. ДЛЯ НЕПРЯМОГО ДЕЗАМИНИРОВАНИЯ НЕОБХОДИМЫ ВИТАМИНЫ: 1.В1; 2.В6; 3.РР; 4.С Ответ: 2, 3 Теоретическая часть. Вопросы для собеседования 1.Общие пути катаболизма аминокислот. Катаболические превращения аминокислот по α-NH2 группе, по α-СООН группе и по углеродному «скелету». 2.Декарбоксилирование аминокислот. Ферменты. Кофакторы. Продукты. 3.Биогенные амины. Токсические амины. Обезвреживание. 4.Трансаминирование (переаминирование). Химизм процесса, характеристика трансаминаз, роль витамина В6 в трансаминировании. 5.Биологическое значение реакций трансаминирования. Коллекторная функция α- кетоглутарата в процессе трансаминирования. 6.Дезаминирование аминокислот. Виды дезаминирования. Окислительное (прямое)дезаминирование глутамата. Химизм и значение процесса, характеристика фермента. 7.Трансдезаминирование аминокислот (непрямое дезаминирование). Схема процесса. Роль a-кетоглутарата, глутамата в этом процессе. Биологическое значение трансдезаминирования. 8.Судьба безазотистого остатка аминокислот (a-кетокислот). Гликогенные и кетогенные аминокислоты. Связь обмена аминокислот с ЦТК. 9.Источники и основные пути образования аммиака. 10.Токсичность и пути обезвреживания NH3: а) восстановительное аминирование a-кетоглутарата; б) образование амидов (глутамина, аспарагина) и аланина — транспортных форм аммиака; в) образование солей аммония (аммонигенез в почках); роль глутамина(аспарагина) в образовании солей аммония в почках и поддержании кислотно-основного состояния в организме; г) биосинтез мочевины. Цикл Кребса-Хензелайта (орнитиновый цикл). Химизм процесса, роль аспартата в этом процессе. 11.Нарушение биосинтеза мочевины. Гипераммониемия. Врожденные ферментные нарушения цикла мочевинообразования (цитрулинемия и аргининемия). 12.Специфические пути обмена фенилаланина, тирозина и метионина. Ситуационные задачи Задача №1 После введения мышам аминокислоты СЕРИНА, содержащей меченый атом (N15) в α-положении, обнаружили, что метка быстро появляется в α-аминогруппе других аминокислот печени. Объясните, почему это происходит, аргументируя ответ соответствующей схемой. Задача №2. У детей часто вирус гриппа нарушает синтез фермента карбомаилфосфатсинтетазы. При этом возникает рвота, головокружение, судороги, возможна потеря сознания. Укажите причину наблюдаемых симптомов. Для этого: а) Напишите схему орнитинового цикла. б) Укажите, концентрация какого вещества повышается в крови больного. в) Объясните механизм его токсического действия на нервную систему. г) Объясните, какую диету можно рекомендовать при данном нарушении. Задача №3. У больного с характерными признаками токсического отравления центральной нервной системы (рвота, головокружение, недомогание, потеря сознания ) выявлено в моче до 3 г в сутки аргининосукцината ( в норме он отсутствует). Укажите возможную причину этого заболевания. Для этого: а) Напишите схему орнитинового цикла. б) На схеме укажите место ферментного блока. в) Перечислите вещества, содержание которых повышено в крови у данного больного. Задача №4. У ребенка с характерными признаками отравления центральной нервной системой (повторяющаяся рвота, потеря сознания) в крови обнаружена высокая концентрация цитруллина. Каковы причины данных симптомов? а) Ответ проиллюстрируйте схемой нарушенного процесса, указав место ферментного блока. б) Объясните механизмы развития перечисленных симптомов. в) Почему состояние больного улучшается при назначении малобелковой диеты. Задача №5. При биохимическом исследовании крови и мочи больного обнаружили, что концентрация мочевины в моче составляет 15г в сутки ( в норме 30 г в сутки), в крови больного мочевины 2,0 мМ/л ( в норме 3,3-6,6 мМ/л). Объясните причину указанной патологии. Ответ проиллюстрируйте схемой метаболического пути, который нарушен в данном случае. Задача №6. После введения голодающим крысам глутамата концентрация глюкозы в крови животных увеличилась. Как можно объяснить это? Ответ поясните. Для этого: а) Напишите схему использования безазотистых остатков аминокислот при снижении уровня глюкозы в крови. б) Проследите схематично судьбу азотистого остатка глутаминовой кислоты. Задача №7. У новорожденного ребенка наблюдается потемнение мочи при контакте с воздухом. Вспомнив энзимопатии обмена аминокислот, объясните, накоплением какого продукта обусловлен этот симптом. Обмен какой аминокислоты нарушен при данном заболевании? Назовите это заболевание, напишите схему соответствующего процесса. Задача №8. У пациента отсутствуют механизмы защиты от ультрафиолетовых лучей, он быстро получает солнечные ожоги, загар - не появляется. Какое это заболевание? Укажите его причины. Для этого: а) Назовите синтез какого вещества нарушен в организме этих людей. б) Напишите схему его образования в норме. в) Назовите фермент, дефект которого вызывает перечисленные симптомы. Задача №9. При дефиците витамина В6 у грудных детей, находившихся на искусственном вскармливании, описаны поражения нервной системы. Объясните биохимические механизмы развития патологии, вспомнив роль этого витамина в обмене нейромедиаторов и аминокислот. Для этого: а) перечислите основные предшественники медиаторов и сами медиаторы, метаболизм которых связан с витамином В6, б) приведите примеры реакций образования некоторых биогенных аминов, в) укажите, как происходит их инактивация, написав соответствующие реакции. Задача №10. Витамин В6 часто назначают при состояниях, связанных с недостаточностью катехоламинов ( паркинсонизме, невритах, депрессивных состояниях). Объясните, на чем основано действие пиридоксина. Для этого: а) напишите схему синтеза катехоламинов, б) укажите на схеме реакцию, для которой необходим витамин В6. Задача №11. У пациента с жалобами на боли в печени определяли активность аланинаминотрансферазы (АлТ) и аспартатаминотрансферазы (АсТ) в крови. Активность какой трансферазы увеличится в большей степени при нарушении функции печени и почему? ПРИЛОЖЕНИЕ. Мочевина – это азотосодержащий конечный продукт катаболизма белка. Считается, что с повышенным уровнем со держания мочевины в крови связаны сос тояния гипер уремии и азотемии. Параллельное опре деление мочевины и креатинина в крови проводится для того, чтобы различить преренальную и постре нальную азотемии. Преренальная азотемия, вызванная, например, обезвоживанием, повышен ным катаболизмом белка, лечением кортизолом или пони женной ренальной перфузией, приводит к повышению уров ня мочевины в крови, в то время как значения креатинина остаются в пределах нормы. В случае постренальных азо темий, вызванных обструкцией уринарного тракта, повы шается как уровень мочевины, так и креатинина, но креатинина – в меньшей степени. В случае болезней почек кон центрация мочевины повышается при заметном снижении скорости гломерулярной фильтрации и при поглощении белка свыше 200 г в день. Метод “Уреазный – глутаматдегидрогеназный”: ферментативный УФ тест. Принцип определения Мочевина + 2H2O 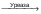 2NH4+ + 2HCO3– 2NH4+ + 2HCO3–2-Оксоглутарат + NH4++ НAДH 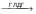 L-Глутамат + НAД++ H2O ГЛДГ: Глутамат дегидрогеназа Реагенты Компоненты и их концентрации в реакци онной смеси R1: Tрис, ммоль/л pH 7.8 120 2-Оксоглутарат, ммоль/л 7 АДФ, ммоль/л 0.6 Уреаза, кЕ/л 6 Глутаматдегидрогеназа, кЕ/л 1 R2: НAДH, ммоль/л 0.25 Стандарт, мг/дл(ммоль/л): 50(8.33) Исследуемые образцы • Сыворотка. • Плазма (не использовать гепаринат аммония!). • Свежая моча. Мочу разбавить дистиллированной водой 1 + 100 и полученный результат умножить на 101. Процедура определения Длина волны, нм 340, Hg 334, Hg 365 Длина опт.пути, см 1 Температура, °С 25/30/37 Измерение относительно холостой пробы; двухточечная кинетика Запуск реакции субстратом
А = (А1 – А2)образца/стандарта – (А1 – А2)холостой пробы. Запуск реакции образцом
А = (А1–А2)образца/стандарта. – (А1-А2)холостой пробы Примечания: Фразу “примерно 60 с при 25–30°С или примерно 30–40 с при 37°С следует понимать так, что пользователь может сам выбрать нужное время инкубации, и оно должно быть точно одинаковым для всех измерений. Расчет По калибратору или стандарту Мочевина [мг/дл] = 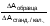 Конц.станд./кал. [мг/дл]. Фактор пересчета Мочевина [мг/дл]0.1665 = Мочевина [ммоль/л]. Мочевина [мг/дл]0.467 = = Азот мочевины [мг/дл]. Азот мочевины [мг/дл]2.14 = Мочевина [мг/дл]. Нормальные величины В сыворотке/плазме [1] Взрослые мг/дл ммоль/л Общие пределы 17–43 2.8–7.2 Женщины <50 лет 15–40 2.6–6.7 Женщины >50 лет 21–43 3.5–7.2 Мужчины <50 лет 19–44 3.2–7.3 Мужчины >50 лет 18–55 3.0–9.2 Дети 1–3 года 11–36 1.8–6.0 4–13 лет 15–36 2.5–6.0 14–19 лет 18–45 2.9–7.5 Соотношение мочевина/креатинин [1] 25–40 [(ммоль/л)/(ммоль/л)] 20–35 [(мг/дл)/(мг/дл)] Мочевина в моче [2] 26–43 г/сут. (0.43–0.72 моль/сут.) ФЕРМЕНТАТИВНЫЕ (УРЕАЗНЫЕ) МЕТОДЫ ОПРЕДЕЛЕНИЯ МОЧЕВИНЫ Ферментативные методы определения мочевины приобрели наибольшее распространение в современной клинико-лабораторной практике. Эти методы определения мочевины называются также уреазными, так как в них в качестве реактива используется фермент уреаза. Для уреазы мочевина является единственным физиологическим субстратом, поэтому уреазные методы высокоспецифичны. Ферментативные методы определения мочевины достаточно многочисленны, но все состоят из двух этапов. Первый этап - общий для всех уреазных методов. Суть его заключается в том, что под действием уреазы происходит гидролиз мочевины до аммиака. На втором этапе определяется концентрация аммиака, образовавшегося на первом этапе. В зависимости от используемых способов регистрации концентрации аммиака, ферментативные (уреазные) методы определения мочевины можно разделить на следующие группы:
| ||||||||||||||||||||||||||||||||||||
