Свойства ферментов (чувствительность к pH, термолабильность, специфичность и др.)
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ (ХИМИЧЕСКАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ, БЕЛОК-БЕЛКОВЫЕВЗАИМОДЕЙСТВИЯ). РОЛЬ ГОРМОНОВ, цАМФ, Са2+, ИТФ, МЕТАБОЛИТОВ С20:4, NO. ПРИНЦИП ОБРАТНОЙ ОТРИЦАТЕЛЬНОЙ СВЯЗИ. ОГРАНИЧЕННЫЙ ПРОТЕОЛИЗ. АДЕНИЛАТЦИКЛАЗНЫЙ И ИНОЗИТОЛТРИФОСФАТНЫЙ ПУТИ РЕГУЛЯЦИИ МЕТАБОЛИЗМА Клетка должна постоянно реагировать на меняющиеся условия среды. Это обеспечивается согласованной регуляцией скоростей химических реакций в различных метаболических путях. Скорость ферментативных реакций можно регулировать с использованием нескольких механизмов:Количеством фермента. Изменить количество ферментов в клетке можно регулируя скорость синтез (транскрипцию, трансляцию и посттрасляционную модификацию; подробнее материал будет рассматриваться в теме «Белки и нуклеиновые кислоты-5») и скорость распада фермента. Процесс такой регуляции достаточно медленный и плохо подходит для клеточного ответа в условиях быстрых изменений окружающей среды. Активностью фермента. В этом случае используется: Химической модификации фермента, Изостерическая регуляция, Аллостерическая регуляция, Белок-белковые взаимодействия. Химической модификации фермента.Ограниченный (частичный) протеолиз (ЖКТ, гемостаз) (рисунок 13). Пример необратимой регуляции (механизм регуляции используется один раз). Например, пепсиноген превращается в пепсин. 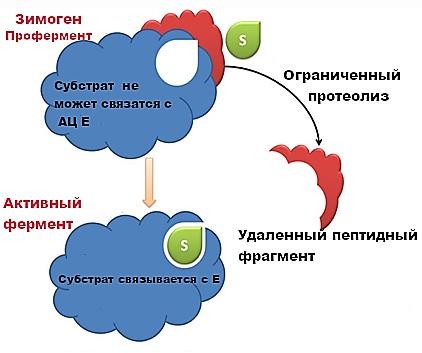 Рисунок 13 — Схема ограниченного (частичного) протеолиза. Примечание.Разработка автора на основе [4] Фосфорелирование/дефосфорилирование (рисунок 14). Пример обратимой регуляции. Может использоватся много раз. Например, протеинкиназы модифицируют другие белки путём фосфорилирования остатков аминокислот. 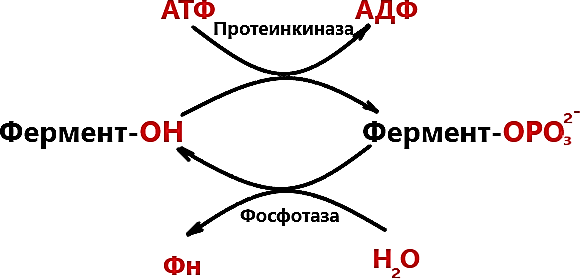 Рисунок 14 — Схема реакций фосфорелирование/дефосфорилирование фермента Также используется:Метилирование/деметилирование; Ацетилирование/деацетилирование; Аденилирование/деаденилирование и др. Белок-белковые взаимодействия.Некоторые ферменты меняют свою активность путем белок-белковых взаимодействий. Например, панкреатическая липаза секретируется в просвет 12- персной кишки в виде неактивного фермента – пролипазы. Активируется путем образования комплекса с белком колипазой (рисунок 15). 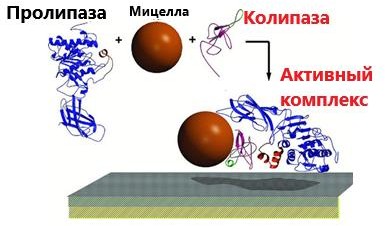 Рисунок 15 — Активация фермента липазы. Примечание. Разработка автора на основе [5] Аллостерическая регуляция активности ферментов (вопрос разобран в теме «Ферменты-3») Роль гормонов в регуляция активности ферментовВ зависимости от способа передачи гормонального сигнала в клетке меняется скорость реакций метаболизма: в результате изменения активности фермента, в результате изменения количества фермента. Внутриклеточные молекулярные сигнальные пути связывают внешние сигналы (гормоны) с внутриклеточными молекулярными процессами. К таким сигнальным путям относится: аденилатциклазная мессенджерная система, инозитол- зависимая мессенджерная система. В этих механизмах используются белок- белковые взаимодействия, аллостерическая регуляция и химическая модификация фермента. Аденилатциклазная мессенджерная система. В состав входят: Рецептора (связывает гормон); Фермент аденилатциклазы (синтезирует цАМФ); G-белка. Связывает аденилатциклазу с рецептором. Выделяют 2 типа G- белка: активирующий Gs и ингибирующий Gi. В составе каждого G-белка имеются 3 субъединицы (ɑ, β, γ). За проявление активирующей и ингибирующей активности отвечает ɑ-субъединица. Конформация G-белка зависит от того, связан он в данный момент с ГДФ или ГТФ. Присоединение гормона к рецептору вызывает замену ГДФ на ГТФ в G-белке и активацию G-белка; цАМФ-зависимая протеинкиназа. Фосфорилирует внутриклеточные ферменты-мишени, соответственно изменяя их активность; Фермент фосфодиэстераза. Вызывает распад цАМФ и тем самым прекращает (обрывает) действие сигнала. В каскадном принципе работы аденилатциклазного комплекса заложен механизм усиления сигнала. Под влиянием 1 молекулы адреналина из клетки печени высвобождается 10 000 молекул глюкозы. Инозитол-зависимая система регуляции включает несколько вторичных мессенджеров: Ca2+, ИФ3 – инозитолтрифосфат, ДАГ – диацилглицерол. Конечный эффект – активация протеинкиназы и фосфорилирование ферментов с изменением их активности [1,6,7]. Задание 5.1. – Поясните принцип обратной отрицательной связи, рассмотрев схему рисунка 16. 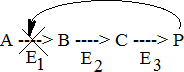 Задание 5.2. – Объясните физиологическое значение обратной отрицательной связи. Задание 5.2. – Объясните физиологическое значение обратной отрицательной связи.Рисунок 16 — Принцип обратной отрицательной связи Задание 5.3. – Приведите 3 примера превращения проферментов в ферменты. Задание 5.4. – Объясните физиологическое значение превращения проферментов в ферменты, рассмотрев рисунок 17. 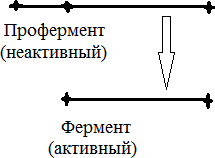 Рисунок 17 — Схема реакции ограниченного протеолиза Задание 5.5. – Дополните схему рисунка 18. следующими терминами: обратимые, специфические, аллостерический, изостерический, конкурентный, неконкурентный. 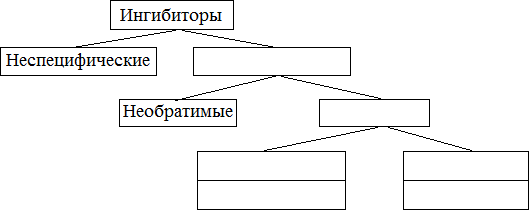 Рисунок 18 — Виды ингибиторов Задание 5.6. – Рассмотрите рисунок 19 и объясните механизм действия неконкурентных ингибиторов. 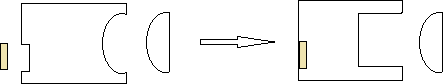 Рисунок 19 — Действие неконкурентных ингибиторов на ферментативную реакцию Задание 5.7. – Рассмотрите рисунок 20 и объясните механизм действия конкурентных ингибиторов. 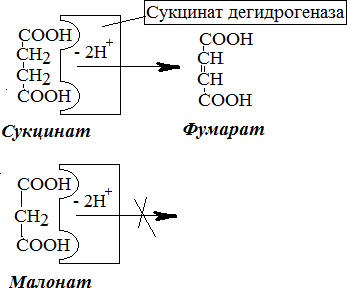 Рисунок 20 — Действие конкурентных ингибиторов Задание 5.8. – Найдите и обозначьте на схеме рисунка 21 протеинкиназу А, аденилатциклазу, G-белок, гормон, рецептор. 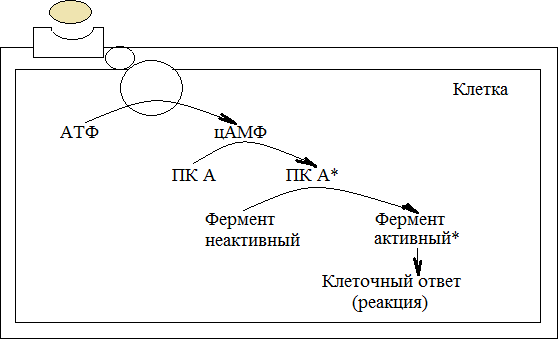 Задание 5.9. – Поясните суть процесса регуляции с помощью аденилатциклазного механизма. Задание 5.9. – Поясните суть процесса регуляции с помощью аденилатциклазного механизма.Задание 5.10. – Найдите и обозначьте на схеме рисунка 22 лейкотриены, простагландины, тромбоксаны, ЭПР, фосфотидилинозитол, фосфатидилинозитолдифосфат, инозитол-3-фосфат, ДАГ. Задание 5.11. – Обозначьте на схеме рисунка 22 разными цветами пути регуляции вторичных посредников ИФ3, ДАГ, PG, LT, TХA. Задание 5.12. – Поясните суть процесса регуляции с помощью инозитолтрифосфатного механизма (рисунок 22). 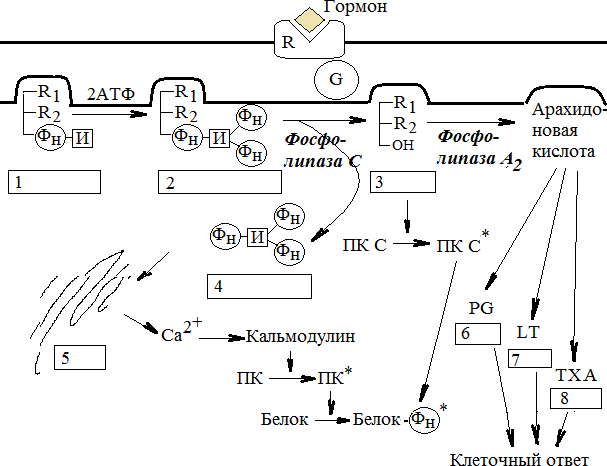 Рисунок 22 — Инозитолтрифосфатный путь регуляции метаболизма |
