Свойства ферментов (чувствительность к pH, термолабильность, специфичность и др.)
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
Термодинамика ферментативных реакций (энергетические изменения при химических реакциях)Согласно законам термодинамики любая химическая система стремится к снижению упорядоченности (увеличению энтропии). Поэтому разница энергий исходных субстратов и конечных продуктов самопроизвольно протекающей реакции (изменение свободной энергии реакции – ΔG) величина отрицательная (рисунок 3). 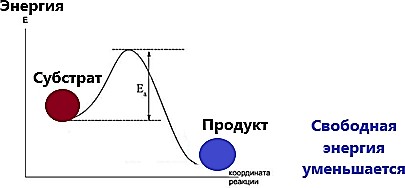 Рисунок 3 — Изменение свободной энергии компонентов спонтанно протекающей химической реакции Примечание.Разработка автора на основе [3] Химическая реакция проходит при обычных условиях, если уровень энергии молекул, вступающих в реакцию выше определенного значения (Еа). Этот уровень энергии называется энергией активации – дополнительное количество кинетической энергии, необходимое молекулам, чтобы они вступили в реакцию (энергия будет затрачена на правильную ориентацию реакционных групп, перегруппировку связей и другие преобразования). Таким образом энергия активации – это та избыточная энергия, которой должны обладать молекулы для достижения ими переходного состояния, соответствующего вершине энергетического (активационного) барьера. Молекулы, обладающие Еа, находятся в переходном состоянии (Еа – разность значения энергии в основном и переходном состоянии). Чем больше молекул обладают энергией, превышающий уровень Еа, тем выше скорость химической реакции. И наоборот, чем выше энергия активации, тем медленнее протекает реакция. Повысить скорость реакции можно нагреванием. В живых организмах высокие температуры разрушают пространственную структуру белка, поэтому в клетках используются ферменты. В отсутствии энергии активации сложные макромолекулы самопроизвольно превращались бы в более простые молекулярные формы. В таких условиях было бы невозможно существование сложных высокоорганизованных структур, протекание метаболизма. Ферменты в свою очередь способны избирательно понижать Еа тех реакций, которые необходимы клетке. Для ферментативного катализа характерны следующие особенности:Фермент влияет на скорость реакции, не сдвигает равновесия; Положение равновесия между субстратом и продуктом зависит от разности значений свободной энергии; Если свободная энергия продукта реакции (Р) ниже, чем субстрата (S), то равновесие сдвинуто в сторону образования продукта; Снижение Еа при ферментативном катализе обусловлено увеличением числа стадий химического процесса; Индуцирование ряда промежуточных реакций приводит к тому, что исходный активационный барьер дробится на несколько более низких барьеров, преодолеть которые реагирующим молекулам можно гораздо быстрее, чем основной [2,6,8]. Дополнительную информацию по теме вопроса вы можете узнать из [16-22]. |
