Свойства ферментов (чувствительность к pH, термолабильность, специфичность и др.)
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙПредметом химической кинетики является изучение всех факторов (химическая природа реагирующих веществ, факторы окружающей среды), влияющих на скорость как суммарного процесса, так и всех промежуточных стадий. Скорость ферментативной реакции определяется по изменению количества молекул субстрата или продукта в единицу времени. Скорость ферментативной реакции – мера каталитической активности фермента (каталитическая активность фермента). Факторы, влияющие на скорость ферментативных реакций:Концентрация, фермента и субстрата; Температура; Величина рН; Наличие эффекторов (активаторов и ингибиторов); Площадь поверхности субстрата в гетерогенном катализе. Зависимость скорости реакции от концентрации фермента:Чем выше концентрация фермента, тем выше скорость реакции (в условиях избытка субстрата). Графически зависимость такой реакции имеет вид прямой линии. Зависимость скорости реакции от концентрации субстрата:Изучая зависимость скорости ферментативной реакции от концентрации реагирующих веществ Л. Михаэлис и М. Ментен в 1913 году, создали общую теорию действия ферментов и ферментативной кинетики. 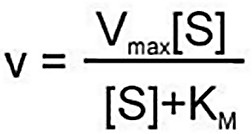 Зависимость между концентрацией субстрата и скоростью реакции для большинства ферментов имеет один и тот же вид, и выражается уравнением Михаэлиса-Ментен: Зависимость между концентрацией субстрата и скоростью реакции для большинства ферментов имеет один и тот же вид, и выражается уравнением Михаэлиса-Ментен:Где V- скорость реакции; [S] – концентрация субстрата; Vmax – максимальная скорость реакции; Км – константа Михаэлиса. Если концентрация фермента постоянна, а изменяется только количество субстрата, то график скорости ферментативной реакции описывается гиперболой (рисунок 4). 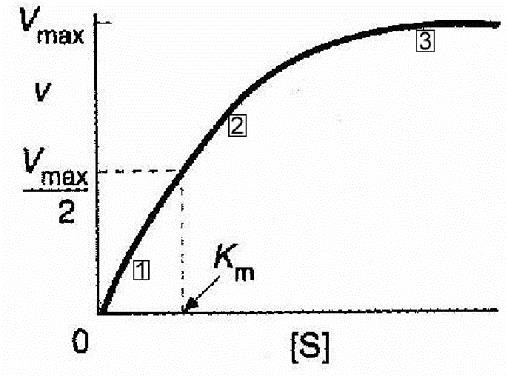 Рисунок 4 — Зависимость скорости ферментативной реакции от концентрации субстрата [2] Сложная гиперболическая зависимость показывает, что низкие, средние и высокие концентрации субстрата по-разному влияют на скорость ферментативной реакции. На графике этап номер 1 (соответствует низким концентрациям субстрата) представляет собой стадию быстрого образования фермент-субстратного комплекса. На этом этапе скорость реакции пропорциональна концентрации субстрата. При дальнейшем повышении концентрации субстрата (этап 2) зависимость все больше отклоняется от линейной (прирост активности все больше отстает от прироста концентрации субстрата). Еще большее увеличение концентрации субстрата приводит к достижению максимальной скорости реакции (3 этап). В данном случае активность фермента (скорость реакции) перестает зависеть от концентрации субстрата. Для некоторых ферментов субстрат в высокой концентрации (рисунок 5) может выступать в роли ингибитора (замедлять скорость реакции). В этом случаи к активному центру фермента одновременно пытаются присоединиться несколько молекул субстрата. Это замедляет скорость присоединения конкретной молекулы субстрата и снижает скорость ферментативной реакции. 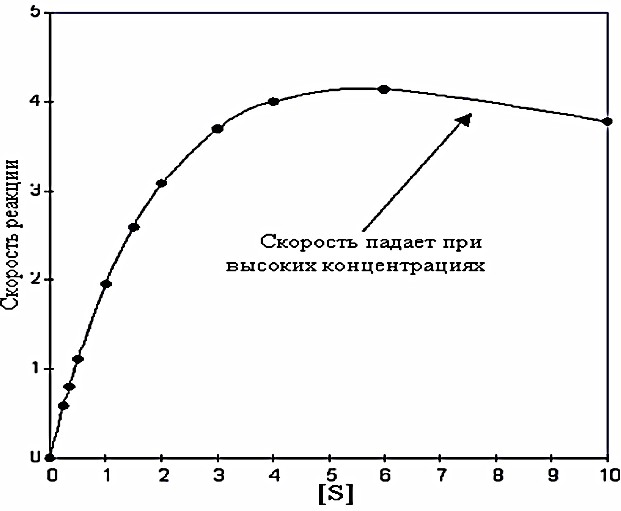 Рисунок 5 — Зависимость скорости ферментативной реакции от высоких концентраций субстрата [2] Основной кинетической характеристикой фермента является константа Михаэлиса (Кm). Она численно равна концентрации субстрата, при которой скорость химической реакции численно равна ½ от Vmax (рисунок 4). Константа Михаэлиса постоянна для каждого фермента и характеризует его сродство к субстрату. Чем больше константа, тем меньше сродство, и наоборот. Если концентрация субстрата ниже Кm, то скорость реакции пропорциональна концентрации субстрата и хорошо регулируется его количеством. Если концентрация субстрата намного выше Кm, то начальная скорость реакции равна Vmax, которая зависит только от активности самого фермента. Если концентрация субстрата равна Кm, то начальная скорость реакции равна 1/2 Vmax. Кm является регулятором метаболических потоков. В разных органах и тканях экспрессируются одни и те же ферменты, но с различными величинами Кm, что позволяет регулировать скорость реакции в каждом из органов, но и обеспечить целесообразное межорганное распределение субстратов (например, глюкозы в печени, мышцах и эритроцитах). Для более удобного анализа экспериментальных данных уравнение Михаэлиса- Ментен можно преобразовать в координатах «двойных обратных величин». 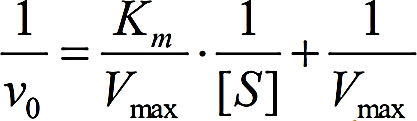 Данная форма записи уравнения Михаэлиса-Ментен называется уравнением Лайнуивера-Берка: Данная форма записи уравнения Михаэлиса-Ментен называется уравнением Лайнуивера-Берка:График зависимости представляет собой прямую линию и позволяет более точно определить Vmax и Кm. График удобен для анализа механизма ферментативных реакций и действия ингибиторов 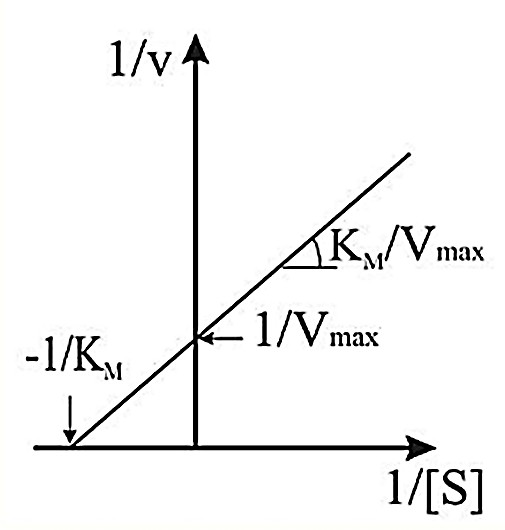 Рисунок 6 — Зависимость скорости ферментативной реакции от концентрации субстрата. Метод «двойных обратных величин» [2] Подавляющее большинство ферментов подчиняются кинетике Михаэлиса- Ментен. Наиболее важным исключением являются аллостерические ферменты. Для аллостерических ферментов характерна сигмоидная форма кривой зависимости V реакции от концентрации субстрата (в отличие от гиперболической для не аллостерических ферментов) (рисунок 7) [1,2,9]. 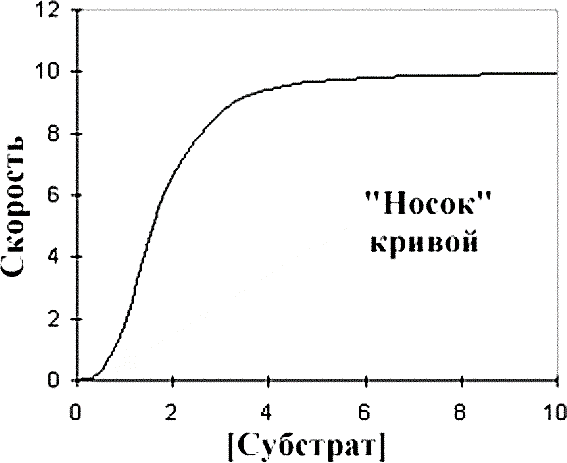 Рисунок 7 — Зависимость скорости ферментативной реакции, катализируемой аллостерическим ферментом, от концентрации субстрата [2] Дополнительную информацию по теме вопроса вы можете узнать из [26-28]. |
