Свойства ферментов (чувствительность к pH, термолабильность, специфичность и др.)
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
ИНГИБИРОВАНИЕ ФЕРМЕНТОВ. ВИДЫ ИНГИБИТОРОВ, МЕХАНИЗМ ИХ ДЕЙСТВИЯ, ПРИМЕРЫСкорость ферментативной реакции зависит от присутствия в среде специальных веществ – активаторов и ингибиторов. Первые повышают, а вторые снижают скорость ферментативной реакции (рисунок 8). 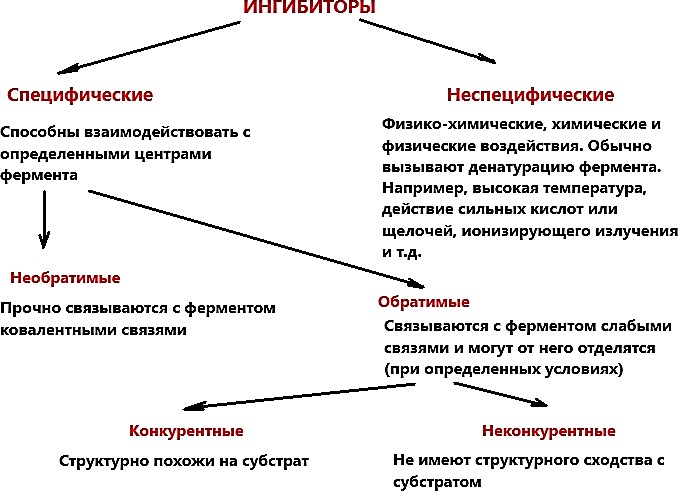 Рисунок 8 — Классификация ингибиторов По механизму действия обратимые ингибиторы подразделяются на конкурентные и неконкурентные. Конкурентное ингибирование осуществляют конкурентные ингибиторы.Конкурентный ингибитор – это соединение, обладающее структурным сходством с субстратом. Поэтому такой ингибитор способен взаимодействовать с активным центром фермента, конкурируя с истинным субстратом. Субстрат и ингибитор связываются с ферментом в активном центре, и связывание там одного из них исключает связывание второго (рисунок 9). 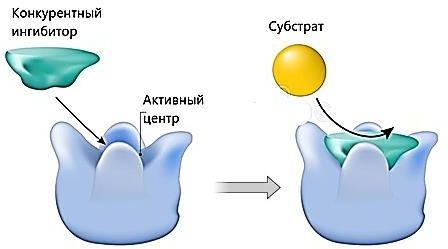 Рисунок 9 — Механизм действия конкурентного ингибитора. [3] Конкурентные ингибиторы повышают Кm, не влияют на Vmax. Эффект конкурентного ингибитора может быть устранен избытком субстрата (рисунок 10). 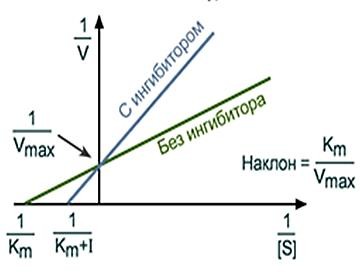 Рисунок 10 — График Лайнуивера-Берка в случаи классического конкурентного ингибирования. Примечание.Разработка автора на основе [2] Лечение людей, отравившихся метанолом, основано на конкуренции за активный центр фермента печени алкогольдегидрогеназы (АДГ). Лечение при отравлении метанолом состоит в медленном внутривенном введении этанола, с такой скоростью, которая позволяет поддерживать постоянной его концентрацию в крови на протяжении нескольких часов. Этанол – альтернативный субстрат АДГ. Действие этанола напоминает действие конкурентного ингибитора, с тем отличием, что его концентрация снижается по мере превращения в продукт реакции. Неконкурентное ингибирование осуществляется ингибиторами, не имеющими структурного сходства с субстратом. Ингибиторы связываются не с активным центром, а c другой областью молекулы, в том числе и c областью аллостерического центра (рисунок 11). 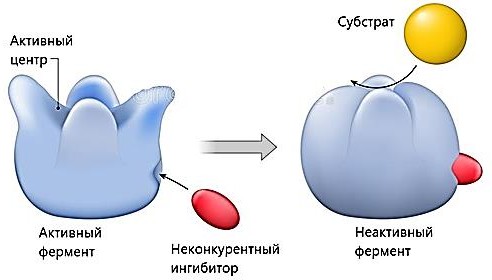 Рисунок 11 — Механизм действия конкурентного ингибитора [3] Неконкурентные ингибиторы не влияют на Кm, но снижают Vmax. Снижение Vmax происходит за счет снижения количества нормальных фермент- субстратных комплексов. Степень ингибирования зависит от концентрации ингибитора и не зависит от концентрации субстрата (рисунок 12). 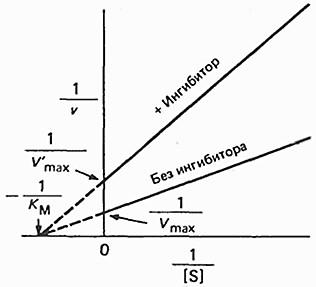 Рисунок 12 — График Лайнуивера-Берка в случаи неконкурентного ингибирования. Примечание. Разработка автора на основе [2] Конкурентное и неконкурентное ингибирование представляют собой два крайних случая ингибирования. На практике ингибирование большинства ферментативных реакций происходит по промежуточным механизмам. Смешанное ингибирование. Ингибитор, действующий по механизму смешанного типа, также связывается вне активного центра, но как с ферментом, так и с фермент-субстратным комплексом. При соединении фермента с I сохраняется возможность последующего присоединения S с образованием тройного комплекса, что обеспечивает медленное превращение в продукт. При ингибировании смешенного типа Vmax – снижается, Кm – повышается. Бесконкурентное ингибирование. Ингибитор присоединяется к фермент- субстратному комплексу и формируется тройной неактивный (или медленно реагирующий) комплекс. Часто встречается в сложных полисубстратных реакциях. Обычно наблюдается при повышенной концентрации субстрата (повышение концентрации субстрата усиливает ингибирование). Vmax и Кm при бесконкурентном ингибировании снижаются. Большое количество лекарств, применяемых для лечения различных болезней - от головной боли до ВИЧ-инфекции, представляют собой ингибиторы ферментов. Например, пенициллин – необратимый ингибитор фермента транспептидазы. Открыт в 1928г. А.Флемингом. Пенициллин блокирует синтез пептидогликана – основного компонента клеточной стенки бактерий, предохраняющего ее от осмотического лизиса [1,2,8]. Примеры лекарств, оказывающих ингибирующее действие, приведены в таблице 1. Таблица1. Лекарства – ингибиторы ферментов
|
