сам работа ноябрь. Тема . Электрохимические процессы
 Скачать 75.84 Kb. Скачать 75.84 Kb.
|
|
РАЗДЕЛ V ЭЛЕКТРОХИМИЧЕСКИЕ ЯВЛЕНИЯ. ТЕМА Ι. Электрохимические процессы. Содержание темы. 1. Электрохимические процессы. Типы электрохимических процессов. Строение двойного электрического слоя. Электродные потенциалы. 2. Стандартные электродные потенциалы. Стандартный водородный электрод. 3. Уравнение Нернста. 4. Гальванические элементы: электрохимические схемы, катодные и анодные процессы, токообразующие реакции, электродвижущая сила. Элемент Даниэля-Якоби. Типы гальванических элементов. Аккумуляторы. 5. Электролиз: катодные и анодные процессы, электролиз с инертным и активным анодом, суммарные реакции электролиза. Законы Фарадея. 6. Применение электрохимических процессов. Контрольные вопросы и задания. 1. Назовите типы электрохимических процессов. 2. Объясните, как возникает двойной электрический слой. 3. Что называют гальваническим элементом? Описать принцип его работы. 4. Что такое стандартный электродный потенциал? Уравнение Нернста. 5. Что такое электродвижущая сила гальванического элемента? Как рассчитывается ЭДС гальванического элемента для стандартных условий и условий, отличных от стандартных? 6. В чем отличие металлических и концентрационных гальванических элементов? 7. Какие процессы протекают при работе гальванического элемента, состоящего из железного и серебряного электродов, опущенных в растворы своих солей? 8. Составить схемы водородного, хлорсеребряного и каломельного электродов. 9. Что такое электролиз? 10. Назвать продукты электролиза водного раствора нитрата меди на нерастворимом аноде. 11. Каковы особенности электролиза с активным анодом? 12. Сформулируйте законы Фарадея. 1.3 Примеры решения задач. Пример 1. Гальванический элемент состоит из металлического цинка, погруженного в 0,1 моль/л раствор нитрата цинка, и металлического свинца, погруженного в 0,02 моль/л раствор нитрата свинца. Вычислить ЭДС элемента, написать уравнения электродных процессов, составить схему элемента. Решение Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы. Для этого в приложении находим значения стандартных электродных потенциалов систем, а затем рассчитываем значения электродного потенциала по уравнению Нернста: 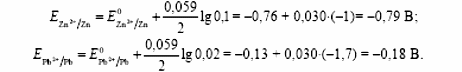 2) Определяем анод и катод. Поскольку ЕPb2+/Pb > ЕZn2+/Zn , то на свинцовом электроде будет происходить восстановление, т. е. он будет служить катодом: Pb2+ + 2 e = Pb0. На цинковом электроде будет происходить процесс окисления, т. е. этот электрод будет анодом: Zn0 – 2 e = Zn2+. 3) Находим ЭДС элемента 4) Записываем схему гальванического элемента Пример 2. Гальванический элемент составлен из стандартного цинкового электрода и хромового электрода, погруженного в раствор, содержащий ионы Cr3+. При какой концентрации ионов Cr3+ ЭДС этого элемента будет равна нулю? Решение 1) Так как по условию задачи ЭДС равна нулю, то исходя из формулы определения ЭДС = Eкат – Eанода, можно заключить, что электродные потенциалы катода и анода равны ЕCr3+/Cr = ЕZn2+/Zn. 2) Записываем электродные потенциалы через уравнение Нернста и приравниваем их: 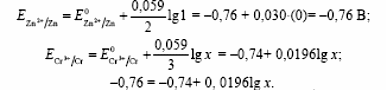 3) Найдем искомую концентрацию x ионов Сr3+ Таким образом, концентрация ионов Сr3+ составит 0,1 моль/л. Пример 4. Написать уравнения процессов, происходящих при электролизе сульфата натрия с инертным анодом. Решение В растворе сульфата натрия будет происходить диссоциация согласно уравнении Na2SO4 = 2Na+ + SO42–. К отрицательному электроду (катоду) будут подходить ионы натрия и воды. 2) Так как стандартный электродный потенциал системы Na+ + 1 e = Na0 значительно более отрицательный, чем потенциал водородного электрода, то согласно правилам электролиза на катоде будет происходить электрохимическое восстановление воды, а ионы натрия, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора. 3) На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода, так как стандартный электродный потенциал реакции окисления воды ниже, чем стандартный потенциал окисления сульфат-ионов. Ионы SO42–, движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве. Таким образом, будут протекать следующие реакции: – на катоде 2H2O + 2 e → H2 + 2OH –; – на аноде 2H2O – 4 e → O2 + 4H +. 4) Складывая катодные и анодные процессы и умножая левую и правую части катодного процесса на 2, получаем суммарное уравнение 5) Приняв во внимание, что одновременно происходит накопление ионов Na+ в катодном пространстве и SO42– в анодном пространстве, суммарное уравнение можно записать в следующей форме: Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия в катодном пространстве, и серная кислота в анодном пространстве. 1.4 Задания для самоконтроля. При какой концентрации ионов Zn2+ (в г-ион/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала. Марганцевый электрод в растворе его соли имеет потенциал —1,23 В. Вычислите концентрацию ионов Мn2+ в г-ион/л. Потенциал серебряного электрода в растворе AgNO3 оставил 95% от величины его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ в г-ион/л? При какой концентрации ионов Сu2+ в г-ион/л значение потенциала медного электрода становится равным стандартному потенциалу водородного элемента? Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cda+] = 1 г-ион/л. Изменится ли величина э.д.с., если концентрацию каждого из ионов понизить до 0,01 г-ион/л? Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (в г-ион/л), чтобы э.д.с. элемента стала равной нулю, если [Zn2+] = 0,001 г-ион/л? Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению Ni + Pb (NO3)2 = Ni(NO3)2 + Pb Напишите электронные уравнения анодного и катодного процессов. Вычислите э.д.с. этого элемента, если [Ni2+] = 0,01 г-ион/л, [Рb2+] = 0,0001 г-ион/л. Список рекомендуемой литературы. 1. Ахметов Н.С. Общая и неорганическая химия: Учеб. для студ. хим.-технол. спец. вузов/Н.С. Ахметов-4-е изд., испр.-М.: Высш.шк., 2009г, с 234- 248. 2. Попков В.А. Общая химия: учеб. пособие для вузов/В.А. Попков, С.А. Пузаков. – М.: ГЭОТАР – Медиа,2010. с 687-716. 3. Слесарев В.И. Химия: основы химии живого: учебник/В.И. Слесарев. -3-е изд., испр.- СПб.: Химиздат, 2005. с 652 - 677 ТЕМА ΙΙ. Коррозия и защита металлов. 2.1 Содержание темы. 1. Коррозия как результат окислительно-восстановительных реакций. Определение понятия коррозии. Признаки и стадии коррозии. 2. Классификация коррозионных процессов: – по условиям протекания – атмосферная, жидкостная, почвенная; – по характеру коррозионных разрушений; – по механизму протекания – химическая коррозия и электрохимическая коррозия. 3. Химическая коррозия: термодинамика и кинетика. 4. Электрохимическая коррозия. Механизм электрохимической коррозии. Коррозия с водородной и кислородной деполяризацией. Коррозия при контакте разных металлов. 5. Факторы, влияющие на скорость коррозии. Влияние рН среды. Влияние природы металлов и внешних условий на протекание коррозии. Степень термодинамической неустойчивости металлов. 6. Методы защиты от коррозии: легирование, защитные покрытия, электрохимическая защита. Изменение свойств коррозионной среды. Ингибиторы коррозии. 2.2. Контрольные вопросы и задания. 1. Перечислите признаки коррозии. 2. Приведите примеры химической коррозии металлов. 3. В чем сущность электрохимической коррозии металлов? 4. Какие реакции протекают при коррозии металлов в кислых и нейтральных растворах? 5. Как определить, какой из металлов корродирует при контакте двух металлов? Какой металл разрушается при электрохимической коррозии в микрогальванопаре: Fe или Mg, Fe или Cd, Fe или Ni? 6. Какое железо называется лужёным, а какое оцинкованным? 7. Какие процессы протекают на катоде и аноде при коррозии оцинкованного железа в сернокислой среде? 8. В чем суть протекторной защиты? Какие металлы используются для протекторной защиты железных изделий от коррозии? 9. В чем суть катодной защиты? Где она может быть применена? Приведите схему катодной защиты (электрозащиты) свинцового кабеля в условиях кислой почвы (рН = 4) и свободного доступа кислорода. Запишите уравнения электродных реакций 2.3. Примеры решения задач. Пример 1. Какой характер коррозионных разрушений является наиболее опасным? Решение К наиболее опасным коррозионным разрушениям относится локальная коррозия: язвенная, точечная, приводящая к сквозным разрушениям, межкристаллитная и коррозионное растрескивание. Пример 2. Почему алюминий и его сплавы не корродируют на воздухе, а черные металлы корродируют? Решение На поверхности алюминия образуется сплошная плотная защитная пленка из оксида алюминия. В атмосферных условиях она предохраняет алюминий от коррозии. На черных металлах образуется рыхлая и слоистая гигроскопичная пленка ржавчины, которая не изолирует полностью металл от окружающей среды, под этой пленкой коррозионный процесс продолжается. Пример 3. Объясните следующее явление: в две пробирки наливают раствор CuSO4 и погружают в него алюминиевую проволоку. Коррозия не наблюдается. При добавлении в одну из пробирок поваренной соли происходит быстрое растворение алюминия с выделением меди. Решение На поверхности алюминия присутствует оксидная пленка. При добавлении в раствор поваренной соли происходит диссоциация этой соли. Ионы хлора разрушают оксидную пленку на алюминии и алюминий, лишенный защитной пленки, легко реагирует с сульфатом меди Ионы хлора стимулируют коррозию. Пример 4. Почему в морской воде по сравнению с пресной скорость коррозии стали и алюминиевых сплавов резко возрастает? Какой участок корпуса корабля будет подвергаться коррозии в большей степени? Решение Морская вода содержит стимуляторы коррозии – ионы хлора, поэтому коррозия металлов в морской воде по сравнению с пресной резко возрастает. Так как скорость коррозии зависит от концентрации растворенного в воде кислорода, то в районе ватерлинии скорость коррозии будет максимальной. Пример 5. Каким покрытием: катодным или анодным является цинк, олово на поверхности железа? Как протекает процесс электрохимической коррозии: а) луженого, б) оцинкованного железа при нарушении целостности покрытия на воздухе? Решение Защитное покрытие редко удается получить сплошным. Поэтому необходимо заранее предвидеть поведение гальванической пары в месте повреждения покрытия в условиях контакта его с влагой. Стандартный электродный потенциал цинка меньше, чем железа ( E0(Zn/Zn2+) = –0,763 В; E0(Fe/Fe2+) = –0,440 В), поэтому цинковое покрытие играет роль анода – жертвенного участка. Оно будет защищать поверхность железа, пока полностью не разрушится. Такое покрытие защищает механически и электрохимически и является безопасным. Схема образующегося гальванического элемента: Электродные процессы: анодный процесс Zn0 – 2 e = Zn2+, катодный процесс в нейтральной среде O2 + 2H2O + 4 e = 4OH–. Вторичная реакция: Zn2+ + 2OH– = Zn(OH)2. Если покрытие оловянное, то при его нарушении будет происходить коррозия железного изделия, т. к. стандартный потенциал олова выше, чем железа: E0(Fe/Fe2+) = –0,440 В < E0(Sn/Sn2+) = – 0,136 В, причем коррозия проникает вглубь, образуя язвы. Такое покрытие защищает только механически и является опасным. Схема образующегося гальванического элемента (–) Fe | H2O, O2 | Sn (+). Электродные процессы: анодный процесс Fe 0– 2 e = Fe 2+, катодный процесс в нейтральной среде O2 + 2H2O + 4e = 4OH–. Вторичные реакции: Fe2++ 2OH– = Fe(OH)2; 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)2. Пример 6. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии? Решение Стандартный потенциал цинка равен (– 0,763 В), а кадмия (– 0,403 В). Поэтому цинк будет являться анодом, а кадмий – катодом. Электродные процессы: анодный процесс: Zn0 – 2 e =Zn2+; катодный процесс: в кислой среде 2H++ 2 e = H2; в нейтральной среде O2 + 2H2O + 4 e = 4OH–. Поскольку ионы двухвалентного цинка при взаимодействии с гидроксогруппой образуют нерастворимый гидроксид Zn2+ + 2OH–= Zn(OH)2, то продуктом коррозии будет Zn(OH)2. 2.4 Тестовые задания для самоконтроля. Выберите один правильный ответ. 01. ИЗ МЕТАЛЛОВ (Au, Cu, Cr, Mg) ВО ВЛАЖНОМ ВОЗДУХЕ ПРИ 25 °С БУДУТ КОРРОДИРОВАТЬ: 1) все; 2) Cu, Cr, Mg; 3) Mg; 4) ни один; 5) Cu, Mg. 02. ТРИ СТАЛЬНЫЕ БОЧКИ, ИЗГОТОВЛЕННЫЕ ИЗ ЖЕЛЕЗА, ЗАПОЛНЕНЫ: ОДНА – КЕРОСИНОМ, ВТОРАЯ – ЧИСТОЙ РОДНИКОВОЙ ВОДОЙ, ТРЕТЬЯ – КОНЦЕНТРИРОВАННЫМ РАСТВОРОМ СОДЫ. БЫСТРЕЕ ПРОКОРРОДИРУЕТ БОЧКА: 1) все одинаково; 2) первая; 3) вторая; 4) третья; 5) ни одна. 03. ОТВЕРСТИЯ В ЖЕЛЕЗНОМ КОТЕЛКЕ ЗАПАЯЛИ ОЛОВОМ. ЧЕРЕЗ НЕКОТОРОЕ ВРЕМЯ КОТЕЛОК ПРОХУДИЛСЯ. СХЕМА АНОДНОГО ПРОЦЕССА: 1) 2H2O + 2 e= H2 + 2OH–; 2) Sn – 2 e= Sn2+ ; 3) Fe – 2 e= Fe2+; 4) 2Н+ + 2 e = Н2; 5) Zn – 2 e = Zn2+. 04. НАЗОВИТЕ МЕТАЛЛЫ, КОТОРЫЕ МОЖНО ИСПОЛЬЗОВАТЬ ДЛЯ ПРОТЕКТОРНОЙ ЗАЩИТЫ ЖЕЛЕЗНЫХ ИЗДЕЛИЙ ОТ КОРРОЗИИ: 1) все, стоящие в ряду напряжений правее водорода; 2) все, стоящие в ряду напряжений левее водорода; 3) все, стоящие в ряду напряжений левее железа; 4) все, стоящие в ряду напряжений правее железа. 05. УКАЖИТЕ, КАКОЙ МЕТАЛЛ ПОДВЕРГАЕТСЯ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ, ЕСЛИ ЖЕЛЕЗО СОДЕРЖИТ МИКРОВКЛЮЧЕНИЯ Mg: 1) Fe; 2) Mg; 3) ни один; 4) Fe, Mg. 2.5 Список рекомендуемой литературы. Попков В.А. Общая химия: учеб. пособие для вузов/В.А. Попков, С.А. Пузаков. – М.: ГЭОТАР – Медиа,2010 с 687-716. РАЗДЕЛ VΙ. ФИЗИКО-ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ И РАСТВОРОВ ВМС. ТЕМА Ι. Дисперсные системы. 1.1 Содержание темы. Дисперсные системы. Дисперсная фаза и дисперсионная среда. Степень дисперсности. Классификация дисперсных систем: по степени дисперсности; по агрегатным состояниям дисперсной фазы и дисперсионной среды. Коллоидное состояние вещества. Классификация и характеристика коллоидных растворов. Диспергационные и конденсационные способы получения коллоидных растворов. Свойства коллоидных растворов, явление электрофореза и электроосмоса. Устойчивость и строение коллоидной частицы, правило Паннета-Фаянса, двойной электрический слой. Коагуляция, электролитная коагуляция лиофобных золей. Правило Шульце-Гарди. Пептизация. 1.2 Контрольные вопросы и задания. Что такое дисперсные системы, и как они классифицируются по различным признакам? Какие методы получения коллоидных систем вам известны? Коллоидное состояние сульфата бария получено путем добавления раствора ацетата бария к избытку раствора сульфата лития. Какие ионы будут адсорбироваться на поверхности частиц? Какая устойчивость коллоидной системы обусловлена броуновским движением коллоидных частиц? Что называют порогом коагуляции? Примеры решения задач. Пример 1. Для коагуляции 10 мл золя иодида серебра требуется 0,5 мл раствора нитрата кальция молярной концентрации 0,2 моль/л. Определите порог коагуляции. Решение. Порог коагуляции определяем по уравнению  1.4 Тестовые задания для самоконтроля. 01. РАЗМЕР ИСТИННО КОЛЛОИДНЫХ ЧАСТИЦ СОТОВЛЯЕТ: 1) 10-4 – 10-7 м 2) 10-7 – 10-9 м 3) 10-3 – 10-5 4) <10-9 м 02. МЕТОДАМИ ПОЛУЧЕНИЯ ЛИОФОБНЫХ ЗОЛЕЙ ЯВЛЯЮТСЯ: 1) замена растворителя 2) самопроизвольное диспергирование 3) измельчение с помощью шаровых и коллоидных мельниц 4) электрораспыление 03. ДЛЯ ПОЛУЧЕНИЯ ЗОЛЕЙ МЕТОДОМ ХИМИЧЕСКОЙ КОНДЕНСАЦИИ НЕОБХОДИМО СОБЛЮДАТЬ УСЛОВИЯ: 1) наличие стабилизатора 2) эквивалентное соотношение реагирующих веществ 3) малая растворимость дисперсной фазы 4) состояние пересыщения раствора 04. УРАВНЕНИЯ, ОПИСЫВАЮЩИЕ ПЕРЕМЕЩЕНИЕ ЧАСТИЦЫ ПРИ БРОУНОВСКОМ ДВИЖЕНИИ: 1) 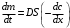 2) 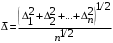 3) 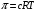 г) 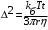 4) 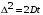 05. ВЕЛИЧИНА ОСМОТИЧЕСКОГО ДАВЛЕНИЯ В КОЛЛОИДНЫХ РАСТВОРАХ ЗАВИСИТ ОТ ФАКТОРОВ: 1) частичная концентрация 2) присутствие электролитов 3) температура 4) вязкость среды 06. ОБРАТНЫМИ ЭЛЕКТРОКИНЕТИЧЕСКИМИ ЯВЛЕНИЯМИ ЯВЛЯЮТСЯ: 1) электрофорез 2) электроосмос 3) потенциал протекания 4) потенциал течения 07. НАИБОЛЕЕ ЭКОНОМИЧНЫМ ДЛЯ ОЧИСТКИ ВОДОПРОВОДНОЙ ВОДЫ ОТ ВЗВЕШЕННЫХ ЧАСТИЦ ГЛИНЫ И ПЕСКА ЯВЛЯЕТСЯ ЭЛЕКТРОЛИТ: 1) Na3PO4 2) AL2(SO4)3 3) CaCL2 4) KBr 5) щавелевая кислота 08. МЕТОД ХИМИЧЕСКОЙ КОНДЕНСАЦИИ – ЭТО: 1) выделение новой фазы из гомогенной системы в результате химической реакции 2) возникновение новой фазы из пересыщенного раствора в результате химической реакции 3) совместная конденсация паров веществ, образующих дисперсную фазу и дисперсионную среду 4) возникновение новой фазы из гомогенной системы при изменении состава среды 09. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ СЕДИМЕНТАЦИИ ПОД ДЕЙСТВИЕМ СИЛЫ ТЯЖЕСТЬ: 1) размер частиц 2) рН среды 3) плотность частиц дисперсной фазы 4) плотность дисперсионной среды 5) вязкость дисперсионной среды 10. ПРИ МЕДЛЕННОЙ КОАГУЛЯЦИИ УВЕЛИЧЕНИЕ КОНЦЕНТРАЦИИ ЭЛЕКТРОЛИТА-КОАГУЛЯТОРА ВЫЗЫВАЕТ: 1) медленное увеличение скорости коагуляции 2) резкое увеличение скорости коагуляции 3) не влияет на скорость коагуляции 4) уменьшение скорости коагуляции 1.5 Список литературы. 1. Попков В.А. Общая химия: учеб. пособие для вузов/В.А. Попков, С.А. Пузаков. – М.: ГЭОТАР – Медиа,2010. с 76-77, 797-845. 2. Слесарев В.И. Химия: основы химии живого: учебник/В.И. Слесарев. -3-е изд., испр.- СПб.: Химиздат, 2005. с 708 - 762 |
