I. Телофрагма и тонкие миофиламенты
Тело-
фрагма
|
Телофрагма (1) (видимая как Z-линия) - это
сетчатая пластинка из -актинина (не путать с актином!) и некоторых других белков, которая
расположена поперёк миофибрилл и
служит местом крепления тонких миофиламентов.
|
Состав тонких миофи-
ламентов
|
а) Тонкие, или актиновые, миофиламенты (1) образованы глобулярным белком актином.
б) Примерно 350 молекул последнего объединяются в двойную спираль.
в) Кроме того, с данной спиралью связаны ещё два белка (по 50 молекул):
глобулярный белок тропонин
и фибриллярный белок тропомиозин.
г) Именно присутствие этих дополнительных белков отличает
тонкие миофиламенты от
тонких микрофиламентов - элементов цитоскелета (тема 3).
|
Электронная микрофотография (А) и схема (Б) - тонкая структура саркомеров.
А Б Б
Полный размер
|
Роль дополни-
тельных белков
|
а) Функциональная роль тропонина и тропомиозина состоит в том, что они влияют на взаимодействие актина с толстыми миофиламентами.
б) А именно:
в состоянии покоя эти белки блокируют активные центры актина,
что исключает взаимодействие миофиламентов.
|
Крепле-
ние
|
а) Тонкие филаменты прикрепляются к телофрагме (т.е. к белку актинину) с обеих её сторон.
б) Таким образом, в каждом саркомере -
две группы актиновых филаментов,
идущих от соседних телофрагм навстречу друг другу.
|

|
в) В покое между их концами остаётся промежуток, соответствующий Н-зоне (3).
|
Коли-
чество
|
Всего в саркомере – примерно 5600 тонких миофиламентов.
|
II. Толстые миофиламенты и мезофрагма
Состав толстых миофи-
ламентов
|
а) Толстые (миозиновые) миофиламенты (4) образованы белком миозином.
б) Молекула миозина состоит из нескольких пептидных цепей и включает
"стержень" - длинную палочковидную часть
и двойную "головку".
|

|
в) В толстом миофиламенте – примерно 300 молекул миозина. Причём
их стержни плотно упакованы в толстом филаменте,
а головки выступают наружу и при сокращении участвуют во взаимодействии с тонкими филаментами.
|
Креп-
ление и положе-
ние в сарко-
мере
|
а) Толстые миофиламенты крепятся своей срединной частью к мезофрагме (образованной М-белком).
б) Они тоже (как и тонкие миофиламенты) ориентированы вдоль длинной оси миофибриллы.
в) При этом каждая толстая миофиламента доходит своими концами до краёв А-диска. Иными словами,
длина толстых миофиламентов равна ширине тёмного (А-) диска,
и само существование этого тёмного диска обусловлено присутствием здесь толстых миофиламентов.
г) От толстых миофиламентов по всей их длине отходят нити из белка титина, прикрепляющиеся к телофрагме.
Они предохраняют мышечное волокно от перерастяжения.
|
Коли-
чество
|
Всего в саркомере – около 1400 толстых миофиламентов, что
вчетверо меньше общего количества тонких миофиламентов.
|
III. Взаимное расположение миофиламентов
Состав участков сарко-
мера
|
Из сказанного вытекает следующий состав различных участков саркомера:
в пределах Н-зоны на поперечном срезе миофибриллы содержатся только толстые миофиламенты,
в остальных областях тёмного (А-) диска - и тонкие, и толстые миофиламенты,
а в пределах светлого (I-) диска - только тонкие миофиламенты.
|
Гексаго-
нальная упаковка
|
В области перекрывания толстые и тонкие миофиламенты расположены гексагональным образом, причём так, что
вокруг каждого толстого миофиламента находятся 6 тонких,
а вокруг каждого тонкого - 3 толстые.
|
Относи-
тельное коли-
чество
|
а) Отсюда следует, что, если учитывать тонкие миофиламенты лишь одной половины саркомера, число этих миофиламентов вдвое больше, чем толстых.
б) С учётом же и второй группы тонких миофиламентов, последних оказывается уже
вчетверо больше, чем толстых
(что и было отмечено выше).
|
IV. Дополнительные опорные структуры
Общий перечень
|
Такая упорядоченность расположения миофиламентов в миофибрилле и миофибрилл в миосимпласте поддерживается с помощью ряда опорных структур:
уже известных нам телофрагмы, мезофрагмы, нитей титина,
а также ещё не упоминавшихся промежуточных филаментов и костамеров.
|
Промежу-
точные филаменты
|
а) Промежуточные филаменты (см. тему 3) образованы в миосимпластах белком десмином.
б) Эти филаменты связывают
соседние телофрагмы миофибриллы,
телофрагмы (и мезофрагмы) соседних миофибрилл,
а также миофибриллы с мембранными структурами симпласта.
|
Костамеры
|
Костамеры же - это кольца из белка винкулина, которые
расположены под плазмолеммой и
прикрепляют к ней I-диски подлежащих миофибрилл.
|

11.2.2.4. Миофибриллы: взаимодействие миофиламентов
I. Состояние покоя
Актиновые нити
|
В саркоплазме невозбуждённого мышечного волокна – очень низкая концентрация ионов Са2+. В этих условиях
в тонких миофиламентах комплексы тропонина и тропомиозина блокируют центры актина,
и миозиновые головки толстых миофиламентов не могут взаимодействовать с этими центрами.
|
Головки миозина
|
В то же время
с головками миозина связаны продукты гидролиза АТФ (АДФ и фосфат),
а сами головки находятся в напряжённой (энергизованной) конформации – за счёт предшествующего распада АТФ.
|
II. Механизм сокращения
Инициация
|
При возбуждении мышечного волокна в сарколемме резко возрастает содержание ионов Са2+.
б) Это инициирует цепочку следующих событий.
|
1. Активация тонких МФ
|
В тонких миофиламентах (МФ) меняется конфигурация комплексов тропонин-тропомиозин, в результате чего
освобождаются центры актина.
|
2. Замыкание мостиков между толстыми и тонкими МФ
|
а) C освободившимися центрами связываются миозиновые головки – образуются мостики между толстыми и тонкими миофиламентами.
б) Одновременно
АДФ и фосфат вытесняются актином из связи с миозиновыми головками.
|
3. Перемеще-
ние МФ
|
а) Hапряжённая конформация миозиновых головок создаёт силу, тянущую тонкие и толстые миофиламенты навстречу друг другу. –
б) Происходит их взаимное перемещение на некоторое расстояние – а конкретно
тонкие МФ вдвигаются ещё глубже между толстыми МФ.
в) В итоге миозиновые головки переходят в менее напряжённое состояние.
|
4. Размыка-
ние мостиков с помощью АТФ
|
Головки связывают новые молекулы АТФ (в соотношении 1:1) – и только это приводит к размыканию мостиков:
АТФ вытесняет актин из комплексов с миозиновыми головками.
|
5. Энерги-
зация головок миозина
|
Миозиновые головки
катализируют распад АТФ (до АДФ и фосфата)
и за счёт энергии этого распада вновь переходят в энергизованное состояние,
т.е. приобретают способность вступить в новый цикл.
|
III. Изменение саркомеров при сокращении
1. Характер изменений.
а) Циклы замыкания и размыкания мостиков (стадии II-V описанного механизма) повторяются много раз, отчего
тонкие миофиламенты всё глубже вдвигаются между толстыми.
б) В итоге в саркомерах миофибрилл
I-диски (1) и светлая (Н-) зона А-диска становятся тоньше,
а тёмные участки А-диска – шире.
в) Общая ширина А-дисков, очевидно, не меняется: она определяется постоянной длиной толстых миофиламентов.
г) За счёт же укорочения I-полудисков саркомеры, а с ними и мышца в целом, тоже укорачиваются.
|
Электронная микрофотография: миофибрилла при сокращении
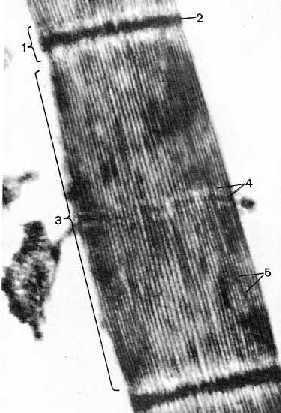
|
2. Максимальное сокращение.
а) Максимальное сокращениедостигается тогда, когда
I-полудиски полностью исчезают,
т.е. концы толстых миофиламентов начинают упираться в телофрагмы.
б) Учитывая исходную ширину I-дисков (0,8 мкм) и постоянную ширину А-дисков (1,5 мкм), нетрудно найти, что
при максимальном сокращении длина мышцы уменьшается примерно на 35%.
|
IV. Резюме
Вышесказанное о структуре саркомера и её изменениях при сокращении суммируется следующей таблицей. -
|
Z-линия
|
I-полудиск
|
Тёмная часть диска А
|
Н-зона диска А
|
М-линия
|
Опорный
элемент
тонких
миофила-
ментов
|
Только
тонкие
миофила-
менты
|
Тонкие и толстые
миофиламенты
|
Только
толстые
миофила-
менты
|
Опорный
элемент
толстых
миофила-
ментов
|
----
|
При сокращении
суживается
|
При сокращении
расширяется
|
При сокращении
суживается
|
---
|
V. Трупное окоченение
Вышеизложенное позволяет также объяснить известный феномен трупного окоченения.
а) После смерти, в связи с угасанием метаболических процессов, в мышцах быстро снижается концентрация АТФ. Поэтому
перестаёт функционировать Са2+-насос,
и в саркоплазме повышается концентрация ионов Са2+.
б) Под их влиянием в мышцах замыкаются мостики между тонкими и толстыми миофиламентами.
в) А разомкнуться они не в состоянии, т.к. для этого требуется АТФ (см. механизм сокращения).
г) Таким образом, существо трупного окоченения – это
постепенное замыкание всё большего числа мостиков между миофиламентами.
|

11.2.2.5. Заключительная схема
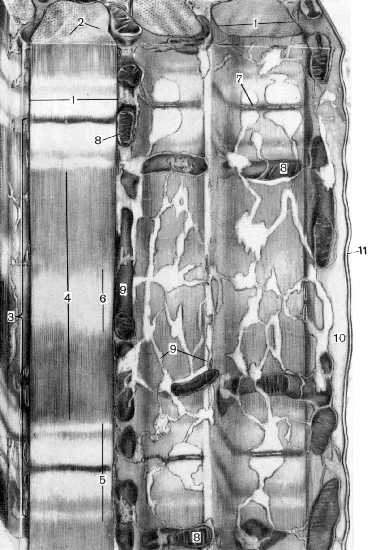
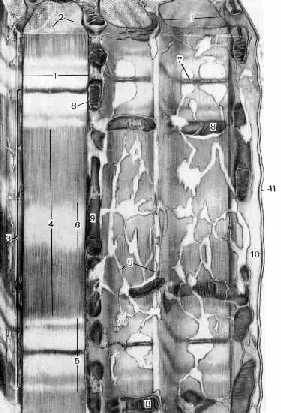
Завершая обсуждение ультрамикроскопического строения мышечных волокон, рассмотрим ещё одну схему.
Поперечнополосатое мышечное волокно. Схема.
|
1. На рисунке показан небольшой фрагмент мышечного волокна.
2. а) Основную часть последнего занимают миофибриллы (1).
б) Они имеют поперечную исчерченность: в них можно видеть
светлые I-диски (5) с тёмной Z-линией (7) посередине
и тёмные А-диски (4) с более светлой Н-зоной (6) посередине.
в) Заметим, что в центре Н-зоны должна находиться М-линия,
но её на рисунке нет.
г) Цифрой (3) обозначен саркомер - участок миофибриллы между двумя соседними Z-линиями.
|
|
д) Как мы уже знаем, исчерченность обусловлена регулярной упаковкой в миофибриллах
толстых и тонких миофиламентов (2).
3. Кроме миофибрилл, на рисунке изображены составные части саркоплазматического ретикулума:
L-канальцы (9), окружающие миофибриллы,
и их расширения - терминальные цистерны.
4. Наконец, показаны также прочие компоненты мышечного волокна:
|
|
сарколемма (11), саркоплазма (10) и
содержащиеся в последней митохондрии (8).
|

11.2.3. Гистохимия мышечных волокон

11.2.3.1. Красные и белые мышечные волокна
I. Введение
а) По своим физиологическим возможностям и обуславливающим их биохимическим свойствам, мышечные волокна делят на несколько типов:
красныемышечные волокна (волокна I-го, илимедленноготипа),
волокна промежуточного типа и
белыемышечные волокна (волокна II-го, илибыстроготипа).
б) Причём эти волокна в том или ином соотношении содержатся в одной и той же мышце.
в) Соотношение же между волокнами разного типа является индивидуальным для каждого человека:
у кого-то преобладают красные волокна,
у кого-то - белые,
а ещё у кого-то количество тех и других примерно одинаково.
в) Есть мнение, что тип мышечного волокна определяется типом иннервирующего его мотонейрона.
| |
 Скачать 1.48 Mb.
Скачать 1.48 Mb.
 Б
Б

