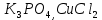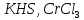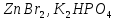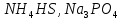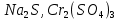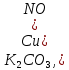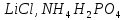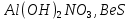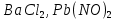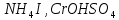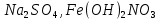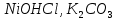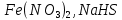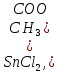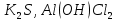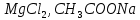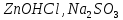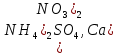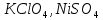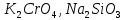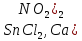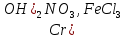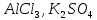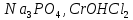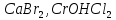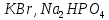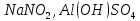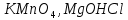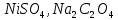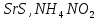Гидролиз солей. Практическое задание_Гидролиз солей. Тема Гидролиз солей
 Скачать 45.33 Kb. Скачать 45.33 Kb.
|
|
Практическое задание Тема «Гидролиз солей» Краткие теоретические положения. Водные растворы солей имеют разные значения рН и различные типы сред – кислотную (рН < 7), щелочную (рН > 7), нейтральную (рН = 7). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу. Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). В водном растворе соли появляется избыток свободных ионов Н+ или ОН-, и раствор соли становится кислотным или щелочным соответственно. Известны четыре случая взаимодействия солей с водой. Соли, образованные анионом сильной кислоты и катионом сильного основания, не гидролизуются. Растворы этих солей электронейтральны. Возможны следующие случаи гидролиза: анионный гидролиз, катионный гидролиз и совместный анионный и катионный гидролиз. Анионный гидролиз проходит, когда соли образованы катионом сильного основания и анионом слабой кислоты. Результатом гидролиза является установление в растворе щелочной среды. Гидролиз многозарядных анионов проходит ступенчато, благодаря ступенчатой диссоциации полиосновных кислот, а при обычных условиях протекает в основном по первой ступени: Гидролиз по второй ступени протекает незначительно: Катионный гидролиз проходит, когда соли образованы катионом слабого основания и анионом сильной кислоты. Гидролиз имеет место в кислом растворе. Гидролиз по второй ступени происходит в ничтожно малой степени: Особенно глубоко протекает гидролиз солей, когда они образованы катионом слабого основания и анионом слабой кислоты (совместный анионный и катионный гидролиз). Гидролиз в таких случаях протекает только по первой ступени. Реакция раствора зависит от соотношения констант диссоциации образованных кислот и оснований. Следовательно, реакция среды – слабощелочная. Гидролиз усиливается при разбавлении, нагревании или добавлении веществ, связывающих гидроксид-ионы или ионы водорода. Практическое задание 1. Составьте уравнения гидролиза солей в молекулярной и ионной формах. 2. Укажите реакцию раствора. Варианты заданий
|