ЛЕКЦИЯ. Лекция №4. Тема Клеточные факторы адаптивного иммунитета. Дифференцировка и основные субпопуляции тлимфоцитов. Цитотоксические лимфоциты. Цитокины. Схема иммунного ответа гуморального и клеточного типа
 Скачать 1.52 Mb. Скачать 1.52 Mb.
|
Т-лимфоциты (CD3+)Общее число лимфоцитов у взрослого человека составляет примерно 1012 клеток. При этом в крови находится только 1% лимфоцитов, остальные сосредоточены в тканях. В кровотоке около 20-30% лейкоцитов представлены лимфоидными клетками. На долю Т- лимфоцитов приходится 55-80% от общего числа лимфоцитов крови (950-2100*109/л). Морфологически Т-лимфоциты – небольшие округлые клетки (диаметром 6-10 мкм) с ядром бобовидной формы и узким ободком цитоплазмы. TCR, как и CD3, являются абсолютными маркерами Т-лимфоцитов: они экспрессируются только на зрелых Т-клетках. СD4+ Т-хелперы – функциональная субпопуляция Т-клеток, которые продуцируют различные цитокины и участвуют в распознавании антигенного пептида в комплексе с молекулами МНС II класса (на антигенпрезентирующей клетке), в генерации цитотоксических Т- лимфоцитов, в межклеточной кооперации с В-клетками, направляя их дифференцировку по пути плазматических клеток, синтезирующих антитела, а также в некоторых вариантах цитотоксичности. Цитотоксические лимфоциты (CD8+) – клетки-киллеры, способные уничтожать собственные клетки, зараженные вирусом, опухолевые клетки, клетки трансплантата. Являются ключевыми в защите организма от внутриклеточных паразитов. 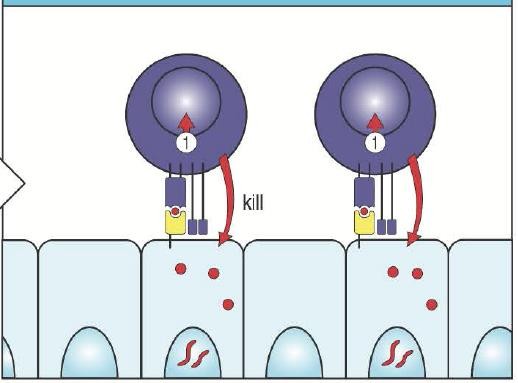 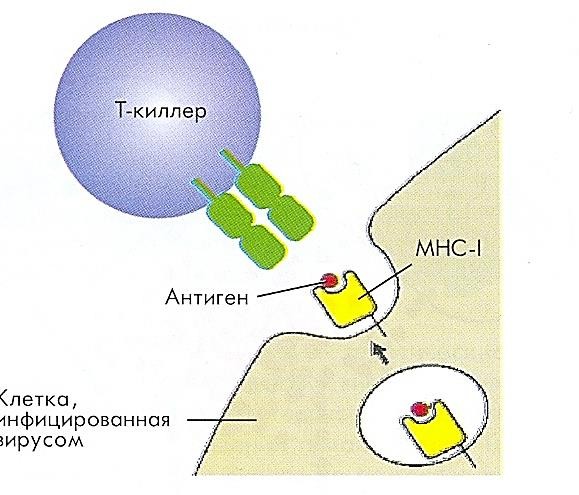 С помощью TCR распознают собственные клетки организма, на поверхности которых имеется чужеродный антиген в комплексе с молекулой гистосовместимости 1 класса – HLA1. Пролиферируют, синтезируют перфорины, формирующие поры в клетке мишени. Через поры в клетку поступают гранзимы, активирующие каспазы и инициирующие апоптоз. С помощью TCR распознают собственные клетки организма, на поверхности которых имеется чужеродный антиген в комплексе с молекулой гистосовместимости 1 класса – HLA1. Пролиферируют, синтезируют перфорины, формирующие поры в клетке мишени. Через поры в клетку поступают гранзимы, активирующие каспазы и инициирующие апоптоз.Рис.3 Т- киллер атакует клетку-мишеньСреди αβТ-лимфоцитов (подавляющее большинство) выделяют 4 естественные субпопуляции: CD4+, CD8+ Т-лимфоциты, естественные регуляторные Т-клетки и NKT. Субпопуляция CD4+ Т-лимфоцитов хелперов распознают антигенный пептид в составе МНС II, а CD8+ Т-клетки цитотоксические- в составе МНС I. ЕстественныерегуляторныеТ-клеткиимеют фенотип CD4+/CD25hi/CTLA-4 (CD152)/внутриклеточный фактор FOXP3, т.е. регуляторные Т-клетки сильно экспрессируют α- цепь рецептора для IL2 (CD25), что отличает их от активированных Т-хелперов, несущих меньшее количество молекул CD25. Их функция состоит в контроле активности аутоспецифических клонов Т-лимфоцитов, не удаленных в процессе отрицательной селекции, мигрировавших в периферический отдел иммунной системы и создающих опасность аутоагрессии. Супрессорная активность CD4+ регуляторных Т-клеток связана с транскрипционным фактором FOXP3 (скурфин). Важную роль в индукции регуляторных Т- клеток играют дендритные клетки тимуса, активированные цитокином (стромальный лимфопоэтин тимуса), секретируемым эпителиальными клетками телец Гассаля. Тreg эмигрируют из тимуса в составе популяции зрелых Т-клеток. CD4+ CD25hi Т-лимфоциты составляют 5% от числа тимоцитов, 3-5% от числа периферических лимфоцитов (5-7% от числа CD4+ Т-клеток). Tr1, Th3 выполняют супрессивную функцию, подавляя активность Т-киллеров в исходе иммунного ответа. Th3-клеткипредставляют разновидность Т-хелперов, индуцируемую при иммунном ответе. Эти клетки секретируют исключительно или преимущественно TGFβ (трансформирующий фактор роста β), который и играет роль их основного эффекторного фактора. Tr1-клетки описаны в барьерных тканях, как клетки, секретирующие IL10 и вовлеченные в формирование неотвечаемости на антигены пищи и симбиотических микроорганизмов. Допускается возможность выработки этими клетками TGFβ, а также их родство или идентичность с Th3-клетками. Таким образом, Т- и В-лимфоциты являются истинными иммунокомпетентными клетками. Только Т- и В-лимфоциты способны: Высокоизбирательно (специфически) распознавать антиген с помощью клонально экспрессированных TCR и BCR; Развивать антигенспецифические иммунные реакции, направленные на элиминацию антигена; Создавать клоны себе подобных клеток после стимуляции антигеном; Формировать иммунную память; Развивать иммунную толерантность. NKT-клетки – особая субпопуляция Т-лимфоцитов (а не NK-клеток!). Формируются в процессе Т-лимфопоэза, но на поздних этапах развития приобретающие признаки NK-клеток: на их поверхности представлены комплекс TCR-CD3 и типичные молекулы NK-клеток CD56 и CD16. NKT-клетки относят к клеткам врожденного иммунитета. Помимо цитотоксической функции они выполняют роль практически единственного источника цитокинов (в первую очередь IFNγ) на первом этапе реакции на внедрение патогенов. Кроме того, NKT-клетки способны осуществлять регуляторную функцию, ограничивая интенсивность иммунного ответа, а также аутоагрессию. Если CD8+ в процессе иммунного ответа функционируют как единая субпопуляция, то среди CD4+ клеток выделяют несколько адаптивных субпопуляций. Выделяют 4 адаптивных субпопуляции Th: Th1, Th2, Th17, Treg адаптивные. Th1/Th2дихотомию впервые описали в 1986г. Т. Мосманн и соавт. Они обнаружили, что в процессе активации эти клетки секретируют разный спектр цитокинов. Различие спектра гуморальных продуктов, прежде всего, ключевых цитокинов Th1- и Th2-клеток (соответственно IFNγ и IL4) определяют основную направленность иммунного ответа в направлении клеточной или гуморальной защиты. Открытие адаптивных субпопуляций Т-хелперов создало основу для формирования представлений о различии клеточных механизмов иммунной защиты, в зависимости от локализации патогенна (внутри- или внеклеточно). Определение мембранных маркеров редко используют для дифференцировки Th1 и Th2- лимфоцитов. К таким маркерам относят, прежде всего, хемокиновые рецепторы. Так, например, для Th1 рецепторы, реагирующие, прежде всего, на INFγ-зависимые хемокины. Однако главным подходом при разграничении Th1- и Th2-клеток служит оценка спектра секретируемых ими цитокинов. При дифференцировке Т-хелперов происходит супрессия одних и усиление экспрессии других цитокиновых генов, прежде слабо экспрессированных в Th0-клетках. Th1-лимфоцитыпродуцируютINFγ,IL2,TNFα,TNFβ,IL3,GM-CSF. Th2-лимфоцитыпродуцируютIL4,IL13,IL5,IL6,IL9,IL11,IL21,IL25,IL10,IL3GM-CSF. В этих спектрах есть цитокины, общие для двух линий (например,GM-CSF). Другие цитокины более специфичны для субпопуляций. Среди них есть ключевые: для Th1 – INFγ; дляTh2-IL4.Через цитокины Th1- и Th2-лимфоциты способны ингибировать развитие и функционирование друг друга. Дифференцировка Th1 и Th2 зависит от двух сигналов: Один из них поступает через TCR и «сообщает» о распознавании молекулы в комплексе с MHC; Второй сигнал осуществляют цитокины. К настоящему времени установлено, что основным индуктором Th1-клеток служит IL12. Развитию и поддержанию Th1-ответа способствуют INFγ, IL18, IL23 и IL27. Цитокином, определяющим развитие Th2-клеток, служит только IL4. Роль второстепенных факторов при их развитии играют IL10, IL6, IL2, IL9. Основной источник цитокинов, обеспечивающих дифференцировку Th1 – дендритные клетки. Они выделяют IL12 уже при первом контакте с CD4+ лимфоцитами. При взаимодействии с активированными Th0-клетками они выделяют весь спектр цитокинов, необходимых для развития Th1. Вопрос о цитокиновом обеспечении Th2 более сложен. Источник IL4 до появления Th2 в ходе иммунного ответа не известен. Конститутивная выработка этого цитокина в той или иной степени свойственна тучным клеткам, базофилам, эозинофилам, NK- и NKT- клеткам, но четко не показано, в какой степени она реализуется при иммунном ответе in vivo и какова доступность выделяемого IL4 для Th0-клеток. Помимо свойств цитокинов, вырабатываемых Th1 и Th2, их функция зависит от прямых контактных взаимодействий с клетками-мищенями, выступающих в качестве эффекторных клеток при иммунном ответе. Для Th1 – это макрофаги, а для Th2 – В-лимфоциты. Развитию Th1-клеток способствуют крайние (очень высокие и очень низкие) дозы антигена и его высокое сродство к рецептору, а развитию Th2-клеток – промежуточные дозы антигена и более низкое сродство к рецептору. Кроме того, известно значение корецептора CD4 в выборе пути дифференцировки. При нокауте гена CD4 происходит усиление дифференцировки в направлении Th1. Th17 - (ключевой цитокин IL17, кроме того секретируют IL21 и IL22) дифференцируются из активированных CD4+ клеток независимо от Th1- и Th2-лимфоцитов. Эти клетки могут участвовать как в иммунной защите от патогенов: мобилизуя нейтрофилы, Th17-лимфоциты участвуют в защите от грамотрицательных бактерий и в то же время могут способствовать повреждению тканей при хроническом воспалении. По-видимому, три описанных выше типа адаптивных субпопуляций не исчерпывают всего разнообразия Т-хелперов. В качестве самостоятельной субпопуляции некоторые исследователи рассматривают фолликулярные Т-хелперы гуморального иммунного ответа (CD4+ Tfh-клетки) и др.  1. Больной К., 45 лет, обратился к врачу иммунологу с диагнозом хронический бронхит. В течение последних 3-5 лет отмечаются обострения заболевания до 8-12 раз в год. При обследовании выявлен вторичный иммунодефицит. Врач планирует оценить клеточное звено иммунитета. Укажите маркеры T лимфоцитов. CD16, CD19, CD4 CD2, CD4\ CD3, CD4, CD8 CD16, CD8 2. 55-летнему больному, который имеет злокачественную опухоль легких, назначена иммунограмма. Какой фактор иммунной системы имеет наибольшее значение в противоопухолевом иммунитете? IgМ Циркулирующие иммунные комплексы CD16+ лимфоциты Комплемент IgA Цитотоксины Цитотоксическийиммунныйответпроходитв4этапа: Презентация дендритными клетками антигена CD8+ Т-клеткам, приводящая к их активации; IL2-зависимая пролиферация CD8+ Т-лимфоцитов, аутокринная или индуцируемая CD4+ лимфоцитами; Дифференцировка CD8+ Т-клеток в цитотоксические Т-лимфоциты (CTL), сопутствующая пролиферация; Реализация цитолиза клеток-мишеней. Первые 3 этапа соответствуют индуктивнойфазе иммунного ответа, последняя эффекторной. Индуктивнаяфаза цитотоксическогоиммунногоответа: Дендритные клетки (ДК) после взаимодействия с антигеном под влиянием хемокинов мигрируют в лимфу, одновременно происходит процессинг антигена и экспрессия комплекса антигенный пептид-МНСI на мембране ДК. Затем ДК попадают в Т-зависимые зоны региональных лимфатических узлов. В свою очередь антигенспецифические Т-лимфоциты, непрерывно рециркулируя, с током крови также приходят в Т-зависимые зоны лимфоузлов. В лимфатических узлах происходит взаимодействие ДК как с наивными Т-киллерами, так и с наивными Th0-лимфоцитами. Между ДК и Т-лимфоцитами формируется иммунологический синапс, представляющий зону высокоупорядоченных рецепторных и корецепторных взаимодействий, приводящей к проведению сигналов и активации клеток. ВзаимодействиеДК снаивнымТ-киллером: С комплексом антиген МНСI (представленном на мембране ДК) взаимодействуют TCR и корецепторная молекула CD8 на Т-лимфоците. В результате происходит передача сигнала внутрь лимфоцита и его активация. Параллельно с этим экспрессируется рецептор к IL2 и начинается секреция этого цитокина самим Т-лимфоцитом, что по механизму обратной связи продолжает активировать Т-клетку, которая затем вступает в стадию пролиферации. ВзаимодействиеДК сTh0: TCR взаимодействует с антигеном, встроенным в молекулу МНСII на поверхности ДК. ДК начинает синтезировать IL12, который вместе с IFNγ способствует дифференцировке Th0 в Th1-лимфоцит. Th1-клетки включают продукцию IL2, который действует на Т-киллеры и способствует их дифференцировке в зрелые цитотоксические лимфоциты (ЦТЛ). Заключительной стадией индуктивной фазы КИО является дифференцировка Т-киллеров с формированием клона специфических ЦТЛ, которые способны непосредственно взаимодействовать с инфицированными клетками организма и подвергать их цитолизу. Эффекторнаяфазацитотоксическогоиммунногоответа: Цитолиз инфицированных клеток может происходить посредством следующих механизмов: Перфорин-гранзимовый механизм цитотоксичности; Fas-опосредованный апоптоз; Цитокиновый механизм цитотоксичности. Перфорин-гранзимовыймеханизмцитотоксичности: Цитотоксическое действие ЦТЛ включает следующие этапы: Распознавание клетки-мишени; Формирование контакта ЦТЛ и клетки-мишени с их поляризацией; Экзоцитоз гранул (программирование лизиса); Индукция гибели клетки-мишени. Т-цитотоксический лимфоцит распознает молекулы МНСI класса в комплексе с антигеном на мишенях с формированием цитотоксического иммунного синапса. Эти взаимодействия приводят к активации ЦТЛ и экзоцитозу содержимого гранул (перфорин и гранзимы) в зону контакта между клетками. Перфорин представляет собой гидрофобный белок, который встраивается в мембрану клетки-мишени (в присутствии ионов Са2+) и образует канал. Через эти каналы в клетку проникают гранзимы В-протеазы, индуцирующие каскад реакций с участием сериновых протеаз, ведущих к запуску апоптоза клетки-мишени. Fas-опосредованныйапоптоз: При действии ЦТЛ апоптоз может происходить с участием Fas-лиганда, экспрессируемого Т-клеткой, и Fas-рецептора клетки-мишени. Экспрессии Fas-рецептора на клетки-мишени способствует инфицирование её вирусом. При взаимодействии лиганд-рецептор активируются внутриклеточные каспазы, приводящие клетку к апоптозу. Цитокиновыймеханизмцитотоксичности: В этом случае цитолиз обеспечивается посредством взаимодействия ФНО-α, синтезируемого ЦТЛ, с соответствующими рецепторами на клетках-мишенях. Сигнал передается через домены смерти и приводит к развитию апоптоза по механизму, схожему с таковым при Fas-цитолизе. Спустя 7-10 дней после распознавания антигена ЦТЛ подвергается апоптозу. Через 2 недели после этого формируется популяция Т-клеток памяти. Цитокины В последние годы среди различных эндогенных механизмов иммунорегуляции особое внимание привлекают цитокины. Цитокины – это регуляторные молекулы пептидной природы, продуцируемые в основном активированными (!) лейкоцитами. Цитокины, вырабатываемые лимфоцитами, иногда называются лимфокинами, а вырабатываемые макрофагами — монокинами. Но такое деление условно, т.к. один и тот же цитокин может продуцироваться различными клетками и, как теперь установлено, не обязательно лимфоци-тами и макрофагами. Продуцировать цитокины могут клетки соединительной ткани, эпителия и эндотелия, правда, в небольших количествах. По химической структуре цитокины – это низкомолекулярные белки, полипептиды, гликопротеиды, являющиеся биологически активными молекулами, способными влиять на процессы клеточной пролиферации, дифференцировки и функциональную активность клеток. Они обеспечивают взаимосвязь иммунокомпетентных клеток (между собой), а также связь иммунокомпетентных клеток с клетками других систем организма (гемопоэза, воспаления). Каждый цитокин служит индуктором экспрессии каскада других цитокинов и/или их рецепторов. В условиях in vivo почти не встречается изолированной продукции индивидуальных цитокинов. Любой индуктор синтеза цитокинов вызывает продукцию серии разных, но взаимосвязанных молекул. На этом базируется концепция цитокиновой регуляторной сети, которая объединяет позитивные и негативные эффекты самих цитокинов в рамках определенного биологического ответа. Все цитокины дей-ствуют на клетку мишень через специфические цитокиновые рецепторы. Цитокины разделяют на несколько групп: · Интерфероны (ИНФ) – цитокины с противовирусной активностью; · Интерлейкины (ИЛ, IL) – факторы взаимодействия между лейкоцитами; · Факторы некроза опухоли (ФНО / TNF - α, -β ) ; · Колониестимулирующие факторы (КСФ) – гемопоэтические цитокины; · Хемокины (ХК) – хемотаксические цитокины. · Факторы роста – регуляторы роста, дифференцировки и активности разных клеток (фактор роста фибробластов; эпидермиса; эндотелиальных клеток, трансформирующий фактор роста). Интерфероны (!) – группа низкомолекулярных биологически активных пептидов, белков, которых в настоящее время известно более 20. Выделено четыре вида интерферонов (α, β, γ, ω), различающихся происхождением, некоторыми химическими и биологическими свойствами. Они объединены в два типа: I тип – альфа-, бета- и омега - интерфероны, 2 тип – гамма-интерферон. α-ИНТЕРФЕРОН (лейкоцитарный) продуцируется лимфоцитами, макрофагами, некоторыми эпителиальными клетками после индукции разными антигенами (индукторамиинтерферона). К последним относятся вирусы, в меньшей степени риккетсии, бактерии, белковые полимеры, синтетические анионы. (В настоящее время описано 24 подтипа интерферона-α.) Интерферон-α ингибирует рост вирусов и других внутриклеточных паразитов. Он ингибирует соединение вирусной РНК с рибосомами клетки, что затрудняет или вовсе исключает возможность репродукции вируса в клетке, а также тормозит пролиферацию нормальных клеток-фибробластов, гемопоэтических клеток (антипролиферативное, тумороцидное действие). β-ИНТЕРФЕРОН (фибробластный) — вырабатывается фибробластами. Усиливает экспрессию HLA- антигенов на клетках, активирует естественные клетки-киллеры (ЕК) и фагоциты. Доказано структурное родство альфа- и бета- интерферонов, а также их функциональная схожесть. Оба вида интерферонов индуцируются вирусами и взаимодействуют с одними и теми же клеточными рецепторами. Основной эффект α- и β- интерферонов – противовирусный и противоопухолевый. ω (омега) – изучен слабо. γ-ИНТЕРФЕРОН (иммунный) — в основном его продуцируют различные субклассы лимфоцитов (CD4 клетки - Т-хелперы(Th1), CD8-клетки и NK). Его секреция наблюдается только после стимуляции клеток антигенами или митогенами. Он усиливает противовирусное и антипролиферативное действие интерферонов-α и -β. Кроме того он является важнейшим иммунорегулятором. Гамма-интерферон усиливает синтез HLA-антигенов клетками, что приводит к ускорению процессов распознавания и переработки антигенов, активирует естественные киллеры, Т-лимфоциты, макрофаги, адгезию лейкоцитов и моноцитов, фагоцитоз, снижают активность В-лимфоцитов и продукцию IgE, подавляет продукцию цитокинов Th-2 клеток. Способностью вырабатывать интерферон в той или иной степени обладают все клетки организма. Наиболее сильными продуцентами интерферона являются иммунокомпетентные клетки. Система интерферона не имеет ни специализированных клеток, ни специализированных органов, так как каждая клетка может быть заражена вирусом и должна иметь систему распознавания и элиминации чужеродной генетической информации, т.е. вирусной нуклеиновой кислоты. Эффект интерферонов неспецифичен. В настоящее время в клинической практике используется большое количество препаратов интерферона и индукторов интерферона. Следует напомнить, что клиническое применение находят рекомбинантные препараты интерферонов α («Роферон А», «Интрон А», «Берофор», «Реаферон», «Реальдирон», «Виферон» суппоз.), которые применяются как при вирусных инфекциях, так и в онкологической практике, с целью иммуностимуляции, а так же в связи с наличием у них антипролиферативного эффекта. Интерлейкины ИНТЕРЛЕЙКИНЫ — высокоактивные биологические вещества. Интерлейкины проявляют многообразную биологическую активность и воздействуют на иммунокомпетентные и вспомогательные клетки, а также на ткани. Они способны вызывать воспалительную реакцию, индуцировать бласттрансформацию, стимулировать митозы, тормозить миграцию, вызывать агрегацию и усиливать фагоцитарную активность макрофагов, оказывать цитотоксический и интерфероноподобный эффект, стимулировать пролиферацию лимфоидных клеток, синтез специфических антител. Они влияют на кооперативное взаимодействие макрофагов и лимфоцитов. В связи с интенсивным изучением и главное клиническим применением интерлейкинов, даём краткую характеристику этих медиаторов. По современной классификации, как указывалось выше, ИНТЕРЛЕЙКИНЫ входят в состав ЦИТОКИНОВ — класс сигнальных молекул, принимающих участие в различного рода межклеточных взаимодействиях и продуцируются они активированными клетками. ИНТЕРЛЕЙКИН 1 — продуцируется главным образом моноцитами и макрофагами. В настоящее время под названием ИЛ-1 объединены два полипептида обозначающиеся ИЛ-1α и ИЛ-1β. У человека главной формой, секретируемого активированными макрофагами/моноцитами, является ИЛ-1β. ИЛ-1α существует в основном в виде мембранной формы. Основные эффекты — активация В- и Т-лимфоцитов, стимуляция стволовых клеток. Усиливает пролиферацию только преактивированных антигеном лимфоцитов, т.е. играет роль второго сигнала в стимуляции пролиферации лимфоцитов. (Вспомните занятие 3.) ИЛ-1 является главным медиатором развития местной воспалительной реакции. Пирогенность является одним из важных его свойств. ИЛ-1 очень быстро активирует практически все типы клеток, участвующих в формировании локальной воспалительной реакции, включая фибробласты, эндотелий, резидентные макрофаги и все типы лейкоцитов крови. ИЛ-1 регулирует функции эндотелия и системы свертывания крови индуцируя прокоагулянтную активность, синтез провоспалительных цитокинов, экспрессию на поверхности эндотелия адгезионных молекул, обеспечивающих прикрепление нейтрофильных лейкоцитов и лимфоцитов, стимулирует выход нейтрофилов в очаг воспаления. ИЛ-1 влияет на ПМЯЛ активируя их активность: усиливая адгезию, хемотаксис, фагоцитоз, продукцию свободных форм кислорода. Прямо не влияя на перечисленные функции нейтрофильных гранулоцитов, проявляет свое действие опосредованно путем индукции синтеза макрофагами, эндотелиальными клетками и фибробластами других цитокинов, главным образом ИЛ-8. Резюмируя следует отметить, что ИЛ-1 является индуцибельным белком, синтез которого начинается в ответ на внедрение микроорганизмов либо повреждение тканей и необходим для развития и осуществления всего комплекса защитных реакций, именуемых острофазным воспалительным ответом. ИНТЕРЛЕЙКИН 2 — продуцируется активированными Т-хелперами (Th1). Проявляет активность после связывания со специфическим клеточным рецептором ИЛ-2R. ИЛ-2 оказывает пролиферирующее и активирующее воздействие на Т-лимфоциты (киллеры) и В-клетки, а также на натуральные киллеры. ИЛ-2 также принимает участие во всех воспалительных и аллергических реакциях, противоопухолевом иммунитете. Недавно появились сообщения о существовании сходных циркулирующих в крови рецепторах (при ВИЧ- инфекции, раке, отторжении трансплантатов, артрите отмечается существенное увеличение уровня свободного рецептора). Подумайте к чему это приводит? ИЛ-2 содействует активности LAK-клеток («лимфокин-активированных киллеров») и TIL-клеток («тумор-инфильтрирующих лимфоцитов»). ИНТЕРЛЕЙКИН3 продуцируется главным образом Т-клетками. Основное действие — содействие пролиферации и дифференциации гемопоэтических клеток, т.е. важный гемопоэтический фактор. Его называют мультиростковым колониестимулирующим фактором. ИНТЕРЛЕЙКИН 4 продуцируется Т-лимфоцитами и в частности Th 2 (второго типа). Стимулирует ранние этапы дифференцировки В-лимфоцитов, синтез Ig E B-клетками. ИНТЕРЛЕЙКИН5 продуцируется Т-клетками (Th2). Наделен преимущественно двумя видами активности: способностью содействовать росту эозинофилов и способностью активировать В-клетки. ИНТЕРЛЕЙКИН6 продуцируется Т-лимфоцитами, моноцитами, макрофагами. Ведет себя одновременно и как гемопоэтический фактор роста, и как лимфокин ( в последнем случае имеют в виду усиление дифференциации В-лимфоцитов и усиление активации Т-лимфоцитов). ИНТЕРЛЕЙКИН7 продуцируется клетками стромы костного мозга, селезенки, тимуса и других органов. Способствует пролиферации предшественников В- и Т-лимфоцитов. ИНТЕРЛЕЙКИН8 продуцируется моноцитами, моноцитами, фибробластами эндотелиальными клетками. Выступает в роли активатора нейтрофилов, т.к. является хемокином, т.е. эндогенным хемоаттрактантом. Стимулирует направленное движение различных типов лейкоцитов, усиливает генерацию активных форм кислорода. ИНТЕРЛЕЙКИН 9 продуцируется Т-клетками, в частности Т-хелперами. Способствует дифференциации и пролиферации В- и Т-клеток. Сходное влияние оказывает также на красный росток костного мозга. ИНТЕРЛЕЙКИН 10 продуцируется Т-лимфоцитами (CD8; Th-2), В-клетками и макрофагами. Включен в так называемый down regulation высвобождения остальных цитокинов – регуляция синтеза цитокинов. Он подавляет образование ИЛ-1, ИЛ-2, ИЛ-6, ФНО. Подавляет активацию Th1типа. Вспомните с прошлого занятия о Th 1и 2 типа. ИЛ-11 - вырабатывается стромальными клетками костного мозга, фибробластами. Относится к регуляторам гемопоэза и имеет сходный эффект с ИЛ-6. Стимулирует гемопоэз мегакариоцитов и эритроцитов. ИЛ-12 - гетеродимер, источником являются активированные В-клетки, моноциты, макрофаги. Является ключевым цитокином для усиления клеточно-опосредованногоответа вызывает пролиферацию активированных Т-лимфоцитов и ЕК, усиливает действие ИЛ-2, стимулирует Т-хелперы 1-го типа и продукцию γ-интерферона, ингибирует синтез IgE. Активирует эффективную противоинфекционную защиту против вирусов, бактерий, грибов и простейших. ИЛ-13 - выделяется Т-лимфоцитами (Th2), индуцирует дифференцировку В-клеток, секрецию IgM, IgE, IgG4. Подавляет синтез активированными макрофагами ИЛ-1, ИЛ-6, ФНО. ИЛ-14 - выделяется активированными Т-лимфоцитами, усиливает аутокринно пролиферацию В- лимфоцитов в В-лимфомах ИЛ-15 - выделяется макрофагами, активирует пролиферацию Т-лимфоцитов, Т-хелперов 1 типа, дифференцировку их в киллеры, активирует ЕК. ИЛ-16 - катионный гомотетрамер, состоит из 130 аминокислот, ММ 14КД, является лигандом, хемотаксическим и активирующим фактором для CD4+ - моноцитов, стимулирует их миграцию и экспрессию ИЛ 2 – рецепторов (CD25) на лимфоцитах. Выделяется под влиянием антигенов CD8+ CD4+ Т-клетками, а также эпителием бронхов и эозинофилами при действии гистамина. ТФРβ – трансформирующий фактор роста β. Подавляет пролиферацию Т- и В-лимфоцитов. Отменяя эффекты многих цитокинов, является супрессорнымфактором. ФНОα (TNF-α) - факторнекрозаопухоли-альфа, кахексин, выделяется макрофагами, Т- и В- лимфоцитами, нейтрофилами, стимулирует воспаление, активирует и повреждает клетки, вызывает лихорадку (пироген). Получил своё название из-за способности ингибировать рост некоторых опухолей. Является одним из основных провоспалительных цитокинов. Его большие концентрации обуславливают токсический шок. Кроме того, через свои рецепторы вызывает апоптоз. ФНОβ (синоним: лимфотоксин) - секретируют Т- и В-лимфоциты, медиатор воспаления, повреждает клетки, вызывая апоптоз. |
