Тема 1.
Техника гистологического исследования

В гистологии, цитологии и эмбриологии существует много методов исследования.
Здесь рассматриваются лишь те, которые связаны со световой и электронной микроскопией мёртвых (фиксированных) клеток и тканей.

1.1. Световая микроскопия

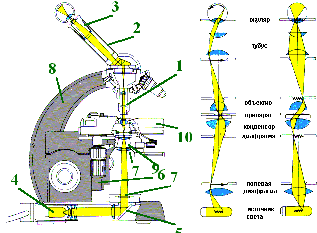
1.1.1. Устройство микроскопа
В микроскоп входят 3 системы -
 оптическая, оптическая,
 осветительная и осветительная и
 механическая. механическая.
1. Оптическая система включает объектив и окуляр.
а) Объектив (1) - это система линз, вставляемая в тубус (2) снизу и непосредственно направляемая на объект (отсюда - и название).
|
Схема - строение светового микроскопа.
Полный размер
|
 Обычные увеличения объектива: Обычные увеличения объектива:
 8 , 8 ,  20 , 20 , 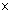 40 (сухие объективы), 40 (сухие объективы),
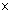 90 (иммерсионный объектив). 90 (иммерсионный объектив).
При использовании последнего объектива его следует погрузить в каплю кедрового (иммерсионного) масла, нанесённую на покровное стекло препарата.
б) Окуляр (3) вставляется в тубус сверху. Применяются окуляры с увеличением
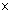 7, 7, 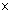 10, 10, 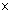 15. 15.
в) Результирующее увеличение микроскопа - произведение увеличений объектива и окуляра, например:
20  10 = 200 раз. 10 = 200 раз.
г) Таким образом, функция оптической системы -
 формирование увеличенного изображения препарата на сетчатке глаза наблюдателя. формирование увеличенного изображения препарата на сетчатке глаза наблюдателя.
|
2. Осветительная система - источник света, зеркало, конденсор и диафрагма.
а) Источник света (4) может быть встроен в микроскоп, а может находиться и вне микроскопа (пример - обычная настольная лампа).
б) Зеркало (5) собирает лучи от источника и направляет их на препарат снизу.
|

|
 Одна поверхность зеркала - плоская, вторая - вогнутая; Одна поверхность зеркала - плоская, вторая - вогнутая;
 последняя используется при искусственном освещении. последняя используется при искусственном освещении.
в) Конденсор (6) состоит из линз, которые фокусируют лучи света на препарате. Поднимая и опуская конденсор (с помощью винта), можно настраивать фокусировку лучей.
г) Диафрагма (7) вмонтирована в конденсор; это система непрозрачных пластинок с отверстием посередине.
 Она ограничивает световой поток, падающий на препарат. Она ограничивает световой поток, падающий на препарат.
 При использовании объективов с большим увеличением отверстие диафрагмы следует уменьшить - для ослабления сферической аберрации. При использовании объективов с большим увеличением отверстие диафрагмы следует уменьшить - для ослабления сферической аберрации.
|
3. Механическая система - тубус (2), штатив (8), колонка (9) и предметный столик (10).
а) С колонкой связаны макро- и микрометрический винты.
Они поднимают и опускают штатив с тубусом для фокусировки изображения объекта на сетчатке глаза наблюдателя.
|

|
 Макровинт используется при работе на малом увеличении, Макровинт используется при работе на малом увеличении,
 а микровинт - на большом. а микровинт - на большом.
б) Предметный столик может перемещаться в горизонтальной плоскости, что позволяет менять участки препарата, попадающие в поле зрения.
|
В итоге, световые лучи проходят следующий путь:
 источник света (4) источник света (4)  зеркало (5) зеркало (5)  конденсор (6) конденсор (6)  диафрагма (7) диафрагма (7)  препарат препарат  объектив (1) объектив (1)  тубус (2) тубус (2)  окуляр (3). окуляр (3).
Т.е. микроскопия ведётся в проходящем свете, для чего препарат должен быть достаточно тонким.
 Заметим также, что микроскоп даёт перевёрнутое изображение объекта. Заметим также, что микроскоп даёт перевёрнутое изображение объекта.
|

1.1.2. Приготовление гистологического препарата
1. По характеру взятого материала различают следующие виды гистологических препаратов:
а) срезы органов (толщиной 5-15 нм),
б) мазки (крови, костного мозга и т.д.) и отпечатки (напр., селезёнки),
в) плёнки (брюшины, мягкой мозговой оболочки), или тотальные препараты
Чаще всего используются срезы.
2. Приготовление препарата обычно включает 5 следующих этапов:
а) взятие и фиксация материала,
б) обезвоживание и уплотнение материала,
в) приготовление срезов,
г) окрашивание препаратов и
д) заключение в консервирующую среду.
|

1.1.2.1. Взятие и фиксация материала
1. Из соответствующего органа вырезают небольшие кусочки (0,5 x 1 x 1 см) и погружают их в фиксатор (формалин, метанол и т.д.) - обычно на 24 ч.
2. Фиксация производится для предупреждения процессов аутолиза (самопереваривания) тканей.
Это достигается путём денатурации (коагуляции) белков.
3. После фиксации образцы промывают проточной водой в течение нескольких часов.
|

1.1.2.2. Обезвоживание и уплотнение материала
1. Затем образцы уплотняют - чтобы в последующем их можно было резать на микротоме.
Часто в качестве уплотнителя используют парафин или целлоидин.
2. Предварительно образцы обезвоживают (иначе гидрофобный уплотнитель не сможет проникнуть в ткань).
а) Для этого их “проводят” по батарее спиртов -
 70 % , 80 % , 96 % , 100 % этанол - 70 % , 80 % , 96 % , 100 % этанол -
до 24 часов (в зависимости от размера образца) в каждом спирту.
б) Т.к. парафин не растворим и в этаноле, образцы выдерживают потом в смеси этанол-ксилол и в чистом ксилоле.
3. Заливка: помещают образцы в смесь ксилол-парафин и затем в жидкий парафин
на 1-2 ч при 52-56о С.
 Дают парафину, остывая, затвердеть; Дают парафину, остывая, затвердеть;
 вырезают из него блок с заключённым образцом и вырезают из него блок с заключённым образцом и
 закрепляют на деревянном кубике. закрепляют на деревянном кубике.
|

1.1.2.3. Приготовление срезов
1. Кубики вставляют в специальный прибор - микротом, - служащий для приготовления срезов.
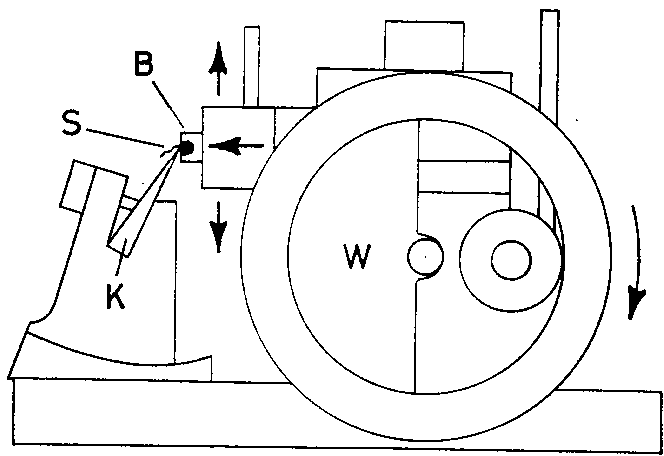
2. а) С помощью микрометрической механической системы объектодержатель вместе с кубиком перемещается за каждый шаг на определённое расстояние (напр., 10 мкм).
б) А микротомный нож, направляемый под углом к поверхности парафинового блока, срезает с него тонкой слой органа (срез) заданной толщины.
3. Срезы помещают на поверхность тёплой воды для их расправления, а затем - на предметное стекло.
|

1.1.2.4. Окрашивание препаратов
1. Перед окрашиванием образцы освобождают от парафина, проводя по батарее растворителей:
 ксилол, спирт 100 %, 96 %, 80 %, 70 %, 60 %, вода (по 2-5 мин) ксилол, спирт 100 %, 96 %, 80 %, 70 %, 60 %, вода (по 2-5 мин)
(Этот ряд кончается водой в том случае, если затем используется водорастворимый краситель.)
2. Для окрашивания предметные стёкла со срезами
 помещают на определённое время в раствор красителя, помещают на определённое время в раствор красителя,
 промывают водой, промывают водой,
 обрабатывают раствором другого красителя (если таковой используется тоже) и обрабатывают раствором другого красителя (если таковой используется тоже) и
 вновь промывают водой. вновь промывают водой.
|

1.1.2.5. Заключение препарата в консервирующую среду
1. Окрашенный препарат
 опять обезвоживают (проводя по батарее спиртов с возрастающей концентрацией), опять обезвоживают (проводя по батарее спиртов с возрастающей концентрацией),
 а затем просветляют (в карбол-ксилоле и ксилоле) - для удаления лишней краски. а затем просветляют (в карбол-ксилоле и ксилоле) - для удаления лишней краски.
2. Наконец, на препарат наносят каплю канадского бальзама (в случае среза) или
кедрового масла (на мазки крови) и накрывают покровным стеклом.
|

1.1.2.6. Мазки и тотальные препараты: особенности приготовления
1. Примеры тотального препарата - участки сальника или мягкой мозговой оболочки, растянутые на предметном стекле.
2. В подобных случаях, а также при приготовлении мазков, из 5-и перечисленных в п. 1.1.2. этапов опускаются два -
 уплотнение материала и уплотнение материала и
 приготовление среза (с последующим освобождением от уплотнителя). приготовление среза (с последующим освобождением от уплотнителя).
3. Остаются:
 фиксация, фиксация,
 окраска и окраска и
 заключение в консервирующую среду. заключение в консервирующую среду.
|
 В остальных же случаях (т.е. при получении срезов) приготовление гистологического препарата - весьма долгая и трудоёмкая процедура. В остальных же случаях (т.е. при получении срезов) приготовление гистологического препарата - весьма долгая и трудоёмкая процедура.
 Но при правильном её выполнении полученный препарат может храниться неопределённо долгое время. Но при правильном её выполнении полученный препарат может храниться неопределённо долгое время.

1.1.2.7. Экспресс-метод приготовления срезов
1. В ряде случаев (при экспресс-диагностике в ходе хирургической операции или при гистохимическом исследовании) применяют иную методику приготовления срезов:
 изучаемый образец органа замораживают (без фиксации) углекислотой или жидким азотом; изучаемый образец органа замораживают (без фиксации) углекислотой или жидким азотом;
 это позволяет его сразу резать (получая тонкие срезы), минуя проводку по спиртам и заливку. это позволяет его сразу резать (получая тонкие срезы), минуя проводку по спиртам и заливку.
2. Но резка должна производиться в криостате или на специальном замораживающем микротоме.
|

1.1.3. Методы окрашивания гистологических препаратов

1.1.3.1. Типы красителей
Все красители, используемые в гистологической технике, подразделяются на 3 типа.-
Тип
красителя
|
Пример
|
Окрашиваемые структуры
|
Кислые красители
|
Кислоты и кислые соли :
 эозин (искусственная краска; название - от греч. эос - заря); эозин (искусственная краска; название - от греч. эос - заря);
 кислый фуксин. кислый фуксин.
|
а) Окрашиваемые структуры называются оксифильными (имеющими сродство к кислым красителям).
б) Это белковые компоненты цитоплазмы и неклеточные структуры (коллагеновые волокна).
|
Основные красители
|
Основные соли :
 гематоксилин гематоксилин
(точнее, продукт его окисления - гематеин);
 азур 2, кармин. азур 2, кармин.
|
а) Красящиеся структуры -
базофильные (сродство к основным красителям).
б) Это структуры, богатые нуклеиновыми или иными кислотами -
 ядра, ядра,
 рибосомы, рибосомы,
 аморфный компонент межклеточного вещества. аморфный компонент межклеточного вещества.
|
Нейтраль-
ные красители
|
Смесь двух красителей:
 основного (азур 2) и основного (азур 2) и
 кислого (эозин). кислого (эозин).
|
а) Структуры, воспринимающие кислые красители, окрасятся эозином;
 пример - специфические гранулы в эозинофильных лейкоцитах. пример - специфические гранулы в эозинофильных лейкоцитах.
б) Ядра всех клеток окрашиваются азуром 2.
|
Индиффе-
рентные
красители
|
Судан III,
судан IV
|
Суданом окрашиваются жировые капли (в которых он растворяется).
|
Существует большое количество различных способов окраски.
Те из них, которые встречаются в нашем курсе, перечислены ниже.

1.1.3.2. Общие методы окраски
I. Окраска гематоксилин-эозином
1.а) Самый распространённый метод окраски.
б) Сочетает основной и кислый красители.
в) Поэтому позволяет выявить почти все клетки и многие неклеточные структуры.
2. При этом
 ядра прокрашиваются гематоксилином, т.е. приобретают сине-фиолетовый цвет, ядра прокрашиваются гематоксилином, т.е. приобретают сине-фиолетовый цвет,
 а цитоплазма красится эозином в желтовато-розовый цвет. а цитоплазма красится эозином в желтовато-розовый цвет.
3. Замечание: используемый гематоксилин готовится по методу Эрлиха: окисляется до гематеина калийными квасцами.
|
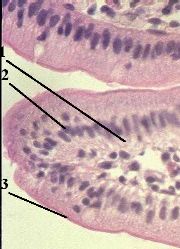
1. Препарат - срез тонкой кишки. Окраска гематоксилин-эозином. (*)
а) На снимке видны кишечные ворсинки (1): они находятся на внутренней поверхности тонкой кишки.
б) Ворсинки покрыты одним слоем эпителиальных клеток.
в) Ядра (2) этих клеток – фиолетового,
а цитоплазма (3) – розового цвета.
|
Полный размер
|
(*) Препараты, отмеченные в теме 1 звёздочкой и имеющие порядковый номер, изучаются на практическом занятии, а также входят в тесты по этой теме.
II. Окраска мазков по Романовскому
1. Применяется для окраски мазков крови и красного костного мозга. Здесь тоже используются 2 красителя:
 основной – азур II, окрашивающий базофильные структуры в тёмно-синий цвет, основной – азур II, окрашивающий базофильные структуры в тёмно-синий цвет,
 и кислый – эозин, красящий оксифильные структуры в ярко-розовый цвет. и кислый – эозин, красящий оксифильные структуры в ярко-розовый цвет.
2. Отличия от приготовления срезов таковы:
 фиксацию мазков проводят чистым метанолом; фиксацию мазков проводят чистым метанолом;
 окрашивание продолжают всего 30-45 мин, а не несколько часов; окрашивание продолжают всего 30-45 мин, а не несколько часов;
 для заключения под покровное стекло используют кедровое масло, а не канадский бальзам. для заключения под покровное стекло используют кедровое масло, а не канадский бальзам.
3. В результате
 эритроциты приобретают розовый цвет, эритроциты приобретают розовый цвет,
 цитоплазма большинства лейкоцитов – голубой или синий цвет, цитоплазма большинства лейкоцитов – голубой или синий цвет,
 цитоплазматические гранулы окрашиваются в зависимости от их природы. цитоплазматические гранулы окрашиваются в зависимости от их природы.
|
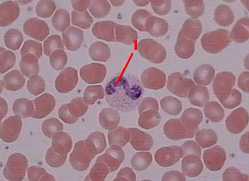
Препарат – мазок крови.
Среди многочисленных эритроцитов видны:
 лейкоцит (1) с очень мелкой нейтрофильной (фиолетово-розовой) зернистостью в цитоплазме, лейкоцит (1) с очень мелкой нейтрофильной (фиолетово-розовой) зернистостью в цитоплазме,
 а также гораздо более мелкие тромбоциты. а также гораздо более мелкие тромбоциты.
|
|
III. Окраска железным гематоксилином (по методу Генденгайна)
1. Препарат
 предварительно обрабатывают (протравляют) железноаммиачными квасцами, предварительно обрабатывают (протравляют) железноаммиачными квасцами,
 а потом обрабатывают гематоксилином. а потом обрабатывают гематоксилином.
2. Структуры приобретают коричневато-серый цвет.
3. Хорошо выявляются
|
 структуры ядра, структуры ядра,
 границы клеток, границы клеток,
 мышечные волокна. мышечные волокна.
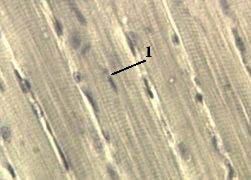
Препарат - срез языка.
В мышечных волокнах видны ядра (1) и отчётливая поперечная исчерченность.
|
|

1.1.3.3. Выявление неклеточных структур соединительной ткани
I. Выявление коллагеновых волокон
А. Окраска по методу Маллори.
1. Краситель – смеськислого фуксина, анилинового синего и оранжевого G.
2. Коллагеновые волокна окрашиваются в синий цвет.
|
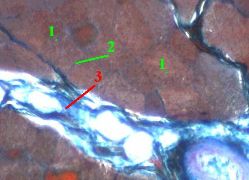
Препарат - срез мышцы.
 Мышечные волокна (1) – розовые, Мышечные волокна (1) – розовые,
 а прослойки соединительной ткани (2 и 3) между ними – синие. а прослойки соединительной ткани (2 и 3) между ними – синие.
|
|
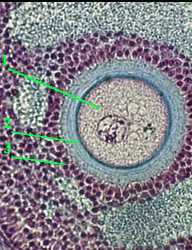
2. Препарат - срез яичника кролика. Окраска по Маллори. (*)
а) На снимке - женская половая клетка (ооцит), находящаяся в фолликуле яичника.
 Цитоплазма (1) клетки окрашена в слабо-розовый, Цитоплазма (1) клетки окрашена в слабо-розовый,
 окружающая её блестящая оболочка (2) - в сине-голубой, окружающая её блестящая оболочка (2) - в сине-голубой,
 а ядра фолликулярных клеток (3) - в фиолетовый цвет. а ядра фолликулярных клеток (3) - в фиолетовый цвет.
|
Полный размер
|
б) Синий цвет блестящей оболочки свидетельствует о том, что в ней, помимо прочих компонентов, содержатся коллагеновые волокна.
3. Окраска по Маллори используется не только для выявления компонентов соединительной ткани, но и в иных целях –
 например, для дифференциации эндокринных клеток гипофиза. например, для дифференциации эндокринных клеток гипофиза.
|
Б. Окраска по методу Ван Гизона.
Красители – пикриновая кислота и кислый фуксин:
 коллагеновые волокна окрашиваются в ярко-красный цвет, коллагеновые волокна окрашиваются в ярко-красный цвет,
 а элементы других тканей (напр., мышечные волокна) – в жёлтый цвет. а элементы других тканей (напр., мышечные волокна) – в жёлтый цвет.
|
II. Выявление ретикулярных волокон –
импрегнация серебром.
1. Препарат обрабатывают аммиачным раствором серебра, а затем – восстановителями.
2. Выделяющееся серебро осаждается на ретикулярных (аргирофильных) волокнах(богатых SH-группами),
и волокнаприобретают чёрный цвет.
|
Препарат - срез лимфоузла.
Видны многочисленные ретикулярные волокна (1), образующие густую сеть.
|
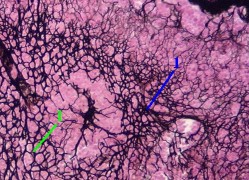
|
III. Выявление эластических элементов
А. Окраска орсеином:
 эластические волокна и мембраны(если таковые имеются) приобретают вишнёвый цвет; эластические волокна и мембраны(если таковые имеются) приобретают вишнёвый цвет;
 остальные структуры – слабо-розовый. остальные структуры – слабо-розовый.
|
Препарат - срез аорты.
В её средней оболочке (II) обнаруживаются многочисленные эластические мембраны (1) – в виде толстых извилистых линий, расположенных концентрически.
|
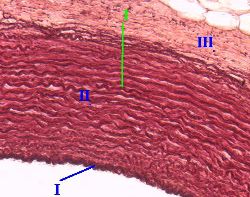
|
Б. Окраска пикрофуксином и гематоксилином:
 эластические волокна окрашиваются в жёлтый цвет, эластические волокна окрашиваются в жёлтый цвет,
 коллагеновые волокна – в красный цвет, коллагеновые волокна – в красный цвет,
 ядра клеток – в фиолетовый цвет. ядра клеток – в фиолетовый цвет.
|
Препарат - срез эластической связки.
Видны пучки эластических волокон (1) и между ними – клетки (фиброциты) (2).
|
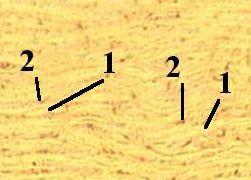
|
IV. Выявление элементов костной ткани –
окраска по методу Шморля
1. Вначале кусочек кости для размягчения подвергают декальцинации (с помощью кислоты).
2. Краситель – раствор тионина.
3. Стенки костных полостей и канальцев (выстланные сетью коллагеновых волокон) окрашиваются в тёмно-коричневый цвет; остальной фон – светло-коричневый.
|
3. Препарат - срез трубчатой кости. Окраска по Шморлю. (*)
В костном веществе видны
 костные полости (1), содержащие тела костных клеток (остеоцитов), костные полости (1), содержащие тела костных клеток (остеоцитов),
 и костные канальцы (2), содержащие отростки остеоцитов. и костные канальцы (2), содержащие отростки остеоцитов.
|
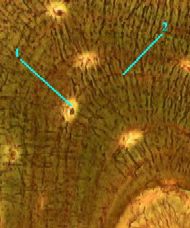
Полный размер
|

1.1.3.4. Выявление элементов нервной системы
I. Выявление клеток нервной системы и их отростков –
импрегнация нитратом серебра
1. В этом методе
 фиксацию материала в формалине проводят не менее 7 дней, фиксацию материала в формалине проводят не менее 7 дней,
 а уплотнение образца осуществляют путём замораживания. а уплотнение образца осуществляют путём замораживания.
2. При окрашивании срез обрабатывают растворами
 азотнокислого серебра, азотнокислого серебра,
 формалина, формалина,
 аммиачного серебра. аммиачного серебра.
|
3. Клетки и волокна нервной системы окрашиваются в чёрный цвет, а окружающие ткани – в светло-коричневый цвет.
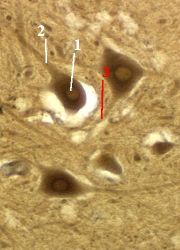
Препарат - срез спинного мозга.
Видны нервные клетки, имеющие
 тёмную цитоплазму, тёмную цитоплазму,
 более светлое ядро (1) и более светлое ядро (1) и
 отростки (2 и 3). отростки (2 и 3).
|
|
II. Выявление базофильных структур в цитоплазме нейронов –
окраска по методу Ниссля
1. Красителем служит толуидиновый синий, окрашивающий умеренно базофильные соединения в синий цвет.
2. Таким образом в цитоплазме нервных клеток обнаруживаются глыбки базофильного вещества (т.н. субстанция Ниссля).
|
Препарат - срез спинного мозга.
Вышеуказанные глыбки содержатся в теле (1) нейрона и в некоторых отростках (2).
|

|
III. Выявление миелиновых нервных волокон –
фиксация или импрегнация осмием
а) Метод применим для выявления всех структур, богатых липидами или жирами, – мембран, жировых или липидных капель и т.д.
б) Растворяя в себе осмиевую кислоту, эти структуры приобретают чёрный цвет.
|
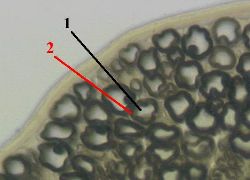
Препарат - поперечный срез нерва.
а) Видны поперечные срезы миелиновых нервных волокон.
б) У каждого из них светлый осевой цилиндр (1) окружён толстой миелиновой оболочкой (2).
|
|
в) Последняя имеет мембранную природу и потому – осмиофильна.
|

1.1.4. Гистохимические методы исследования
а) Гистохимические методы основаны на специфической реакции между химическим реактивом и определённым компонентом препарата.
б) Образующийся продукт реакции имеет окраску, отличную от окраски исходного реактива.
I. Реакция Браше – на РНК
1. Реактив – смесь двух красителей: метилового зелёного и пиронина.
2. Пиронин окрашивает структуры, богатые РНК, в малиновый цвет. Другие структуры – зелёные.
3. Чтобы проверить специфичность окраски, делают контрольный препарат, который перед окрашиванием обрабатывают рибонуклеазой.
|
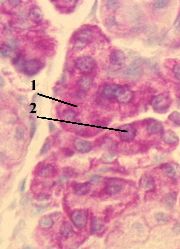
Препарат - срез поджелудочной железы.
В малиновый цвет окрашены
 цитоплазма (1) и цитоплазма (1) и
 ядрышки (2) секреторных клеток – ядрышки (2) секреторных клеток –
из-за высокого содержания в них РНК (в составе рибосом и их предшественников).
|
|
II. Реакция Фёльгина – на ДНК
1. Основной реактив – фуксинсернистая кислота (реактив Шиффа).
2. а) Под его действием ДНК-содержащие структуры окрашиваются в вишнёвый цвет.
б) Прочие структуры – зелёные.
|
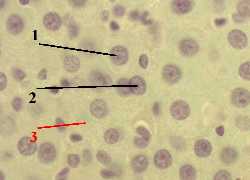
Препарат - срез печени.
Распределение окраски – противоположное предыдущему:
 в вишнёвый цвет красится хроматин (1) в ядрах, в вишнёвый цвет красится хроматин (1) в ядрах,
|
|
 а ядрышки (2) и цитоплазма (3) клеток оказываются зелёными. а ядрышки (2) и цитоплазма (3) клеток оказываются зелёными.
|
III. Реакции на белки
Используются различные реакции; в том числе:
а) с бромфеноловым синим (у белков - тёмно-фиолетовая окраска);
б) со смесью нингидрин-реактив Шиффа (белки приобретают красный цвет).
|
IV. ШИК-реакция – на полисахариды
1. Реактив - Шифф-периодная кислота (выделенные буквы и составляют аббревиатуру ШИК).
2. Периодат способствует образованию в субстрате альдегидной группы, которая взаимодействует с реактивом Шиффа.
3. На препарате ШИК-положительные компоненты (например, гранулы гликогена) имеют фиолетовый или тёмно-красный цвет.
|
Препарат - срез тонкой кишки.
а) На снимке (как и в п. 1.1.3.2.I)) – кишечная ворсинка.
б) В составе покрывающего её эпителия выделяются своей фиолетовой цитоплазмой т.н. бокаловидные клетки. (1).
|

|
в) Эти клетки активно секретируют слизь, отчего в их цитоплазме накапливаются полисахариды – компоненты слизи.
|
V. Реакция с толуидиновым синим – на гликозамингликаны.
1. При взаимодействии толуидинового синего с веществами, содержащими много кислотных групп, наблюдается метахромазия – изменение окраски с синей на фиолетовую и красную.
2. Подобным свойством обладают, в частности, компоненты межклеточного аморфного вещества соединительной ткани –
|
гликозамингликаны (являющиеся гетерополисахаридами с высоким содержанием кислотных радикалов).
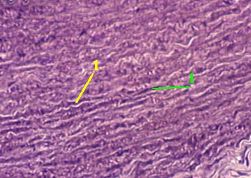
Препарат - срез аорты.
Снимок показывает, что стенка аорты богата гликозаминогликанами.
|
|
VI. Реакция с суданом III – на нейтральный жир
1. Как уже отмечалось в п. 1.1.3.1, судан III – представитель индифферентных, или липофильных, красителей.
2. Проникая в клетки, он (подобно осмиевой кислоте; п. 1.1.3.3) растворяется в жировых и липидных каплях и тем самым окрашивает их в ярко-оранжевый цвет.
|
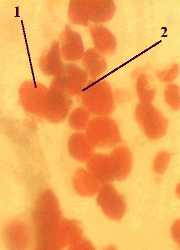
4. Тотальный препарат сальника. Окраска суданом III и гематоксилином. (*)
а) Препарат является тотальным, т.е. перед нами - не срез органа, а участок сальника, растянутый на предметном стекле.
б) Видны жировые клетки;
каждая из них содержит крупную каплю жира (1), которая
 занимает почти всю цитоплазму и занимает почти всю цитоплазму и
 окрашена в ярко-оранжевый цвет. окрашена в ярко-оранжевый цвет.
|
Полный размер
|
в) Клеточные ядра (2) должны краситься гематоксилином в фиолетовый цвет. В данном случае они окрашены весьма слабо.
г) Ядро оттесняется жировой каплей к периферии клетки.
|

1.2. Электронная микроскопия
а) В световом микроскопе увеличение составляет от 10 до 1000 раз.
б) Электронный же микроскоп даёт увеличение от 100 до 500.000 (и даже более) раз, т.е. его максимальное увеличение примерно в 100 раз больше.

1.2.1. Принцип работы электронного микроскопа

1.2.1.1. Особенности:
электронная волна, электромагнитные "линзы"
1. В электронном микроскопе образец облучается не видимым светом, а пучком электронов.
 Длина же электронной волны значительно меньше, чем световой. Длина же электронной волны значительно меньше, чем световой.
 Соответственно, такая волна “чувствует” меньшие препятствия: разрешающая способность микроскопа оказывается выше. Соответственно, такая волна “чувствует” меньшие препятствия: разрешающая способность микроскопа оказывается выше.
2. Конструктивная же особенность состоит в том, что в электронном микроскопе в качестве линз используются электромагнитные катушки.
|
Внешний вид электронного микроскопа

|

1.2.1.2. Типы электронных микроскопов
Основные типы электронных микроскопов:
 трансмиссионные (просвечивающие) и трансмиссионные (просвечивающие) и
 сканирующие (растровые). сканирующие (растровые).
1. При трансмиссионной микроскопии
 пучок электронов проходит через изучаемый объект, пучок электронов проходит через изучаемый объект,
 и в результате получается плоскостное изображение объекта. и в результате получается плоскостное изображение объекта.
2. При сканирующей же микроскопии
 на поверхность объекта вначале наносится металлическое напыление, на поверхность объекта вначале наносится металлическое напыление,
 а в ходе микроскопии электронный пучок последовательно “пробегает” по всем точкам поверхности объекта (сканирует поверхность), выбивая из напылённого вещества вторичные электроны (бета-лучи). а в ходе микроскопии электронный пучок последовательно “пробегает” по всем точкам поверхности объекта (сканирует поверхность), выбивая из напылённого вещества вторичные электроны (бета-лучи).
Последние формируют пространственное изображение поверхности.
|

1.2.1.3. Ход "лучей" в трансмиссионном микроскопе
Ход "лучей" рассмотрим лишь для трансмиссионного микроскопа.
В принципе, этот ход таков же, как в световом микроскопе.
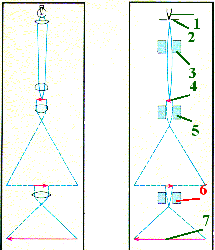
1. а) Источником электронов служит катод (1),
а движущей силой - разность потенциалов между катодом и анодом (2).
б) Анод расположен вблизи катода и имеет отверстие посередине, через которое проскакивают электроны.
в) Чтобы их поток далее не ослабевал, в тубусе микроскопа создаётся высокий вакуум.
|
Схема - ход лучей в световом (I) и электронном (II) микроскопе.
Полный размер
|
2. а) Одна электромагнитная катушка (3) служит в качестве конденсора (фокусирует пучки на образце (4)),
б) вторая катушка (5) - в качестве объектива (принимает лучи, расходящиеся от образца),
в) а третья катушка (6) - в качестве окуляра, или проекционной линзы.
|
3. Электронные "лучи", проходящие через последнюю катушку, попадают далее на люминесцентный экран (7) и вызывают его свечение в месте падения электронов.
|

1.2.2. Особенности приготовления препарата
1. Взятие материала и
фиксация
|
Материал берут очень маленькими кусочками (порядка 1 мм 3 ),
а фиксацию осуществляют обычно в 2 стадии:
 вначале глутаральдегидом (стабилизация белков), вначале глутаральдегидом (стабилизация белков),
 затем - четырёхокисью осмия (стабилизация фосфолипидов и контрастирование ткани). затем - четырёхокисью осмия (стабилизация фосфолипидов и контрастирование ткани).
|
2. Уплотнение материала
|
1. Образцы, как обычно, обезвоживают,
а для их дальнейшего уплотнения используют эпоксидные смолы .
2. а) Заливку производят в специальных формах,
б) затвердевание смеси происходит путём её полимеризации в термостате,
в) и затвердевшие блоки имеют вид маленьких свечей.
|
3. Приготовление
срезов
|
1. Срез делают с помощью ультратома;
их толщина - 30-50 нм (ср. с микротомными срезами - 10.000 – 20.000 нм).
2. Затем их переносят на сеточки (играющие роль предметного стекла).
|
4. Окрашивание
срезов
|
1. а) Окрашивание срезов сводится к их контрастированию с помощью солей тяжёлых металлов (свинца, вольфрама, урана).
б) Эти соли осаждаются на фосфолипидах мембран и поглощают электроны.
2.Поэтому соответствующие места клетки выглядят более тёмными.
|
 |
 Скачать 0.57 Mb.
Скачать 0.57 Mb.