Лекція_7_1. Тема. Титриметричні методи аналізу. Метод нейтралізації
 Скачать 0.61 Mb. Скачать 0.61 Mb.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Назва індикатора | Кд | рКд | Інтервал переходу РН | Забарвлення при різних значеннях рН середовища | рТ | ||
| Силь- но- кис- лотне | Сильно- лужне | рН = р К | |||||
| Метиловий оранжевий | 1,8∙10–4 | 3,75 | 3,0-4,4 | Рожеве | Жовте | Оранжеве | 3,75 |
| Метиловий червоний | 10–5 | 5,0 | 4,2-6,2 | Червоне | Жовте | Оранжеве | 5,20 |
| Нейтральний червоний | 10–7 | 7,0 | 6,8-8,0 | Червоне | Жовте | Оранжеве | 7,20 |
| Фенолфталеїн | 2∙10–11 | 10,7 | 8,2-10,0 | Безбарвне | Малинове | Рожеве | 8,9 |
| Тимолфталеїн | | | 9,4-10,6 | Безбарвне | Синє | Блакитне | 9,9 |
Як випливає з таблиці, кожен індикатор характеризується певним інтервалом переходу, тобто проміжком рН, у межах якого змінюється його забарвлення. Наприклад, інтервал переходу метилового оранжевого знаходиться в межах рН = 3,0-4,4. Це означає, що при всіх значеннях рН < 3,0 його забарвлення буде рожевим; при рН ≥ 4,4 – жовтим, а при рН між 3,0 і 4,4 – оранжевим. Інтервал переходу різних індикаторів залежить від їхньої константи йонізації Кд (табл. 7.1) і приблизно може бути обчислений за формулою:
рН = рКд ± 1.
Значення рН, що відповідає середині інтервалу переходу, при якому спостерігається найпомітніша для ока зміна забарвлення і при якому практично закінчують титрування, називають показником (точкою) титрування індикатора і позначають рТ. Як правило, рТ дорівнює рК індикатора.
Таблиця 7.2
Основні індикатори кислотно-основного титрування
| № з/п | Індикатор | Інтервал переходу рН і забарвлення індикатора | рТ |
| 1 | Кристалічний фіолетовий (перший перехід) | 0-1,0 жовтий – зелений | 0,5 |
| 2 | Кристалічний фіолетовий (другий перехід) | 1,0-2,6 зелений – фіолетовий | 1,8 |
| 3 | Тимоловий синій (перший перехід) | 1,2-2,8 червоний – жовтий | 2,0 |
| 4 | Тропеолін 00 | 1,4-2,6 червоний – жовтий | 2,0 |
| 5 | Метиловий жовтий | 2,9-4,0 червоний – жовтий | 3,0 |
| 6 | Метиловий оранжевий | 3,2-4,4 червоний – жовтий | 4,0 |
| 7 | Бромфеноловий синій | 3,0-4,6 жовтий – синій | 4,1 |
| 8 | Бромкрезоловий зелений | 3,8-5,4 жовтий – синій | 4,5 |
| 9 | Метиловий червоний | 4,2-6,2 червоний – жовтий | 5,0 |
| 10 | Хлорфеноловий червоний | 5,0-6,6 жовтий – червоний | 6,25 |
| 11 | Бромкрезоловий пурпуровий | 5,2-6,8 жовтий – фіолетовий | 6,0 |
| 12 | Феноловий червоний | 6,8-8,4 жовтий – червоний | 7,5 |
| 13 | Бромтимоловий синій | 6,0-7,6 жовтий – синій | 7,0 |
| 14 | Лакмус | 4,5-8,3 червоний – синій | 7,0 |
| 15 | Тимоловий синій (другий перехід) | 8,0-9,6 жовтий – синій | 8,5 |
| 16 | Фенолфталеїн | 8,2-10,0 безбарвний – червоний | 9,0 |
| 17 | Тимол фталеїн | 9,4-10,6 безбарвний – синій | 9,6 |
3. Криві титрування і вибір індикатора
У кожному окремому випадку кислотно-основного титрування закінчення реакції відповідає певному значенню рН розчину, яке залежить від природи й концентрації реагуючих речовин. Значення рН у точці еквівалентності залежить від ступеня гідролізу утвореного продукту і може збігатися з точкою нейтральності при рН = 7 (реакція між сильною кислотою і сильною основою), знаходитися в кислотному середовищі – рН<7 (реакція між сильною кислотою і слабкою основою) або у лужному – рН>7 (реакція між слабкою кислотою і сильною основою).
Для правильного вибору індикатора треба знати зміну рН розчину в процесі титрування, що графічно виражають кривою титрування. При побудові кривої титрування на осі ординат відкладають значення рН розчину (0-14), а по осі абсцис – об’єм добавленого титрованого розчину (см3) або ступінь нейтралізації розчину (%).
Аналіз кривих титрування дає можливість визначити інтервал рН розчину поблизу точки еквівалентності, тобто величину стрибка на кривій титрування(стрибка титрування) і вибрати відповідний індикатор таким чином, щоб значення рТ індикатора знаходилось посередині стрибка титрування. Отже, аналіз кривих титрування дає можливість вибрати оптимальні умови (концентрацію реагентів, індикатор) проведення титрування.
Робочими розчинами методу нейтралізації служать розчини хлоридної кислоти та натрій гідроксиду. Рідше використовують інші сильні кислоти чи основи: HNО3, H2SО4, КОН.
В методі нейтралізації можливі такі випадки титрування:
титрування сильної кислоти сильною основою або навпаки, HCl-NaOH;
титрування слабкої основи сильною кислотою: NH3-НСl;
титрування слабкої кислоти сильною основою: СН3СООН-NaOH;
титрування поліпротонних кислот та їх солей: Н3РO4, Н3ВO3, Na2CO3;
титрування поліпротонних основ та їх солей: Pb(OH)3, FeCl3.
Оскільки існують різні випадки кислотно-основного титрування, розглянемо найважливіші з них
1.Титрування сильної кислоти лугом (або навпаки). Для прикладу проаналізуємо титрування розчину хлоридної кислоти робочим розчином натрій гідроксиду, хімізм якого подають рівнянням:
і
Н3О+ + ОН– =2Н2О.
Крива титрування в цьому випадку має вигляд, зображений на рис. 7.1.
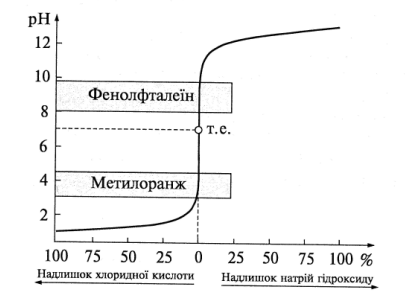
Рис. 7.1. Крива титрування сильної кислоти лугом
Припустимо, що для титрування взяли 20 см3 0,1 М розчину НСl, а як титрант використовували 0,1 М розчин NаОН. Оскільки кожна молекула НСl дає при дисоціації один йон загальна концентрація H+-йонів в 1 дм3 вихідної 0,1 М кислоти складає 0,1, або 10–1 моль/дм3. Отже, рН цього розчину 1. Коли 90% хлоридної кислоти буде відтитровано, йонів Н+ залишиться 10% від первинної кількості, тобто 0,01, або 10–2 моль/дм3, а рН розчину стає рівним 2. При нейтралізації 99,0% хлоридної кислоти – рН = 3; при нейтралізації 99,9% кислоти – рН= 4 тощо. У момент повної нейтралізації хлоридної кислоти розчин, який титрують, містить тільки натрій хлорид і має рН = 7. Додавання надлишку натрій гідроксиду веде до збільшення рН розчину, як це наведено в табл. 7.3.
За результатами цих обчислень будують графік у координатах рН–V титранту, або рН – %НСl (NаОН) відповідно табл. 10.1. Одержаний графік називають кривою титрування.
Крива титрування 0,1 М розчину НСl 0,1 М розчином NаОН показана на рис. 7.1. Хід цієї кривої свідчить, що в кінці титрування сильної кислоти сильною основою відбувається різкий стрибок рН розчину. До моменту нейтралізації 99,9% кислоти рН поступово росте від 1 до 4, тобто всього на три одиниці, а при переході від 0,1% залишку НСl до 0,1% надлишку NaОН рН розчину різко збільшується з 4 до 10. Це означає, що додавання однієї краплі лугу в кінці титрування знижує концентрацію йонів Н+ з 10–4 до 10–10 моль/дм3, або в мільйон разів.
В результаті різкої зміни рН розчину від останньої краплі розчину основи походить і різка зміна забарвлення індикатору. За відсутності стрибка рН на кривій титрування забарвлення індикатора змінювалося б поступово і визначити точку еквівалентності було б неможливо.
На початку титрування спостерігається незначна зміна рН; зменшення залишку кислоти в 10 разів супроводжується збільшенням рН тільки на одиницю. Біля точки еквівалентності (т.е.) відбувається різка зміна рН; 1-2 краплі розчину лугу зумовлюють різке зростання рН від 3 до 11. Тому крива титрування біля точки еквівалентності проходить практично перпендикулярно до осі абсцис. Таку різку зміну рН розчину біля точки еквівалентності називають стрибком титрування. При подальшому добавлянні лугу крива титрування знову стає пологою.
Середина стрибка титрування відповідає точці еквівалентності, яка в цьому разі збігається з рН = 7, оскільки утворена сіль не гідролізує і розчин її має нейтральну реакцію середовища.
Знаючи особливості кривої титрування, вибирають відповідний індикатор. Для кожного випадку титрування придатні тільки ті індикатори, показники титрування (рТ) яких входять у межі стрибка рН на кривій. Таким чином, чим більша величина стрибка титрування, тим більшу кількість індикаторів можна використовувати для визначення кінцевої точки титрування.
Для визначення кінця титрування потрібно взяти такий індикатор, який змінював би своє забарвлення в межах стрибка титрування. Оскільки при титруванні сильної кислоти лугом стрибок великий (рН змінюється від 3 до 11), можна використати будь-який індикатор, інтервал переходу якого лежить у цих межах рН, – метиловий оранжевий, метиловий червоний, фенолфталеїн тощо.
Таблиця 7.3
Зміна рН розчину при титруванні сильної кислоти сильною основою
| Додана кількість NaОН | Залишилося НСl | [Н+], моль/дм3 | pH | ||
| % | см3 | % | моль/дм3 | ||
| 0,0 | 0,00 | 100,0 | 0,1 | 10–1 | 1 |
| 90,0 | 18,00 | 10,0 | 0,01 | 10–2 | 2 |
| 99,0 | 19,80 | 1,0 | 0,001 | 10–3 | 3 |
| 99,9 | 19,98 | 0,1 | 0,0001 | 10–4 | 4 |
| 100,0 | 20,00 | 0,0 | 10–7 | 10–7 | 7 |
| | | надлишок NaОН | | | |
| 100,1 | 20,02 | 0,1 | 0,0001 | 10–10 | 10 |
| 101,0 | 20,20 | 1,0 | 0,001 | 10–11 | 11 |
| 110,0 | 22,00 | 10,0 | 0,01 | 10–12 | 12 |
| 200,0 | 40,00 | 100,0 | 0,1 | 10–13 | 13 |
За результатами цих обчислень будують графік у координатах рН–V титранту, або рН – %НСl (NаОН) відповідно табл. 7.3. Одержаний графік називають кривою титрування.
Відношення доданого об’єму титранту V до об’єму титранту в точці еквівалентності Vекв називають ступенем відтитрованості (р):
Слід зазначити, що на величину стрибка титрування впливають величини концентрацій розчину, який титрують, і титранту. У титриметрії існує поняття рівня титрування, який визначається порядком концентрації титранту, що використовується (10–1 М, 10–2 М тощо). При зменшенні рівня титрування зменшується величина стрибка титрування. Це призводить до того, що при рівні титрування 10–4 М стрибок титрування стає настільки малим, що дуже важко підібрати індикатор для визначення кінцевої точки титрування.
Залежність величини стрибка титрування розчинів НСl розчинами NаОН від рівня титрування наведено в таблиці 7.4.
Таблиця 7.4
Залежність величини стрибка титрування розчинів НСl розчинами NaОН від рівня титрування
| Рівень титрування | Стрибок титрування, ΔрН |
| 100 | 7,4 |
| 10–1 | 5,4 |
| 10–2 | 3,4 |
| 10–3 | 1,4 |
У зв’язку з вище сказаним при титруванні прагнуть створити умови, що дозволяють збільшити величину стрибка титрування.
На величину стрибка титрування впливають наступні чинники:
рівень титрування;
константи йонізації кислот і основ;
температура розчинів;
наявність домішок у розчинах.
Кислотно-основне титрування звичайно прагнуть виконувати так, щоб молярна концентрація титранту і речовини, яку визначають, приблизно були рівні, що робить зручним приготування розчинів речовин, відповідні розрахунки і проведення титрування. При підвищенні концентрації розчинів збільшується величина стрибка титрування. Як уже наголошувалося, при титруванні сильної кислоти сильною основою рівень концентрації не повинен бути менше 10–4 М. Слабкі кислоти і основи не рекомендують титрувати при їх концентрації нижче 10–2 М. Слабкі кислоти і основи, у яких рК > 6, не можна відтитрувати, оскільки не можна підібрати індикатор, рТ якого співпадав би з дуже вузьким стрибком титрування. Так для кислот з рК 7 стрибок титрування рівний 2, а для кислот з рК 9 стрибок практично відсутній. Підвищення температури розчину приводить до збільшення йонного добутку води, зміни рК кислот і основ; стрибок титрування при цьому зміщується у бік нижчих значень рН. Тому звичайно титрування проводять при кімнатній температурі. Зміни йонної сили розчину, пов’язані з присутністю сторонніх електролітів у достатньо високих концентраціях, призводять до достатньо великих змін рК кислот і основ і можуть істотно впливати на величину стрибка титрування. Так, для титрування сильної кислоти сильною основою придатний лакмус, показник титрування якого (рТ= 7) не тільки входить у межі стрибка, але навіть співпадає з точкою еквівалентності. У фенолфталеїну рТ = 9. Очевидно, застосовуючи цей індикатор, титрування закінчують не в точці еквівалентності, а при деякому надлишку основи, який дуже малий. Адже вже при 0,1% надлишку NaОН рН розчину збільшується до 10. Отже, з фенолфталеїном розчин перетитровують лише на частки краплі лугу, чим цілком можна знехтувати. У метилового оранжевого рТ= 4, а у метилового червоного рТ= 5,5. Обидва показники входять до інтервалу стрибка рН на кривій. Але ж, застосовуючи ці індикатори, розчин трохи недотитровують, але знову-таки на величину, що не перевищує 0,1% від загальної кількості кислоти.
Хід кривої титрування розчину лугу сильною кислотою є дзеркальним відображенням кривої, наведеної на рис. 7.1, тому вибір індикатора проводять аналогічно.
2.Титрування слабкої кислоти лугом. Для прикладу розглянемо титрування розчину ацетатної кислоти розчином натрій гідроксиду, у процесі якого відбувається така реакція:
СН3СООН + ОН– =СН3СОО– +Н2О.
Криву титрування для цього випадку зображено на рис. 7.2.
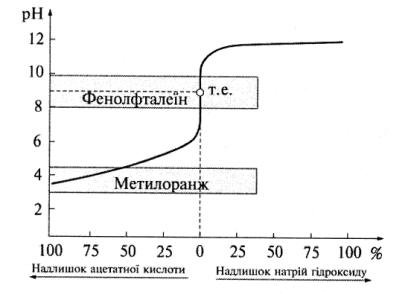
Рис.7.2. Крива титрування ацетатної кислоти лугом
Ацетатна кислота є слабким електролітом, тому рН її розчину становить приблизно 3,0. Хід кривої титрування подібний до наведеної вище, проте стрибок титрування значно менший (від 7,5 до 10,5) і середина його лежить при рН9. Це пояснюють тим, що утворені у процесі титрування ацетат-йони зазнають гідролізу і створюють лужне середовище:
СН3СОО– + НОН
Для визначення кінця титрування можна використати фенолфталеїн і тимолфталеїн (табл. 7.1), оскільки їх інтервали переходу відповідають стрибку титрування. Якщо виконувати це титрування за наявності метилового оранжевого, то зміна забарвлення настане вже тоді, коли буде відтитровано лише 20% ацетатної кислоти. Отже, цей індикатор вибрано неправильно.
3.Титрування слабкої основи сильною кислотою. Розглянемо приклад титрування розчину амоній гідроксиду сильною хлоридною кислотою:
NH4OH + Н+ = NH4+ + Н2О.
Криву титрування зображено на рис. 7.3.
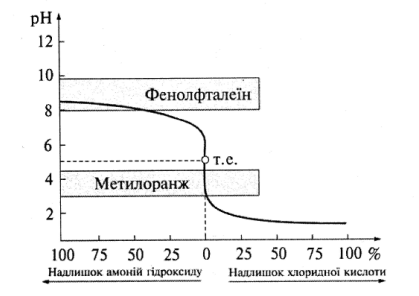
Рис. 7.3. Крива титрування розчину амоній гідроксиду хлоридною кислотою
Побудову кривої титрування здійснюють так само, як у попередніх прикладах. До початку титрування розчин амоніаку має лужне середовище (рН ≈ 8,5), у процесі його титрування хлоридною кислотою рН зменшується. Стрибок титрування невеликий і знаходиться в межах рН = 6,2-3,8. Точка еквівалентності лежить у слабкокислотному середовищі (рН ≈ 5), що зумовлено гідролізом утвореної солі NH4Cl за рівнянням
NH4+ + НОН
Отже, при титруванні слабких основ сильними кислотами слід використовувати індикатори, які змінюють своє забарвлення в межах рН = 3,8-6,2, – метиловий оранжевий,метиловий червоний. Фенолфталеїн у цьому випадку не використовують.
4. Титрування слабкої кислоти слабкою основою. Цей випадок розглянемо на прикладі титрування ацетатної кислоти розчином амоній гідроксиду, що ґрунтується на реакції:
СН3СООН + NH4OH = СН3СОО– + NH4+ + Н2О.
За такого титрування стрибок титрування (рис. 7.4) малопомітний. Різкої зміни забарвлення індикатора від зайвої краплі титранту не спостерігається. Тому виявити точку еквівалентності складно, і на практиці таку систему не застосовують.
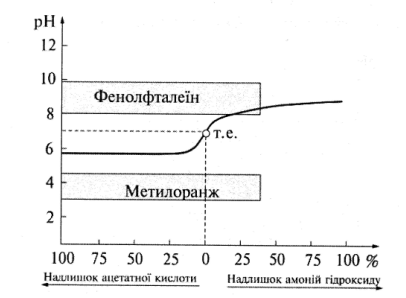
Рис. 7.4. Крива титрування ацетатної кислоти розчином амоніаку
5. Титрування багатоосновних кислот (і багатокислотних основ). Багатоосновні кислоти (H4Р2O7, Н2СO3 тощо), а також багатокислотні основи (Ва(ОН)2 Мg(ОН)2 тощо) дисоціюють ступінчасто.
Кожен ступінь дисоціації можна розглядати як йонізацію однопротонної кислоти або основи. Кожному ступеню відповідає своя константа йонізації. Тому у розчині поліпротонних кислот або основ знаходиться суміш кислот або основ, які утворюються у процесі йонізації, і крива титрування складається з кривих титрування продуктів йонізації (рис. 7.5). Помітна різниця між першою, другою і наступними точками еквівалентності на кривих титрування з’являється тільки у тому випадку, якщо різниця між константами йонізації К1 і К2 і наступними є більшою ніж у 10000 разів (або на чотири одиниці pК).
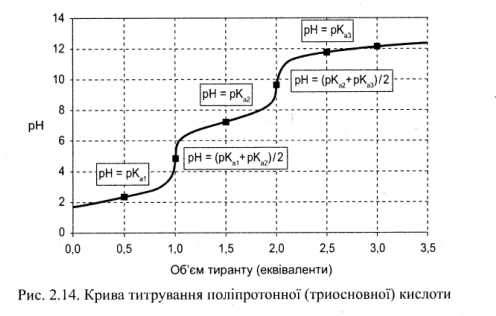
Рис. 7.5. Крива титрування полі протонної (триосновної) кислоти
При титруванні поліпротонних основ на кривих титрування також спостерігають декілька стрибків титрування, якщо константи йонізації кожного ступеня відрізняються більш ніж у 10000 разів.
Наприклад, йонізація Н3АsО4 протікає за трьома ступенями:
Н3АsО4
Н2АsО4–
НАsО42–
Проте дисоціація за третім ступенем майже не відбувається через те, що катіони Н+, що утворилися у попередніх ступенях, зміщують вліво рівновагу третьої реакції. Крім того, це пояснюється утрудненістю дисоціації при зростанні заряду аніона.
При титруванні розчину арсенатної кислоти Н3АsО4 розчином сильної основи (наприклад, КОН) спочатку нейтралізуються йони Н+, що утворилися на першому ступені, і в точці еквівалентності спостерігається стрибок рН (рис. 7.6).
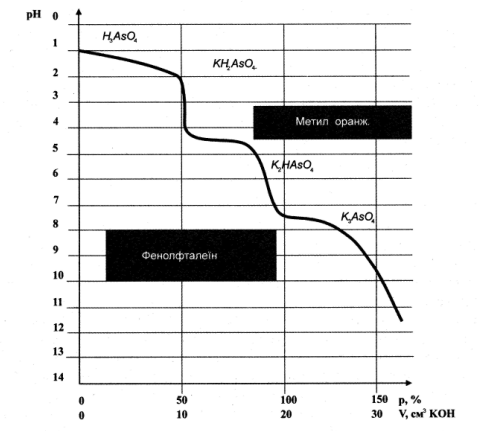
Рис. 7.6. Крива титрування 0,1 М розчину Н3АsО4 0,1 М розчином КОН
Якщо продовжувати титрування, то далі нейтралізуватимуться і йони Н+, що утворилися за другим ступенем дисоціації, і на кривій з’явиться другий стрибок рН. Здавалося б, що у момент нейтралізації йонів Н+, що утворилися за третім ступенем дисоціації, біля точки еквівалентності повинен відбутися третій стрибок рН. Проте його не має, оскільки лужність розчинів калій арсенату і калій гідроксиду дуже близькі. Таким чином, криві титрування багатоосновних кислот (або багатокислотних основ) мають декілька перегинів, що відповідають різним ступеням дисоціації. Правда, найчастіше ці перегини недостатньо чіткі, особливо біля другої і третьої точок еквівалентності. Але в окремих випадках вони добре виражені. Це дає можливість спостерігати різку зміну забарвлення того чи іншого індикатору і визначати точки еквівалентності при титруванні.
4. Можливості кислотно-основного титрування
Методом кислотно-основного титрування можна визначити:
сильні кислоти і сильні основи;
слабкі кислоти і слабкі основи, константи йонізації яких більші ніж 5·10–7;
два типи солей, що гідролізуються:
утворені слабкою кислотою, Ка якої менше ніж 5·10–7, і сильною основою;
утворені сильною кислотою і слабкою основою, Кb якої менше ніж 5·10–7.
Цим методом також можна визначити суміші різних за силою кислот або основ за умови, що відношення їх констант йонізації буде більше або рівно 104.
При дотриманні цієї умови можливо визначати не тільки суміші кислот або основ, але й суміші:
кислот і солей, що гідролізуються;
основ і солей, що гідролізуються;
2-х солей, що гідролізуються.
Розглянемо це твердження на прикладі суміші К2СО3 і КНСО3. Обидві солі утворені сильною основою (КОН) і слабкою двоосновною кислотою (Н2СО3). Обидві константи йонізації цієї кислоти (Ка1 = 4,5·10–7, Ка2= 4,6·10–11) менше ніж 5·10–7, тому кожну з цих солей можна визначати даним методом окремо. А оскільки відношення цих констант приблизно рівне 104, то в процесі титрування суміші цих двох солей можна чітко відзначити два стрибки титрування.
5. Вибір індикаторів за продуктами реакції
У разі експресного аналізу, коли немає можливості провести титрування стандартного зразка і побудувати криву титрування, щоб максимально точно підібрати індикатор, його вибирають за продуктами реакції. Це швидший, але менш точний спосіб вибору індикатора. Як користуватися цим методом, розглянемо на прикладі кількісного визначення оксалатної кислоти (Ка1 = 5,62·10–2, Ка2=5,89·10–5):
Н2С2О4 + 2NаОН → Na2С2O4 + 2Н2O.
Продуктами цієї реакції є вода (рН 7) і сіль, що гідролізується, утворена сильною основою і слабкою кислотою. Гідроліз солі йде по аніону, отже, в точці еквівалентності рН > 7. У даному випадку підійде індикатор, інтервал переходу забарвлення якого лежить в лужному середовищі (наприклад, фенолфталеїн).
6. Техніка титрування
Правильне визначення точки еквівалентності при титруванні залежить не тільки від вибору індикатора, але й від послідовності титрування.
За методом нейтралізації титрують розчини кислот розчинами основ або навпаки. Цю послідовність слід враховувати при виборі індикатора. Наприклад, якщо титрують кислоту основою і як індикатор використовують метиловий оранжевий (або метиловий червоний), то рожеве забарвлення індикатора від надлишкової краплі лугу повинно змінитися на жовте. Така зміна забарвлення набагато гірше спостерігається оком, ніж перехід її з жовтої в рожеву. Тому з метиловим оранжевим (або метиловим червоним) рекомендують титрувати розчини основ розчинами кислот. Із фенолфталеїном зручніше титрувати розчини кислот розчинами основ, оскільки при цьому безбарвний розчин стає малиновим. Слід додати, що при використанні індикаторів для фіксації кінцевої точки титрування можлива поява індикаторної помилки. Вона утворюється у разі неспівпадання рН розчину в точці еквівалентності і рТ індикатора. Якщо таке неспівпадання має місце, то розчин звичайно або дещо перетитровують, або, навпаки, недотитровують.
Для зменшення індикаторної помилки титрування проводять із так званим «свідком». У запасну конічну колбу (або стакан) наливають дистильовану воду в кількості, приблизно рівній об’єму рідини, що виходить в кінці титрування. Додають до води стільки ж крапель індикатору, наприклад, метилового оранжевого, скільки і до розчину, який аналізують, і додають з бюретки 1-2 краплі кислоти, що викликає слабке рожеве забарвлення розчину. «Свідок» використовують як зразок при титруванні, добиваючись, щоб забарвлення аналізованого розчину і «свідка» було однакове. За допомогою «свідка» вводять також поправку до результатів титрування на доданий надлишок кислоти, тобто з об’єму, який витрачено на титрування, віднімають об’єм двох крапель 0,04 см3), що пішли на забарвлення індикатору у «свідку».
Нарешті, правильне визначення точки еквівалентності залежить від кількості доданого індикатора. Іноді прагнуть додати більше індикатора, вважаючи, що велика інтенсивність забарвлення розчину полегшить визначення точки еквівалентності. Але чим більше додано індикатора, тим важче помітити зміну забарвлення, оскільки воно відбуватиметься повільніше. Для встановлення кінцевої точки титрування має значення не стільки яскравість забарвлення розчину, скільки чіткість її зміни. Експериментальним шляхом визначено, що на 10-15 см3 розчину, який аналізують, слід брати одну краплю розчину індикатору, а на 25 см3 – не більше 2 крапель.
Таким чином, результат об’ємного визначення залежить не тільки від вибору індикатора, але також від кількості індикатора і від порядку титрування.
Методом нейтралізації можна кількісно визначати також солі, утворені слабкими кислотами і сильними основами, і навпаки. Наприклад, титрування натрію карбонату хлоридною кислотою відбувається у дві стадії, кожна з яких описується константою рівноваги, оберненою до константи йонізації карбонатної кислоти за першим та другим ступенем. При побудові кривих титрування рН розчину розраховують за формулами для поліпротонних кислот (з використанням констант кислотності КНСО3– та КН2СО3). Аналогічно будують криві титрування інших солей слабких кислот.
При титруванні суміші кислот або основ відповідні стрибки титрування з’являються тільки у тому випадку, якщо константи йонізації кислот або основ відрізняються також більше ніж у 10000 разів (або на 4 одиниці рК).
Можливість кислотно-основного титрування сильних кислот і сильних основ обмежується їх низькою концентрацією у розчинах (використання розчинів з концентрацією нижче 0,001 моль/л є недоцільним) у зв’язку з малим стрибком титрування. Для слабких кислот або слабких основ таке титрування також обмежується значеннями їх рКа і рKb які повинні забезпечити величину константи кислотно-основної реакції К > 108.
