Ккрсова. курсовая Шалбуровой А.Б.. Теоретическая часть. 1Комплексные соединения
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
Содержание 1.Теоретическая часть. 1.1Комплексные соединения. 1.2Оксалат меди. 2. Экспериментальная часть. 2.1 Реактивы, приборы и оборудование. 2.2 Методика эксперимента. 2.3 Расчет теоретического выхода. 3. Выводы. 4.Список литературы. 1.Комплексные соединения. Комплексные соединения (лат. Complexus — сочетание, обхват) или координационные соединения (лат. Co — «вместе» и ordinatio — «упорядочение») – это соединение (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером. Согласно координационной теории, в молекуле любого комплексного соединения один из ионов, обычно положительно заряженный занимает центральное место и называется комплексообразователем или центральным ионом. Вокруг него в непосредственной близости расположено или, как говорят, координировано некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами (адендами) и образующих внутреннюю координационную сферу соединения. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более дальнем расстоянии от центрального иона, составляя внешнюю координационную сферу. Число лигандов, окружающих цетральный ион, называется координационным числом. Координационное число зависит: От заряда (степени окисления) комплексообразователя От размеров комплексообразователя и лигандов: - чем больше радиус комплексообразователя, тем больше его координационное число; - чем меньше размер лиганда, тем больше к.ч. комплексообразователя 3. От концентрации растворов, в которых идёт комплексообразование. 4. От температуры: повышение температуры, как правило, приводит к понижению координационного числа. Комплексное соединение, как правило, состоит из двух сфер –внутренней и внешней. Комплексный ион (или внутренняя сфера комплексного соединения) – частица, состоящая из комплексообразователя – обычно иона d- или f- металла в определённой степени. Комплексные соединения классифицируют в зависимости от заряда комплексной частицы, природы лигандов и по некоторым другим признака: 1. Комплексные электролиты и неэлектролиты. Если комплексные соединения содержат внешнюю и внутреннюю сферы, то будучи связанными друг с другом ионным типом связи, диссоциируют в растворе на ионы внешней сферы и комплексные ионы, т.е. являются электролитами. 1.Различают катионные( заряд комплексного иона положителен), анионные(заряд комплексного иона отрицательный) и нейтральные(заряд комплексного иона равен нулю) комплексы. Эти комплексы выделяют в зависимости от заряла комплексного иона. 2.Классификация комплексов по природе лигандов. В зависимости от природы лигандов различают следующие основные типы комплексных соединений: Ацидокомплексные ( комплекы типа двойных солей)- в этих комплексах лигандами являются анионы: 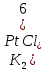 - 2KCl*Pt - 2KCl*Pt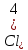 Аммиакаты-это комплексы, лигандами в которых служат молекулы аммиака: 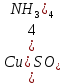 Аквакомплексы (гидраты)- в которых лигандом выступает вода. При кристаллизации вещества из раствора катион захватывает часть молекул воды, которые попадают в кристаллическую решетку соли. Такие вещества называют кристаллогидратами. 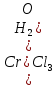 - Cr - Cr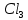 * *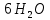 Условия разрушения комплексного иона. Хотя связь комплексообразователя с лигандами прочная, она всё же может быть разорвана. Это означает, что комплексный ион можно разрушить, т.е. заставить его полностью продиссоциировать. Комплекс разрушается, если при действии соответствующего реагента образуется: а) ещё более прочный комплекс; б) очень плохо растворимое вещество. Изомерия комплексных соединений. Одинаковые лиганды располагаются в пространстве вокруг комплексообразователя симметрично. Наиболее распространённым значениям координационных чисел 2, 4 и 6 соответствуют следующие геометрические конфигурации комплексов: линейная, плоско квадратная, тетраэдрическая, октаэдрическая. . Оксалат меди Оксалат меди(II) — неорганическое соединение, соль металла меди и щавелевой кислоты с формулой CuC2O4, не растворяется в воде, образует кристаллогидрат — кислотно-голубые кристаллы. Получение: Обработка растворов солей меди(II) щавелевой кислотой: Физические свойства: Внешний вид оксалата меди. Оксалат меди(II) образует кристаллогидрат состава CuC2O4•H2O (по другим данным CuC2O4•½H2O) — кислотно-голубые кристаллы. Не растворяется в воде. Химические свойства: С оксалатами щелочных металлов и аммония образует комплексные соли. 2.Эксперементальная часть: 2.1 Реактивы, приборы и оборудование: При выполнении работы использовались следующие реактивы: Пентагидрат сульфат меди(II) Моногидрат оксалат аммония Вода деионизованная; В работе были использованы следующие приборы и посуда: Мерные пипетки объемом 10 мл; Термостойкие стаканы объемом 150 мл; Бумажные фильтры; Воронки стеклянные; Весы лабораторные; Песочная баня; Ледяная баня; Шпатель; Микроскоп; Предметное стекло.  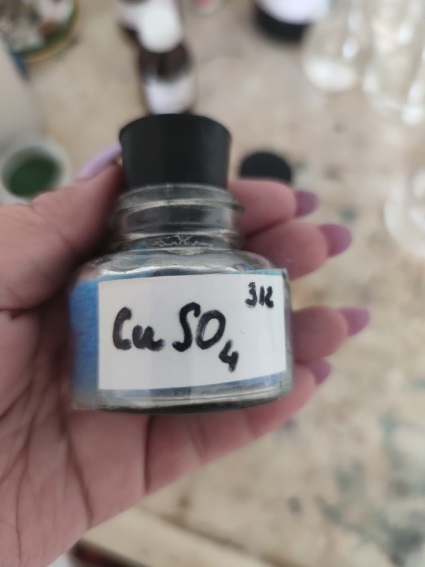 При работе в химической лаборатории необходимо соблюдать следующие правила: Работа должна быть предварительно спланирована учащимся и одобрена преподавателем. На лабораторном столе во время работы не должно быть посторонних предметов. В лаборатории следует работать в хлопчатобумажном халате, волосы должны быть убраны. Строго запрещается принимать в лаборатории пищу. До и после выполнения работы необходимо вымыть руки. Работать нужно аккуратно, результат опыта зависит от чистоты проведения эксперимента. Все опыты с ядовитыми и пахучими веществами выполнять в вытяжном шкафу. Химические реактивы брать только шпателем, пинцетом или ложечкой (не руками!). Неизрасходованные реактивы не высыпать и не выливать обратно в те сосуды, откуда они были взяты. Работу с твердыми щелочами проводить только в защитных очках и перчатках. Жидкости переливать через химические воронки. Склянку, из которой переливают жидкость, необходимо держать этикеткой к руке во избежание её порчи. При нагревании растворов и веществ в пробирке необходимо использовать держатель. Отверстие пробирки должно быть направлено в сторону от себя и других работающих. Нельзя наклоняться над сосудом, в котором происходит нагревание или кипячение жидкости. При необходимости определить запах выделяющихся при реакции газов нужно легким движением ладони направить струю газа от горла сосуда к себе и осторожно вдохнуть. При разбавлении концентрированных кислот и щелочей небольшими порциями приливать кислоту (или концентрированный раствор щелочи) в воду, а не наоборот. Опасные продукты реакции сливать только в соответствующие банки в вытяжном шкафу. Со всеми возникающими вопросами сразу же обращаться к преподавателю. 2.2 Методика эксперимента: Были приготовлены насыщенные растворы сульфата меди и оксалата аммония массами 5 г и 4.8 г. Для получения большего количества вещества следовало увеличить растворимость реагентов, что было достигнуто нагреванием растворов до температуры около 90° С.   Затем растворы были слиты, сразу начали образовываться синие кристаллы дигидрата диоксалатакупрата (2) аммония. После того как раствор полностью охладился, и весь осадок выпал, раствор был отфильтрован через фильтровальную бумагу.   Температура разложения 150°С. В воде не растворим. 2.3 Расчет теоретического выхода. 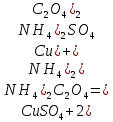 n( 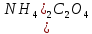 )=0,06моль )=0,06мольn( 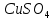 )=0,03 моль )=0,03 мольn( 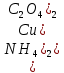 )=n( )=n(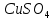 )=0,03моль )=0,03мольm( 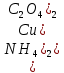 )=0,03*276=8,28 г. )=0,03*276=8,28 г.ή= 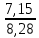 *100%=86,35% *100%=86,35%3.Вывод: В ходе работы было получено комплексное соединение дигидрата диоксалатакупрата(II) аммония массой 7,15 грамм, кристаллы которого были изучены под микроскопом. 4.Список литературы. 1. https://ru.wikipedia.org 2. https://cyberleninka.ru/ 3. Практический курс «Неорганический синтез» Нетреба Е.Е. ,2019 4. Брауер Г. Руководство по неорганическому синтезу. 1985-1986 5. Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с. 6. Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с. 7. Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2003. — 743 с. 8. Глинка Н. Л. Общая химия. — М.: Высшая школа, 2003. — 743 с. 9. Киселев Ю. М. Химия координационных соединений. — М.: Интеграл-Пресс, 2008. — 728 с. 10. Ершов. Общая химия. — Издание восьмое,стериотипное. — Москва: Высшая школа, 2010. — 560 с. |
