Компьютерное моделирование. Теория столкновений (химическая кинетика)
 Скачать 235.3 Kb. Скачать 235.3 Kb.
|
|
Министерство образования и науки Республики Казахстан Карагандинский государственный университет имени академика Е. А. Букетова Химический факультет Кафедра физической и аналитической химии РЕФЕРАТ по дисциплине: "Компьютерное моделирование" на тему: " Теория столкновений (химическая кинетика)» Сделала: студентка группы FH-22 Клименко Е. А Проверено: Кандидат технических наук, доцент Пустолайкина И. А. Караганда 2021 Содержание 1. Введение....................................................................................3 2. Частота столкновений .....................................................................4 3.Энергетический фактор ...................................................................5 4. Пространственный фактор................................................................6 5. Скорость реакции....................................................................... ....7 6. Преимущества и недостатки теории столкновений...........................9 7.Список литературы………………………………………………………9 Введение Одной из первых теорий, объяснявших механизм химических реакций, была теория активных столкновений. Эта теория утверждала, что химическая реакция является результатом столкновения взаимодействующих частиц. Шведский физик Сванте Аррениус предположил, что взаимодействуют только частицы с избыточной энергией. Аррениус вывел закономерность, согласно которой скорость химической реакции зависит от температуры, в виде следующего уравнения: W = A.exp[-E/(RT)], Теория активных столкновений (ТАС) ставит задачу расчета скорости бимолекулярной элементарной реакции, протекающей в газовой фазе, на основе понятий и математического аппарата молекулярно-кинетической теории идеальных газов. Поскольку химическое взаимодействие между молекулами возможно только при их столкновении, скорость химической реакции должна определяться числом столкновений молекул в единицу времени. Однако для любой реакции число таких столкновений настолько велико, что если бы каждое из них привело к химическому акту, то реакции закончились бы очень быстро, почти мгновенно. Поскольку это не так, можно предположить, что не каждое столкновение молекул реагирующих веществ приводит к химическому превращению. Так появилась гипотеза С. Аррениуса о возможности химических превращений только "быстрых" молекул, обладающих достаточной энергией для разрыва межатомных связей при столкновении. Гипотеза С. Аррениуса легла в основу теории активных столкновений, развитой в работах М. Траутца (1916) и У. Льюиса (1918). Очевидно, что условием химического взаимодействия двух частиц является необходимость их контакта (столкновения) в пространстве. Молекулярно-кинетическая теория газов позволяет рассчитать общее число столкновений в единицу времени на единицу объема газовой смеси при заданной температуре. Частота столкновений Поскольку химическое взаимодействие между молекулами возможно только при их столкновении, скорость химической реакции должна определяться числом столкновений молекул в единицу времени. Если бы каждое столкновение приводило к химической реакции, то число столкновений в единицу времени в единице объема по определению соответствовало бы скорости химической реакции. Простое сравнение расчетных значений с экспериментальными данными показывает, что значения экспериментально определенных скоростей реакции на несколько порядков меньше расчетного числа всех столкновений. Это говорит о том, что не каждое столкновение приводит к химическому превращению. Важным для возможности протекания реакции является условие достаточной энергии при столкновении для преодоления отталкивания электронных оболочек и возникновения деформаций в атомах, приводящих к возникновению новых связей. Другими словами, реагирующие молекулы должны иметь некоторый избыточный запас энергии по сравнению со средним значением, чтобы реакция произошла. Распределение энергии молекул в простейшем случае может быть описано классической статистикой Максвелла-Больцмана, согласно которой число частиц (N), имеющих энергию больше некоторой средней энергии, равно: 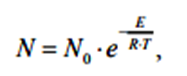 Для объяснения быстрых реакций при расчете числа активных столкновений учитывается вклад не только энергии поступательного, но и других видов движения, в частности колебательного. объяснение медленных реакций несколько сложнее. В качестве одного из объяснений приводится тот факт, что даже при условии энергически активного столкновения молекулы должны быть правильно ориентированы в пространстве относительно друг друга своими функциональными группами, чтобы иметь возможность реагировать, отсюда и термин стерический фактор. Однако такое объяснение не всегда оправдывает уменьшение доэкспоненциального фактора на несколько порядков раз. 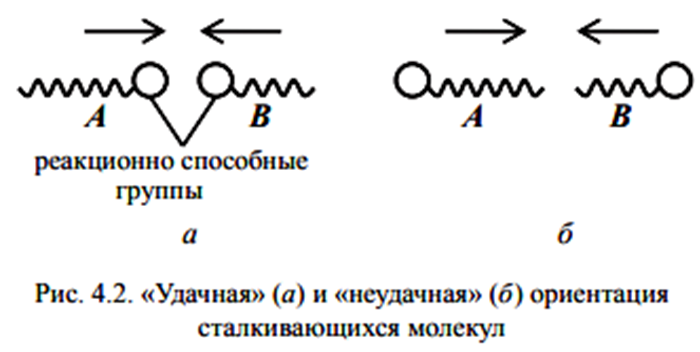 Поскольку химическое взаимодействие между молекулами или ионами происходит при их столкновении, то чем чаще происходят такие столкновения, тем больше должна быть скорость реакции при прочих равных условиях. Частота столкновения молекул или ионов, очевидно, будет тем больше, чем больше концентрация каждой из них в растворе. Закон эффективных масс применим к реакциям с участием твердых тел, которые происходят при столкновении молекул газа с поверхностью твердого тела. Частота столкновений молекул газа с этой поверхностью зависит только от плотности газа и т. д., и поэтому скорость реакции при постоянной площади поверхности твердого тела пропорциональна только парциальным давлениям газов. Энергетический фактор Столь сильное расхождение между рассчитанным общим числом столкновений и числом столкновений, приводящих к химическим реакциям, привело Аррениуса (и некоторых других исследователей независимо от него) к выводу, что в реакцию вступают только так называемые активные молекулы, то есть те молекулы, энергия которых превышает определенное критическое значение. Эту величину он назвал энергией активации, которая определяется из зависимости константы скорости химической реакции от температуры в соответствии с уравнением Аррениуса: 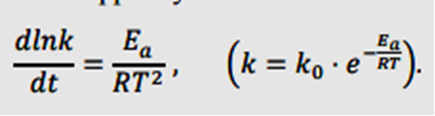 Аррениус предположил, что активные молекулы представляют собой особую таутомерную форму молекул реагирующего вещества. Однако не существует особой формы энергии, соответствующей энергии активации. Энергия активации понимается как избыточная энергия, которой обладают реагирующие молекулы по сравнению со средним уровнем энергии других молекул. Эта избыточная энергия может выражаться в различных формах: 1. увеличение кинетической энергии поступательного или вращательного движения молекул; 2. увеличение энергии взаимной вибрации атомов или атомных групп, составляющих молекулу; 3. увеличение энергии движения электронов и т. д. Для различных реакций не все формы этой энергии равны. Таким образом, согласно теории Аррениуса, все реакции проходят промежуточную стадию, связанную с активацией молекул: 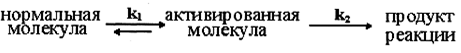 Константы k1 >> k2, поэтому на первом этапе устанавливается равновесие между активированной и нормальной молекулами. Это связано с тем, что обмен энергией происходит довольно быстро. Поэтому предельной стадией является собственно акт химического взаимодействия, а не активация молекул. Таким образом, Аррениус предположил, что для бимолекулярных реакций константой скорости является число активных столкновений на единицу объема в единицу времени. Пространственный фактор Формулы Льюиса много говорят об электронной структуре и стабильности молекул, но пока они ничего не могут сказать об их пространственной структуре. В теории химических связей есть два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются друг с другом. Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на "страшное" название, суть этого подхода очень проста и понятна: химические связи и неразделенные электронные пары в молекулах имеют тенденцию располагаться как можно дальше друг от друга. Теория отталкивания валентных электронных пар (ОВЭП) проста и понятна. Он опирается на классическую геометрию и позволяет правильно предсказывать форму молекул. Однако образование идентичных связей из атомных орбиталей разных типов потребовало введения такого понятия, как ГИБРИДИЗАЦИЯ (то есть “смешение”) атомных орбиталей. 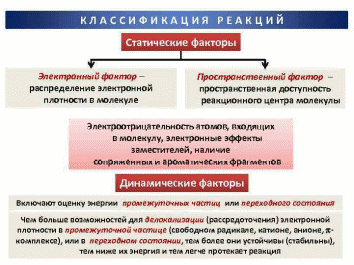 Скорость реакции Скорость химической реакции-это количество вещества, вступающего в химическую реакцию в единицу времени. Количественно удобнее всего характеризовать скорость путем изменения концентрации в единицу времени, или более строгим определением скорости химической реакции является изменение числа молекул данной разновидности в единицу времени. Если реакция однородна и протекает в объеме, то реакционным пространством является объем, а изменение количества вещества рассматривается в единице объема (R≡V). Если реакция неоднородна и протекает на границе раздела фаз, то реакционным пространством является поверхность, а изменение количества вещества приписывается единице площади поверхности (R≡S). Скорость реакции зависит от природы реагирующих веществ, температуры, концентрации, среды, в которой протекает реакция, наличия катализатора и его концентрации. Основной постулат химической кинетики. Количественная зависимость скорости реакции от концентрации выражается основным законом (постулатом) химической кинетики, впервые предложенным К. Гульдбергом и П. Вааге в 1864-1867 годах, который теперь можно сформулировать следующим образом: скорость реакции в каждый момент времени при постоянной температуре пропорциональна произведению концентраций реагирующих веществ в некоторых градусах. Химическая реакция, как известно, обычно записывается в виде стехиометрического уравнения. Последнее является простейшим соотношением числа молекул реагентов и продуктов и представляет собой количественное соотношение между исходными реагентами и продуктами. В этом случае стехиометрическое уравнение должно быть записано так, чтобы коэффициенты перед формулами реагентов были минимальными целыми числами. Для характеристики элементарных реакций используется понятие молекулярной структуры. Молекулярность- это число частиц, взаимодействующих одновременно в элементарном акте. Для простых реакций, протекающих в одну стадию, молекулярность равна числу молекул исходных веществ, определяемому стехиометрическим уравнением. Если реакция протекает в несколько стадий, то каждая из стадий имеет свой молекулярный характер. Таким образом, для многостадийных реакций порядок в интегральном (общем) уравнении может существенно отличаться от молекулярного порядка, так как представляет собой комбинацию молекулярных величин на разных стадиях. Известны моно -, би -и тримолекулярные реакции. Примером мономолекулярной реакции является реакция изомеризации, термического разложения, например: CH3 N2 CH3 → C2 H6 + N2 (разложение азометана); CH3 OCH3 → CH4 + H2 + CO (разложение диметилового эфира). Примеры бимолекулярных реакций: 2HI → H2 + I2 ; CH3 COOH + C2 H5 OH → CH3 COOC2 H5 + H2 O. Тримолекулярных реакций известно немного. Это, например, реакции: 2NO + H2 → N2 O + H2 O; 2NO + O2 → 2NO2 . Реакции более высокой молекулярности неизвестны, поскольку одновременное столкновение четырех и более молекул маловероятно. Так же к реакции можно отнести к тем, у которых константы равновесия имеют очень большие значения, а концентрации исходных веществ в равновесном состоянии пренебрежимо малы. Такие реакции называются необратимыми или односторонними. Преимущества и недостатки теории столкновений Преимущества теории активных столкновений Теория объяснила экспоненциальную зависимость константы скорости от температуры, подтвердила справедливость уравнения Аррениуса в области низких температур и прояснила физический смысл энергии активации. Теория также позволила оценить значение предэкспоненциального фактора. Недостатки теории активных столкновений Теория не позволяет рассчитать энергию активации EA и стерический фактор P. В рамках теории нет объяснения тому факту, что для некоторых реакций Р > 1. Таким образом, в тас стерический фактор является эмпирическим поправочным коэффициентом. Кроме того, теория активных столкновений не объясняет влияния растворителя, давления, добавок инертного газа и других факторов на скорость реакции. 64 В 1935 г. Г. Айринг, М. Полани и М. Эванс предложил теорию, принципиально позволяющую рассчитать не только стерический фактор, но и энергию активации, исходя из свойств участников реакции. Эта теория называется теорией переходного состояния, или теорией активированного комплекса. Список используемой литературы 1 ) Пурмаль А.П. А, В, С химической кинетики. - М.: ИКЦ «Академкнига», 2014. – 278 с. 2)Денисов Е.Т. Химическая кинетика: учеб. для вузов по направлению и спец. «Химия» / Е. Т. Денисов, О. М. Саркисов, Г. И. Лихтенштейн. – М.: Химия, 2010. – 566 с. 3) Замараев К. И. Химическая кинетика: Курс лекций: В 3 ч. / Под ред. А. Г. Окунева, К. П. Брылякова; Новосиб. гос. ун-т. Новосибирск, 2004. Ч 2. 102 с. 4) Макарова Л. Л. М 152 Химическая кинетика и катализ: Учебно-методическое пособие. Ижевск: Изд. центр «Удмуртский университет», 2019. -144с. Стр. |
