0501_Конунников Г А. Термический анализ. Построение диаграммы плавкости двухкомпонентной системы Студенты гр. 0501
 Скачать 112.46 Kb. Скачать 112.46 Kb.
|
|
МИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии отчет по лабораторной работе №3-4 по дисциплине «Материаловедение» Тема: Термический анализ. Построение диаграммы плавкости двухкомпонентной системы
Санкт-Петербург 2021 Цель работы: Построение диаграммы плавкости системы «дифениламин –нафталин» методом термического анализа. Для достижения цели необходимо решить следующие задачи: · построить кривые охлаждения для смесей дифениламина и нафталина с различным соотношением компонентов; · провести анализ построенных кривых охлаждения и определить температуры фазовых переходов для исследованных смесей; · построить фазовую диаграмму системы «дифениламин – нафталин» по полученным экспериментальным данным; · провести полный анализ построенной диаграммы: определить характер всех полей, линий и точек на диаграмме, определить тип равновесия между тремя фазами (инвариантного состояния). Теоретические сведения В гомогенных системах совокупность интенсивных термодинамических свойств характеризует термодинамическое состояние вещества. Для обозначения этого состояния используется специальное название – фаза вещества. Понятие фазы введено Гиббсом в качестве наиболее общей характеристики вещества, не зависящей от размеров и формы системы. К интенсивным свойствам системы относят такие термодинамические свойства, значения которых не зависят от количества вещества в системе. К интенсивным свойствам относятся температура (T), давление (p), концентрация (c), другие свойства, имеющие определенное значение в каждой точке системы. Компоненты — независимые составляющие вещества системы, то есть индивидуальные химические вещества, которые необходимы и достаточны для составления данной термодинамической системы, концентрации которых могут изменяться независимо. Правило фаз Гиббса устанавливает математическую зависимость между числом компонентов и фаз в равновесной системе и ее вариантностью, т. е. числом степеней свободы. s = k − f + n, где s – число степеней свободы, k – количество компонентов, f – количество фаз, n – количество внешних параметров. Числом степеней свободы (s) называется число параметров системы, которые можно изменять независимо друг от друга без изменения числа фаз. Это число можно рассчитать, если от общего количества переменных, определяющих состояние системы, отнять число уравнений, связывающих их в равновесной системе Гомогенная система – система, в которой нет частей, различающихся по свойствам. Гомогенными системами являются, например, воздух, вода, истинные растворы, монокристаллы. Гетерогенная система – система, состоящая из двух или более частей (подсистем), отличающихся по свойствам, причем, хотя бы одно из свойств системы при переходе от одной подсистемы к другой изменяется скачкообразно. Гетерогенными системами являются, например, молоко, кровь, смеси воды и льда, воды и масла, гранит, керамика. Диаграммы плавкости - диаграммы состояния служат для установления условий равновесия между твердыми и жидкими фазами. Диаграмма состояния представляет собой графическое изображение зависимости фазового состояния Типы диаграмм плавкости: 1. Тип I – при увеличении концентрации компонента В температура начала кристаллизации непрерывно повышается. Линия ликвидуса имеет вид непрерывной кривой, все точки которой лежат между температурами кристаллизации компонентов А и В. 2. Тип II – температура начала кристаллизации понижается при добавлении одного компонента к другому. Линия ликвидуса имеет вид непрерывной кривой, проходящей через минимум. 3. Тип III – температура начала кристаллизации повышается при добавлении одного компонента к другому. Линия ликвидуса имеет вид непрерывной кривой, проходящей через максимум. 4. Тип IV – компоненты в твердом состоянии ограниченно растворимы друг в друге, причем на линии ликвидуса имеется перитектическая точка (от греч. peritéko – плавлю, расплавляю, разжижаю) в которой жидкость, находится в равновесии с кристаллическими фазами (химическими соединениями или, как в данном случае, твердыми растворами), число которых равно числу компонентов системы, а при изменении ее температуры уменьшается на единицу. 5. Тип V – компоненты в твердом состоянии ограниченно растворимы друг в друге, но на линии ликвидуса имеется эвтектическая точка Протокол наблюдений Таблица 1 – Результаты эксперимента
Окончание таблицы 1
Обработка результатов экспериментальных данных Диаграммы кривой охлождения при концентрации дифенеламина в различной процентной концентрации представлены на рисунках 1 – 11.  Рисунок 1 – Кривая охлождения при концентрации дифенеламина 0%  Рисунок 2 – Кривая охлождения при концентрации дифенеламина 10%  Рисунок 3 – Кривая охлождения при концентрации дифенеламина 20%  Рисунок 4 – Кривая охлождения при концентрации дифенеламина 30%  Рисунок 5 – Кривая охлождения при концентрации дифенеламина 40%  Рисунок 6 – Кривая охлождения при концентрации дифенеламина 50%  Рисунок 7 – Кривая охлождения при концентрации дифенеламина 60%  Рисунок 8 – Кривая охлождения при концентрации дифенеламина 70%  Рисунок 9 – Кривая охлождения при концентрации дифенеламина 80% 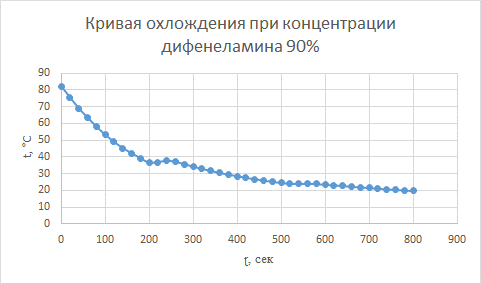 Рисунок 10 – Кривая охлождения при концентрации дифенеламина 90% 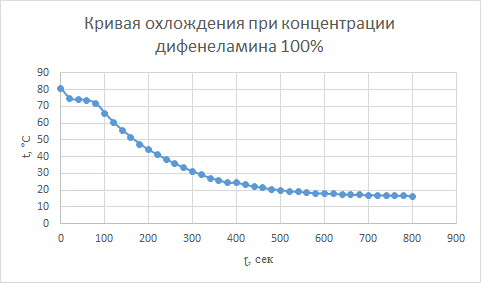 Рисунок 11 – Кривая охлождения при концентрации дифенеламина 100% Температура кристаллизации представлена в таблице 2. Таблица 2 – Температура кристаллизации
Фазовая диаграмма «дифинеламин-нафталин» представлена на рисунке 12. 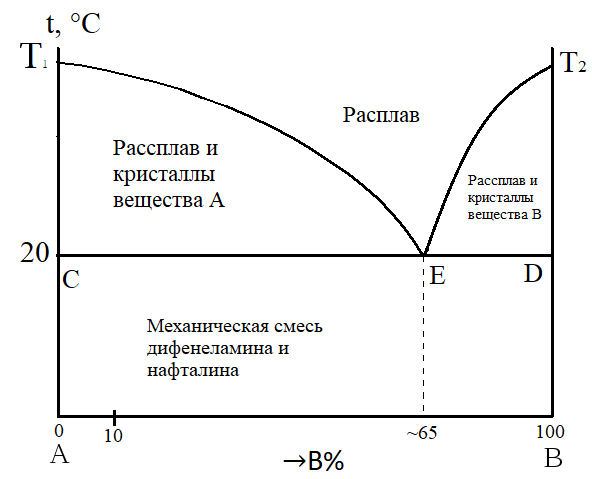 Рисунок 12 – Фазовая диаграмма «дифинеламин-нафталин» где Т1ЕТ2 – линия ликвидуса (состав расплава); Т1Е – линия ликвидуса (расплав и кристаллы вещества А); ЕТ2 – линия ликвидуса (расплав и кристаллы вещества В); СED – линия эвтектики; Т1 – температура плавления вещества А; Т2 – температура плавления вещества В; Е – точка эвтектики. Вывод: в результате измерения лабораторной работы были получены данные для последующего построения кривых охлаждения смесей дифинеламина и нафталина. На основе кривых охлаждения получена диаграмма состояния системы «дифинеламин-нафталин», которая является диаграммой состояния системы с простой эвтектикой. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
