Химия. Тесты по химии для проверки уровня усвоения соответствующего учебного материала. Изложена методика решения типовых задач по химии
 Скачать 0.49 Mb. Скачать 0.49 Mb.
|
Химический эквивалентПримеры решения задач Пример 1 Определите молярную массу эквивалента трехвалентного металла, если при взаимодействии с соляной кислотой 1,47 г этого металла вытеснили 1,83 л водорода при нормальных условиях. Назовите металл. Решение: Молярную массу эквивалента металла Мэкв можно определить из уравнения, выражающего закон эквивалентов: 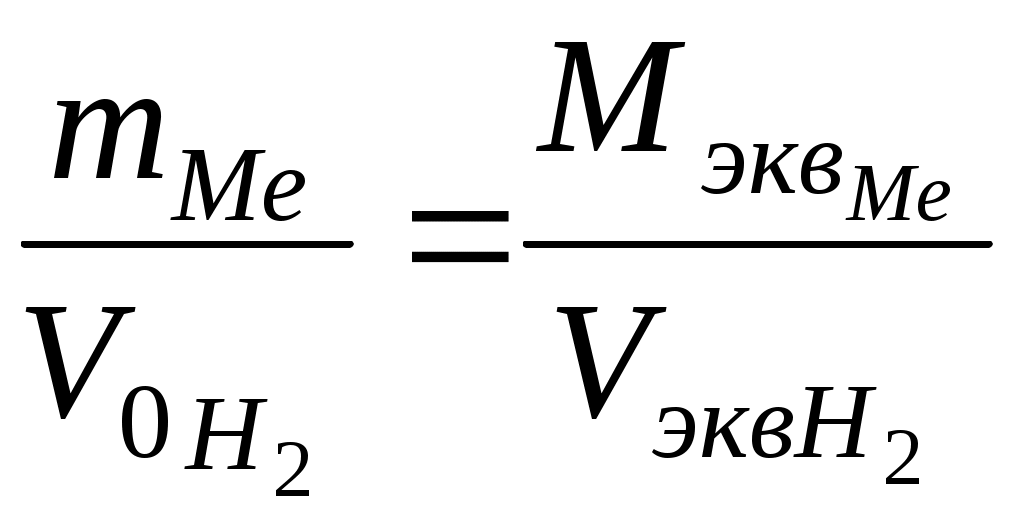 отсюда 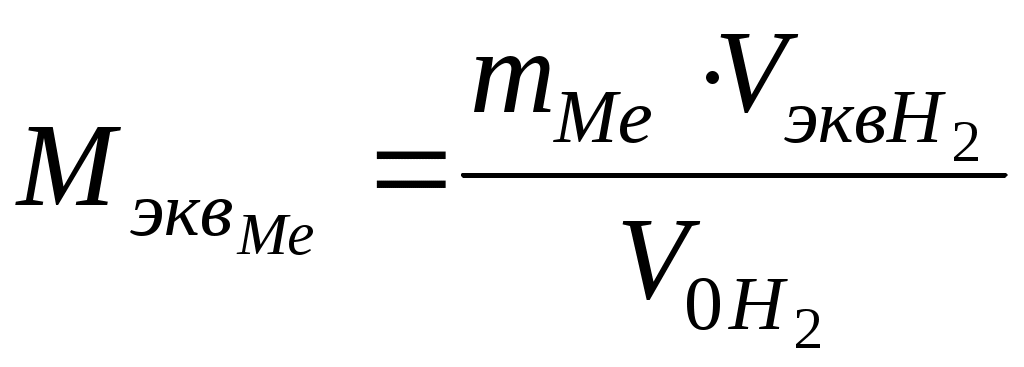 , ,где VM при нормальных условиях в соответствии с законом Авогадро равен 22,4 л/моль, фактор эквивалентности fэкв = 1/2. Следовательно, Подставляем найденные величины в формулу для определения молярной массы металла и получаем Молярная масса металла ММе= В∙МэквМе. Согласно условию В=3 (металл трехвалентный). Находим молярную массу эквивалента металла: ММе = 3∙8,99 = 26,98г/моль. В таблице Д.И. Менделеева находим искомый металл – это алюминий. Уравнение взаимодействия алюминия с соляной кислотой имеет следующий вид: 2Al + 6HCl = 2AlСl3 + 3H2. Пример 2 При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найдите для этого случая значение молярной массы эквивалента ортофосфорной кислоты. Решение: Реакция взаимодействия гидроксида натрия с ортофосфорной кислотой записывается химическим уравнением: 2NaOH + H3PO4 = Na2HPO4 +2 H2O. Молярная масса эквивалента сложного вещества зависит от стехиометрических коэффициентов в уравнении реакции, или от числа протонов, которые замещаются на металл в результате химического превращения. В данном случае – 2. Поэтому Мэкв = М / основность Мэкв = 98/ 2 = 49 г/ моль. Задание к программированному контролю по теме «Химический эквивалент» Вариант 11. Вычислить, какой объем занимает молярная масса эквивалента кислорода при нормальных условиях. Привести расчет. Ответ: а) 22,4 л; б) 11,2 л; в) 5,6 л. 2. Какова молярная масса эквивалента серной кислоты в реакциях H2SO4+CsOH→CsHSO4+H2O; H2SO4+2CsOH→Cs2SO4+2H2O. Ответ: а) 98 и 98 г/моль; б) 98 и 49 г/моль; в) 49 и 98 г/моль. 3. Вычислить молярную массу эквивалента и фактор эквивалентности олова, если процентное содержание его в оксиде составляет 88,12% Ответ: а) 59,5 г/моль, 1 моль; б) 29,70 г/моль, 1/4 моль; в) 59,35 г/моль, 1/2моль. Задание к программированному контролю по теме «Химический эквивалент» |
