|
тесты химия. Тесты входного, промежуточного и итогового контроля по курсу Общая химия для специальности (ей)
ЗАДАНИЕ № 1.
Молярная масса сахарозы С12Н22О11
составляет:
|
ВАРИАНТЫ ОТВЕТОВ а)180г/моль
б)342г/моль
в) 684 г/моль
|
ЗАДАНИЕ № 2.
Объем, который занимают 64 г сероводорода
Н2S при нормальных условиях, равен:
|
ВАРИАНТЫ ОТВЕТОВ а)11,2л
б)22,4 л
в) 44,8 л
|
ЗАДАНИЕ № 3.
Количество нейтронов в ядре атома
изотопа U238 равно:
|
ВАРИАНТЫ ОТВЕТОВ а)92
б)146
в) 238
|
ЗАДАНИЕ № 4.
Какой из элементов обладает более сильно выраженными восстановительными свойствами :
|
ВАРИАНТЫ ОТВЕТОВ а)К
б)Са
в) Cs
|
ЗАДАНИЕ № 5.
В какой из последовательностей представлены только формулы веществ с ионной кристаллической решеткой :
|
ВАРИАНТЫ ОТВЕТОВ а) КОН, СаCl2 , Ва(NО3)2
б) NiО,HCl, Н3РО4
в) NН3, Р2О5, НСlО4
|
ЗАДАНИЕ № 6
Определите число связей и их характер в молекуле СCl4:
|
ВАРИАНТЫ ОТВЕТОВ а)4, ковалентный полярный
б) 2, ковалентный неполярный
в) 1, ионный.
|
ЗАДАНИЕ № 7
При нагревании реакционной смеси скорость реакции в данной системе:
|
ВАРИАНТЫ ОТВЕТОВ а) не изменяется
б) увеличивается
в) уменьшается.
|
ЗАДАНИЕ № 8
Химическое равновесие смещается в сторону образования продуктов реакции, если:
|
ВАРИАНТЫ ОТВЕТОВ а) увеличить концентрацию одного из продуктов реакции
б) увеличить концентрацию одного из исходных веществ
в) применить катализатор.
|
ЗАДАНИЕ № 9
В какой из последовательностей представлены только формулы многоосновных кислот:
|
ВАРИАНТЫ ОТВЕТОВ а)КОН, СаCl2, Ва(NО3)2 б) НNО3,HCl, Н3РО4 в) Н2SO3, Н2SO4, Н3РО4
|
ЗАДАНИЕ № 10
Формула высшего оксида элемента, образующего водородное соединение ЭН2, являющееся при нормальных условиях газом, имеет вид:
|
ВАРИАНТЫ ОТВЕТОВ а) ЭО
б) ЭО4
в) ЭО3
|
ЗАДАНИЕ № 11
В какой из последовательностей представлены формулы соединений, диссоциирующих в водных растворах на следующие ионы: Са2+, Cl-, NО3-, Аl3+:
|
ВАРИАНТЫ ОТВЕТОВ а) СаCl2 , Аl (NО3)2, Са NО3, АlCl
б) СаCl2 , Аl (NО3)3, Са (NО3)2, АlCl3
в) СаCl2 , Аl NО, Са NО, АlCl3
|
ЗАДАНИЕ № 12
Уравнение реакции, практически осуществимой в водном растворе, имеет вид:
|
ВАРИАНТЫ ОТВЕТОВ а) NаNО3+HCl = NаCl+HNО3,
б) CuSO4+2KOH=K2SO4+Cu(OH)2
в)Ва(NО3)2+2NаОН=2Nа NО3+Ва(ОН)2
|
ЗАДАНИЕ № 13
В каком из соединений марганец имеет высшую степень окисления:
|
ВАРИАНТЫ ОТВЕТОВ а) MnО2;
б) КМnО4
в) К2МnО4.
|
ЗАДАНИЕ № 14
Укажите количество электронов, принимающих участие в процессе
N-3→ N+5, классифицируйте процесс:
|
ВАРИАНТЫ ОТВЕТОВ а) 2, окисление
б) 8, восстановление
в) 8, окисление.
|
ЗАДАНИЕ № 15
Веществом Х2 в цепочке превращений
СО2+Н2О
Са→Х1→СаСО3 --------→ Х2 является:
|
ВАРИАНТЫ ОТВЕТОВ а) Са(НСО3)2
б) СаО
в) Са(ОН)2
|
ЗАДАНИЕ № 16
В какой из последовательностей представлены только амфотерные элементы:
|
ВАРИАНТЫ ОТВЕТОВ а) К, Ва, Sn
б) Аl, Pb, Zn
в) S, Nа, Р.
|
ЗАДАНИЕ № 17
При взаимодействии оксида серы (IV) с избытком раствора NаОН образуется:
|
ВАРИАНТЫ ОТВЕТОВ а) сульфит натрия и вода
б) гидросульфат натрия
в) сульфат натрия и вода
|
ЗАДАНИЕ № 18
Какую из аллотропных модификаций углерода используют в качестве материала электродов при проведении электролиза:
|
ВАРИАНТЫ ОТВЕТОВ
а) алмаз
б) графит
в) карбин.
|
ЗАДАНИЕ № 19
Какие газы и в каком примерном объемном соотношении являются основными компонентами атмосферного воздуха:
|
ВАРИАНТЫ ОТВЕТОВ
а) водород : кислород, в соотношении 1:1
б)азот : кислород, в соотношении 3,9:1
в) кислород : азот в соотношении 3,9:1
|
ЗАДАНИЕ № 20
Одной из причин кислотных осадков является:
|
ВАРИАНТЫ ОТВЕТОВ
а) сжигание мазута на ТЭЦ
б) применение этилированного бензина в качестве автомобильного топлива
в) использование в зимнее время на дорогах антигололедных реагентов.
|
КОНТРОЛЬ УРОВНЯ ЗНАНИЙ ПО ОБЩЕЙ ХИМИИ
(Предполагается использование в качестве выходного контроля уровня знаний у выпускников средних школ и входного контроля остаточных знаний по химии у студентов первого курса ВИ ЮРГТУ)
Вариант 2
Время выполнения теста: 45 мин
Количество заданий: 20
Тематическая структура теста:
№ задания
|
Тема задания
|
1,2
|
Основные химические понятия и законы
|
3,4
|
Строение атома и периодическая система
|
5,6
|
Химическая связь и строение вещества
|
7,8
|
Скорость химических реакций и химическое равновесие
|
9,10
|
Классы неорганических веществ
|
11,12
|
Равновесия в растворах электролитов
|
13,14
|
Окислительно-восстановительные процессы
|
15,16
|
Химия металлов
|
17,18
|
Химия неметаллов
|
19,20
|
Химия и окружающая среда
|
ЗАДАНИЕ № 1.
Молярная масса глюкозы С6Н12О6
составляет:
|
ВАРИАНТЫ ОТВЕТОВ а)180г/моль
б)342г/моль
в) 684 г/моль
|
ЗАДАНИЕ № 2.
Объем, который занимают 34 г сероводорода
Н2S при нормальных условиях, равен:
|
ВАРИАНТЫ ОТВЕТОВ а)11,2л
б)22,4 л
в) 44,8 л
|
ЗАДАНИЕ № 3.
Количество нейтронов в ядре атома
изотопа U236 равно:
|
ВАРИАНТЫ ОТВЕТОВ а)92
б)144
в) 238
|
ЗАДАНИЕ № 4.
Какой из элементов обладает наименее выраженными восстановительными свойствами :
|
ВАРИАНТЫ ОТВЕТОВ а)К
б)Са
в) Cs
|
ЗАДАНИЕ № 5.
В какой из последовательностей представлены только формулы веществ с молекулярной кристаллической решеткой :
|
ВАРИАНТЫ ОТВЕТОВ а) КОН, СаCl2 , Ва(NО3)2
б) NiО,HCl, Н3РО4
в) NН3, Р2О5, НСlО4
|
ЗАДАНИЕ № 6
Определите число связей и их характер в молекуле СН4:
|
ВАРИАНТЫ ОТВЕТОВ а)4, ковалентный полярный
б) 2, ковалентный неполярный
в) 1, ионный.
|
ЗАДАНИЕ № 7
При охлаждении реакционной смеси скорость реакции в данной системе:
|
ВАРИАНТЫ ОТВЕТОВ а) не изменяется
б) увеличивается
в) уменьшается.
|
ЗАДАНИЕ № 8
Химическое равновесие смещается в сторону образования исходных веществ, если:
|
ВАРИАНТЫ ОТВЕТОВ а) увеличить концентрацию одного из продуктов реакции
б) увеличить концентрацию одного из исходных веществ
в) применить катализатор.
|
ЗАДАНИЕ № 9
В какой из последовательностей представлены только формулы одноосновных кислот:
|
ВАРИАНТЫ ОТВЕТОВ а)КОН, СаCl2, Ва(NО3)2 б) НNО3,HCl, НI в) Н2SO3, Н2SO4, Н3РО4
|
ЗАДАНИЕ № 10
Формула высшего оксида элемента, образующего водородное соединение ЭН3, являющееся при нормальных условиях газом, имеет вид:
|
ВАРИАНТЫ ОТВЕТОВ а) ЭО
б) Э2О5
в) ЭО3
|
ЗАДАНИЕ № 11
В какой из последовательностей представлены формулы соединений, диссоциирующих в водных растворах на следующие ионы: Са2+, Cl-, NО3-, Аl3+:
|
ВАРИАНТЫ ОТВЕТОВ а) СаCl2 , Аl (NО3)2, Са NО3, АlCl
б) СаCl2 , Аl (NО3)3, Са (NО3)2, АlCl3
в) СаCl2 , Аl NО, Са NО, АlCl3
|
ЗАДАНИЕ № 12
Уравнение реакции, практически не осуществимой в водном растворе, имеет вид:
|
ВАРИАНТЫ ОТВЕТОВ а) NаNО3+HCl = NаCl+HNО3,
б) CuSO4+2KOH=K2SO4+Cu(OH)2
в)Fe(NО3)2+2NаОН=2NаNО3+Fe(ОН)2
|
ЗАДАНИЕ № 13
В каком из соединений марганец имеет высшую степень окисления:
|
ВАРИАНТЫ ОТВЕТОВ а) MnО2;
б) КМnО4
в) К2МnО4.
|
ЗАДАНИЕ № 14
Укажите количество электронов, принимающих участие в процессе
N-3→ N0, классифицируйте процесс:
|
ВАРИАНТЫ ОТВЕТОВ а) 3, окисление
б) 3, восстановление
в) 8, окисление.
|
ЗАДАНИЕ № 15
Веществом Х2 в цепочке превращений
СО2+Н2О
Са→Х1→СаСО3 --------→ Х2 является:
|
ВАРИАНТЫ ОТВЕТОВ а) Са(НСО3)2
б) СаО
в) Са(ОН)2
|
ЗАДАНИЕ № 16
В какой из последовательностей представлены только щелочноземельные металлы:
|
ВАРИАНТЫ ОТВЕТОВ а) Са, Ва, Sr
б) Аl, Pb, Zn
в) S, Nа, Р.
|
ЗАДАНИЕ № 17
При взаимодействии оксида серы (IV) с избытком раствора NаОН образуется:
|
ВАРИАНТЫ ОТВЕТОВ а) сульфит натрия и вода
б) гидросульфат натрия
в) сульфат натрия и вода
|
ЗАДАНИЕ № 18
Какую из аллотропных модификаций углерода используют в качестве материала электродов при проведении электролиза:
|
ВАРИАНТЫ ОТВЕТОВ
а) алмаз
б) графит
в) карбин.
|
ЗАДАНИЕ № 19
Какие газы и в каком примерном объемном соотношении являются основными компонентами атмосферного воздуха:
|
ВАРИАНТЫ ОТВЕТОВ
а) водород : кислород, в соотношении 1:1
б)азот : кислород, в соотношении 3,9:1
в) кислород : азот в соотношении 3,9:1
|
ЗАДАНИЕ № 20
Одной из причин кислотных осадков является:
|
ВАРИАНТЫ ОТВЕТОВ
а) сжигание мазута на ТЭЦ
б) применение этилированного бензина в качестве автомобильного топлива
в) использование в зимнее время на дорогах антигололедных реагентов.
|
2.Тесты первого промежуточного контроля знаний по общей химии
Контролируемые темы:
Основные понятия и законы химии. Закон эквивалентов.
Состав и строение атома.
Свойства элементов и их соединений
Химическая связь
Типы взаимодействия молекул
А. Основные понятия и законы химии. Закон эквивалентов.
Найдите ошибочное утверждение. К химическим свойствам вещества относят:
а)взаимодействие с кислотами б) электропроводность
в) изменение цвета при нагревании г) горение
Количество вещества – это:
а)порция вещества, измеренная в молях б) число структурных единиц, равное 6ּ1023 в)масса вещества г) навеска вещества
Чистыми называют вещества, которые:
а) обладают постоянными свойствами
б) нельзя обнаружить под микроскопом разнородные частицы
в) состоят из молекул одного вида г) не содержат примесей
Вычислить количество вещества и количество эквивалентов вещества в 39 г Na2S.
a) ν Na2S =1 моль б ) νNa2S=0,5моль в)νNa2S=νэкв. г)νNa2S=39
ν экв=0,5 νэкв=1 моль νэкв=0,5 моль νэкв=19,5
Рассчитать молярную массу эквивалента KMnO4 восстановленной до MnO2.
а ) 52,6 г б) 31,6 в) 158 г г) 48,6
Рассчитать молярную массу эквивалента HNO3 при ее восстановлении до NO2.
а ) 21 г б) 63 г в) 0,031 г г) 3,1 г
Чему равна молярная масса эквивалента ортофосфорной кислоты в обменных реакциях?
а ) 21 г б) 32,6 в) 31 г г) 27 г
Объем равный 11,2 л занимает:
а) 14 г N2 б) 2 г H2 в) 8 г O2 г) 17 г Cl2
Б. Состав и строение атома.
Укажите сколько нейтронов в ядре изотопа бария 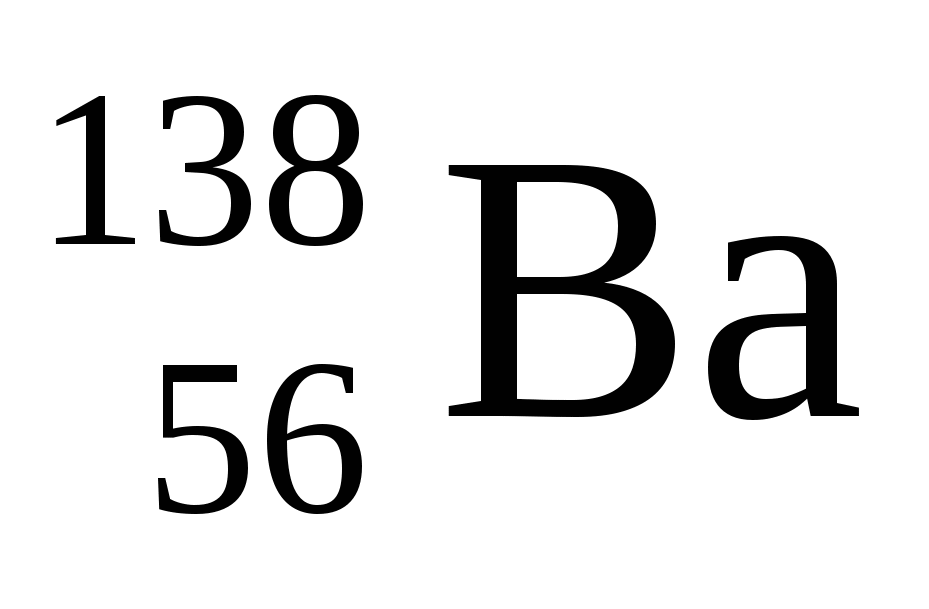
а )56 б )82 в )138 г ) 194
Укажите сколько электронов в атоме изотопа калия 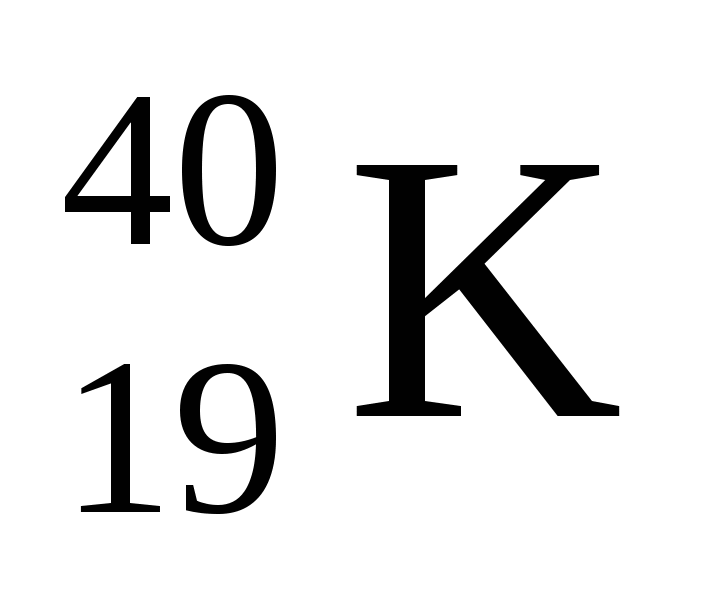
а )40 б )19 в )21 г ) 59
Какому иону соответствует формула: 1S22S22P63S23P63d104S2
a ) Zn2+ б ) Са2+ в ) As3+ г ) Se
Какая формула соответствует F-?
а ) 1S22S22P4 б ) 1S22S22P6 в ) 1S22S22P3 г ) 1S22S22P5
Какому иону соответствует формула: 1S22S22P63S23P63d10
а ) As5+ б ) Са2+ в ) Fe2+ г ) Br-
Какие электроны атома хрома участвуют в образовании химических связей?
а ) 3 d54S1 б ) 3 d 64S0 в ) 3d44S2 г ) 3 d 7
Указать электронную конфигурацию азота в степени окисления +5.
а) 2s22p6 б) 2s02p0 в) 2s22p3 г)2s22p5
Электронная конфигурация атома углерода в возбужденном состоянии:
а) 2s22p2 б) 2s22p4 в) 2s12p3 г) 2s22p4
На энергетическом уровне с главным квантовым числом, равным 3, максимально может расположиться электронов:
а) 2 б) 18 в) 32 г) 26
Химический элемент, завершающий седьмой период, еще не открыт. Однако научный прогноз позволяет определить его порядковый номер:
а) 120 б) 118 в) 110 г) 116
На каком подуровне энергия электрона максимальна:
а) 2s б) 2p6 в) 3d г) 4P
На энергетическом подуровне с орбитальным квантовым числом, равным 3, максимально может расположиться электронов:
а) 2 б) 6 в) 10 г) 14

|
|
|
 Скачать 423 Kb.
Скачать 423 Kb.
