|
|
тесты химия. Тесты входного, промежуточного и итогового контроля по курсу Общая химия для специальности (ей)
Г. Дисперсные системы. Органические полимерные материалы
Дисперсной системой является: а)соляной раствор, б) молоко; в) сахар; г) минеральная вода
Коллоидные системы отличаются от истинных растворов:
а)концентрацией б) плотностью
в) размерами частиц растворенного вещества г) способами приготовления
Согласно теории строения коллоидных растворов мицелла является : а)электронейтральной, б) отрицательно заряженной, ; в) положительно заряженной; г) радикалом
Для золя AgI, полученного по реакции AgNO3+ KI(изб) = AgI↓ + КNO3 коагуляцию вызывают : а)катионы, б) анионы; в) катионы +анионы; г) нейтральные частицы
При растворении в воде ПАВ величина поверхностного натяжения: а)уменьшается, б) не изменяется, ; в) увеличивается; г) уменьшается, затем увеличивается.
Полиэтилен получают в результате реакции: а) вулканизации, б) сополимеризации; в)поликонденсации, г)полимеризации.
Макромолекулы природного каучука имеют : а) сетчатую структуру, б) разветвленную структуру; в) линейную структуру, г) беспорядочную структуру.
Полимер состава: (-СН2-С = СН – СН2-)n называют:
СН3
а) полипропилен б) резина в)каучук г) пластмасса
O O
// | |
Определите тип реакции: n NH2-(CH2)5-C → (-NH-(CH2)5-C-)n + nH2O
\
OH
а) полимеризация б) поликонденсация в) изомеризация г) гидратация
ВСЕГО 70 тестов
4.Тесты третьего промежуточного контроля знаний по общей химии
Контролируемые темы:
Окислительно-восстановительные процессы..
Электролиз.
Коррозия металлов
Химическая идентификация.
А. Окислительно-восстановительные процессы
При окислении происходит:
а) взаимодействие с кислородом
б) перемещение электронной пары
в) отдача электронов атомом, молекулой или ионом
г) присоединение электронов
Среди приведенных ниже схем реакций укажите схемы реакций диспропорционирования
а) NH4NO3 →N2O + H2O,
б) NH4NO2 → N2 + H2O,
в) KClO3 →KClO4 + KCl,
г) KClO3 → KCl + O2.
Найдите сумму коэффициентов в уравнении окислительно-восстановительной реакции: Fe(OH)2 + O2 + H2O → Fe(OH)3
а) 10 б) 9 в)11 г) 8
Какие из металлов, химические знаки которых приведены ниже, реагируют при нормальных условиях с водой: а) Cr,б) Rb,в) Ca,г) Ni,
Е0 MnO4/Mn2+ =1,51B; E0 Cr2O72-/2Cr3+= 1,33 B. Более сильным окислителем является?
а) ион MnO4- б) ион Cr2O72- в) ион Mn2+ г) ион Cr3+
Используя ряд активности металлов, определите в какой паре металлов можно получить наибольшее значение ЭДС в гальваническом элементе?
а) Mn - Sn б) Mn - Ag в) Mn - Fe г)Mn – Au
Какой из приведенных ниже процессов протекает на катоде при электролизе водного раствора сульфата натрия:
а) 2H2O-4e → O2 + 4H+,
б) Na+ + 2e →NaO,
в) 2H2O + 2e → H2 + 2OH-,
г) 2H+ + 2e → H2O.
Что будет выделяться на катоде и аноде, если водный раствор сульфата меди (II) подвергнуть электролизу?
а) Cu и SO4 б)Cu и O2 в) H2 и O2 г)H2 и SO4
Что останется в растворе , если водный раствор нитрата серебра подвергнуть электролизу?
а) H2O б) HNO3 в) AgNO3 г) AgОН
Какое из перечисленных ниже покрытий на железе является анодным?
а) Zn б) Ni в)Sn г)Pb
При повреждении катодного покрытия происходит: а) разрушение металла покрытия б) разрушение металла детали в) пассивация поверхности детали г) ничего не происходит
Какая из указанных ниже реакций будет протекать с выделением водорода?
а) Hg + HCl → б) Al + HCl → в) Au + H2SO4 (разб.) г)Ag + HCl
Сумма коэффициентов в уравнении реакции
FeSO4 + HNO3 = NO + Fe(NO3)3 + Fe2(SO4)3 + H2O … равна:
а) 12 б) 14 в) 21 г) 29
При стандартных состояниях веществ реакция:
Cr2O72- + 6SO42- + 14H+ = 2Cr3+ + 3S2O82- + 7H2O протекает:
а) вправо б) влево в) система находится в равновесии
Для выбора индикатора в методе нейтрализации необходимо знать:
а ) рН в момент б) рН исходных в) интервал г) константу
эквивалентности растворов действия равновесия
и рТ индикатора индикатора
Титруют Н2SO4 раствором КОН, выбрать индикатор:
а ) лакмус б) фенолфталеин в) метилоранж г) метилрот
Методы анализа, основанные на способности вещества поглощать свет определенной длины: а)спектрофотометрические, б) потенциометрические, в) радиометрические, г) фотоэмиссионные
Индикаторным параметром для установления качественного состава веществ спектральными методами является: а)интенсивность линии поглощения (испускания), б) длины волны поглощения (испускания), в) оптическая плотность, г) фотоэлектрический ток
В основе потенциометрического метода лежит уравнение : а)Гиббса, б) Фарадея, в) Ламберта-Бугера-Бэра, г) Нернста
При взаимодействии Fe3+ с гексацианоферритом (II) калия образуется: а)белый осадок, б) бурый осадок, в) синий осадок, г) красный осадок
Общее количество контрольных тестов- 140
5.Образец итогового экзаменационного теста.
Рассчитать молярную массу эквивалента HNO3 при ее восстановлении до NO2.
а ) 21 г б) 63 г в) 0,031 г г) 3,1 г
Чему равна молярная масса эквивалента ортофосфорной кислоты в обменных реакциях?
а ) 21 г б) 32,6 в) 31 г г) 27 г
Объем равный 11,2 л занимает:
а) 14 г N2 б) 2 г H2 в) 8 г O2 г) 17 г Cl2
Укажите сколько нейтронов в ядре изотопа бария 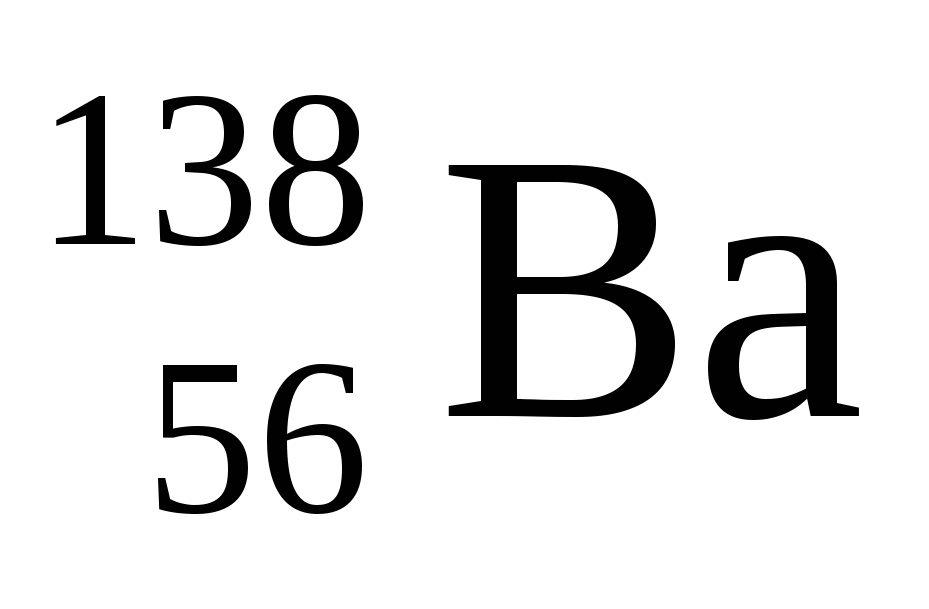
а )56 б )82 в )138 г ) 194
Какому иону соответствует формула: 1S22S22P63S23P63d104S2
a ) Zn2+ б ) Са2+ в ) As3+ г ) Se
На энергетическом уровне с главным квантовым числом, равным 3, максимально может расположиться электронов:
а) 2 б) 18 в) 32 г) 26
На каком подуровне энергия электрона максимальна:
а) 2s б) 2p6 в) 3d г) 4P
Как меняется электроотрицательность в ряду: F, CI, Br, I?
а ) возрастает, б ) убывает в ) периодически меняется г) остается постоянной.
Для какого элемента справедливо уравнение реакции:
Э2О7 + Н2О ↔ 2НЭО4
а ) Р б ) N в ) CI г ) S
Формула высшего оксида элемента, образующего летучий гидрид состава ЭН2:
а ) ЭО б ) ЭО2 в ) ЭО4 г ) ЭО3
При взаимодействии SO2 с избытком едкого натра образуются:
а ) гидросульфит натрия б ) гидросульфат натрия в ) сульфит натрия и вода г ) сульфат натрия и вода.
В какой смеси веществ возможна химическая реакция?
а ) SO2 + HCI ↔ б ) SO2 + Na2O↔
в ) SO2 + CO2 ↔ г ) SO2 + Na2SO4
В каком из соединений образуется наиболее прочная химическая связь?
а ) LiF б ) LiCI в ) LiBr г ) LiI
Укажите вещества с преимущественно ионным типом связи:
а)Na2O б)H2O в)HCl г)H2
Вещества, содержащие только ковалентные полярные связи:
а)H3PO4, BF3, CH3COONH4
б) H2SO4, F2, P2O5
в) PF5, Cl2O7, NH4Cl
г)NO2, SOCl2, CH3COOH
Степень окисления и к.ч. комплексообразователя [Pt(NH3)4CI2]2+
а ) +2;4 б) +4;6 в) +2;6 г) +4; 4
Какой комплексный ион образуется при взаимодействии двух солей CrCl3 + 3KCl:
а) [KCl6]3- б)[K3(CrCl6)]3+ в) [CrCl6]3- г) [Cr(K3Cl)]3+
Стандартная энтальпия образования SO2 равна -297 кДж/моль. Чему равно количество тепла, выделившееся при сгорании 16 г серы:
а) 74,25 кДж б) 148,5 кДж в) 297 кДж г) 594 кДж.
Как изменится скорость прямой реакции 2СО (г)+О2(г)↔2СО2(г), при увеличении концентрации [СО] в 3 раза?
а) увеличится втрое б) увеличится в 9 раз в) не изменится г) уменьшится в 3 раза
Чему равен температурный коэффициент, если при охлаждении на 300С скорость реакции уменьшилась в 8 раз.
а ) 2 б) 3 в) 4 г) 8
Куда сместится равновесие: Ст+ О2(г)↔СО2(г) при увеличении давления?
а) влево б) вправо в) не сместится г) в сторону угла
Смешали 200 г 20%-ного и 300г 10%-ного растворов глюкозы. Концентрация полученного раствора будет:
а) 15% б) 18% в) 16%г) 14%.
При растворении 11,6 г вещества в 400 г воды температура кристаллизации раствора стала составлять 0,93°C. Молярная масса вещества равна, г/моль: а) 93 б) 58 в) 180 г) 342.
Какой из растворов замерзает при более низкой температуре, если молярные концентрации равны?
а) KI б) CuCI2 в) NaCI г) С12Н22О11
Указать уравнение реакции, практически осуществимой в растворе:
а) Ва(NО3)2+ NaOH→
б) Fe2(SO4)3 + НNO3→
в) Na NO3+ НCl →
г) CuSO4+ NaOH →
Раствор, в 500 мл которого растворено 1,825 г НCl, имеет рН, равный:
а) 1 б) 4 в) 7 г) 13
Какая из указанных солей дает щелочную реакцию среды за счет гидролиза:
а ) Na2CO3 б) AlCl3 в) (NH4)2SO4 г)KNO3
ПР (BaSO4) =1·10-10, ПР (CaSO4) =6·10-5 ПР (PbSO4) =1, 8·10-8
Какой осадок при равных условиях образуется первым?
а) CaSO4 б) BaSO4 в) одновременно г) не образуется
Дисперсной системой является: а)соляной раствор, б) молоко; в) сахар; г) минеральная вода
Для золя AgI, полученного по реакции AgNO3+ KI(изб) = AgI↓ + КNO3 коагуляцию вызывают : а)катионы, б) анионы; в) катионы +анионы; г) нейтральные частицы
При растворении в воде ПАВ величина поверхностного натяжения: а)уменьшается, б) не изменяется, ; в) увеличивается; г) уменьшается, затем увеличивается.
Полиэтилен получают в результате реакции: а) вулканизации, б) сополимеризации; в)поликонденсации, г)полимеризации Макромолекулы природного каучука имеют : а) сетчатую структуру, б) разветвленную структуру; в) линейную структуру, г) беспорядочную структуру.
Найдите сумму коэффициентов в уравнении окислительно-восстановительной реакции: Fe(OH)2 + O2 + H2O → Fe(OH)3
а) 10 б) 9 в)11 г) 8
Методы анализа, основанные на способности вещества поглощать свет определенной длины: а)спектрофотометрические, б) потенциометрические, в) радиометрические, г) фотоэмиссионные
При взаимодействии Fe3+ с гексацианоферритом (II) калия образуется: а)белый осадок, б) бурый осадок, в) синий осадок, г) красный осадок
|
|
|
 Скачать 423 Kb.
Скачать 423 Kb.