|
|
тесты химия. Тесты входного, промежуточного и итогового контроля по курсу Общая химия для специальности (ей)
В. Свойства элементов и их соединений
Как меняется электроотрицательность в ряду: F, CI, Br, I?
а ) возрастает, б ) убывает в ) периодически меняется г) остается постоянной.
У какого из перечисленных элементов наибольшее сродство к электрону?
а ) О б ) S в ) Se г ) Те
Энергия ионизации атомов в группе растет
а) слева-направо б ) снизу вверх в) от бора а астату
г) справа – налево.
Атом, какого элемента имеет наибольший радиус?
а ) С б ) В в ) О г ) F
Для какого элемента справедливо уравнение реакции:
Э2О7 + Н2О ↔ 2НЭО4
а ) Р б ) N в ) CI г ) S
Для какого элемента справедливо уравнение реакции
Э2О5 + 3 Н2О ↔ 2 Н3ЭО4
а ) В б ) Р в ) CI г) N
Формула высшего оксида элемента, образующего летучий гидрид состава ЭН2:
а ) ЭО б ) ЭО2 в ) ЭО4 г ) ЭО3
При взаимодействии, какого элемента с кислородом образуется пероксид?
а ) Fe б ) Na в ) Li г )Mg
Какие из ниже написанных оснований будут реагировать с едким натром?
а ) Zn(OH)2 б ) Al(OH)3 в ) Mg(OH)2 г ) Fe(OH)2
Укажите, какие из ниже написанных окислов можно отнести к кислотным:
а ) SO2 б ) FeO3 в ) Cr2 O3 г ) СаО
Установите, в каком случае наблюдается несоответствие соответствие между левыми и правыми частями уравнений реакций взаимодействия:
а )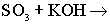 б ) б ) 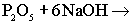
в ) 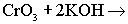 г ) г ) 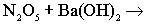
Правые части уравнений реакций взаимодействия:
12. При взаимодействии SO2с избытком едкого натра образуются:
а ) гидросульфит натрия б ) гидросульфат натрия в ) сульфит натрия и вода г ) сульфат натрия и вода.
13.В каком случае происходит реакция образования соли?
а )K2O + FeO → б )HgO + CaO → в ) Na2O + N2O3 → г )P2O5 + CO2 →
14. В какой смеси веществ возможна химическая реакция?
а ) SO2 + HCI ↔ б ) SO2 + Na2O↔
в ) SO2 + CO2 ↔ г ) SO2 + Na2SO4
14.Какое из приведенных ниже соединений имеет название сульфид натрия?
ٱ Na2S2O3 ٱ Na2SO3 ٱ Na2SO4 ٱ Na2S
Г. Химическая связь
В каком из соединений образуется наиболее прочная химическая связь?
а ) LiF б ) LiCI в ) LiBr г ) LiI
Укажите вещества с преимущественно ионным типом связи:
ٱ Na2O ٱ H2O ٱ HCl ٱ H2
Вещества, содержащие только ковалентные полярные связи:
а)H3PO4, BF3, CH3COONH4
б) H2SO4, F2, P2O5
в) PF5, Cl2O7, NH4Cl
г)NO2, SOCl2, CH3COOH
4.В каком веществе нет химических связей между атомами серы?
а) натрий дисульфид б) сероуглерод в) натрий дитионит г)натрий тиосульфат
5.Определите, каким кислотам принадлежат приведённые ниже графические формулы:
1. 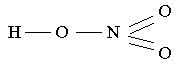 2. 2. 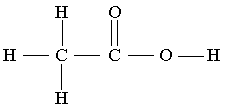
6.Определите, графическая формула какой соли приведена ниже, напишите ее химическую формулу:
Какие элементы, химические знаки которых приведены ниже, способны к образованию межмолекулярных водородных связей:а) Sе,б) C,в) O,г) Te,
Г. Типы взаимодействия молекул
Какой заряд имеет ион [Fe2+(NC)5OH2] ?
а) 3- б ) -2 в ) 3+ г ) +2
Определить степень окисления и к.ч. комплексообразователя в NH4CI.
a) +1, 4 б) -3, 1 в) -3,4 г ) +1,1
Чему равен заряд комплексного иона [Fe(NO)6]CI3
a) 3+ б) 1+ в) 4+ г) 2+
Чему равно к.ч. кобальта в соединении К2[Со(NH3)2(NO2)4]?
а) 2 б) 4 в) 6 г) 8
Степень окисления и к.ч. комплексообразователя [Pt(NH3)4CI2]2+
а ) +2;4 б) +4;6 в) +2;6 г) +4; 4
Какой заряд комплексного иона К3[Cr(OH)6]?
а ) 3+ б) 3- в) 1- г) 1+
Ртуть(II) нитрат при действии избытка калий иодида перейдет в:
а) ртуть(I) иодид б) ртуть(II) иодид
в) ртуть г) калий тетраиодомеркурат(II)
Какой комплексный ион образуется при взаимодействии двух солей CrCl3 + 3KCl:
а) [KCl6]3- б)[K3(CrCl6)]3+ в) [CrCl6]3- г) [Cr(K3Cl)]3+
ВСЕГО 50 тестов
3.Тесты второго промежуточного контроля знаний по общей химии
Контролируемые темы:
Химическая термодинамика..
Химическая кинетика и равновесие
Растворы. Свойства растворов
Дисперсные системы
Органические полимерные материалы
А. Химическая термодинамика
ΔНореакции: CaO(к) + CO2(г) = CaCO3(к) составляет, кДж
а) -177 б) -1,77 в) 177 г) -2237
При сгорании 1 г магния выделилось 25 кДж теплоты. На основании этих данных молярная теплота образования оксида магния (кДж/моль) равна:
а) 600 б) 1000 в) 1200 г) 2000
Стандартная энтальпия образования SO2 равна -297 кДж/моль. Чему равно количество тепла, выделившееся при сгорании 16 г серы:
а) 74,25 кДж б) 148,5 кДж в) 297 кДж г) 594 кДж
Поприведенным стандартным значениям изменения энтальпии и энтропии для химической реакции 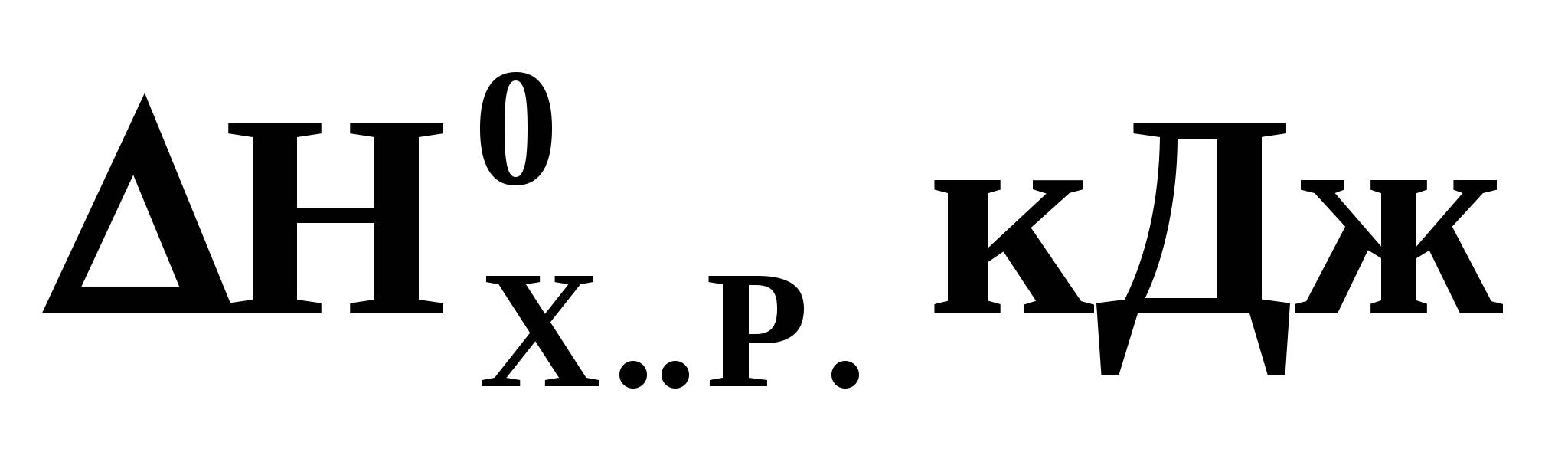 =+ 173, =+ 173, 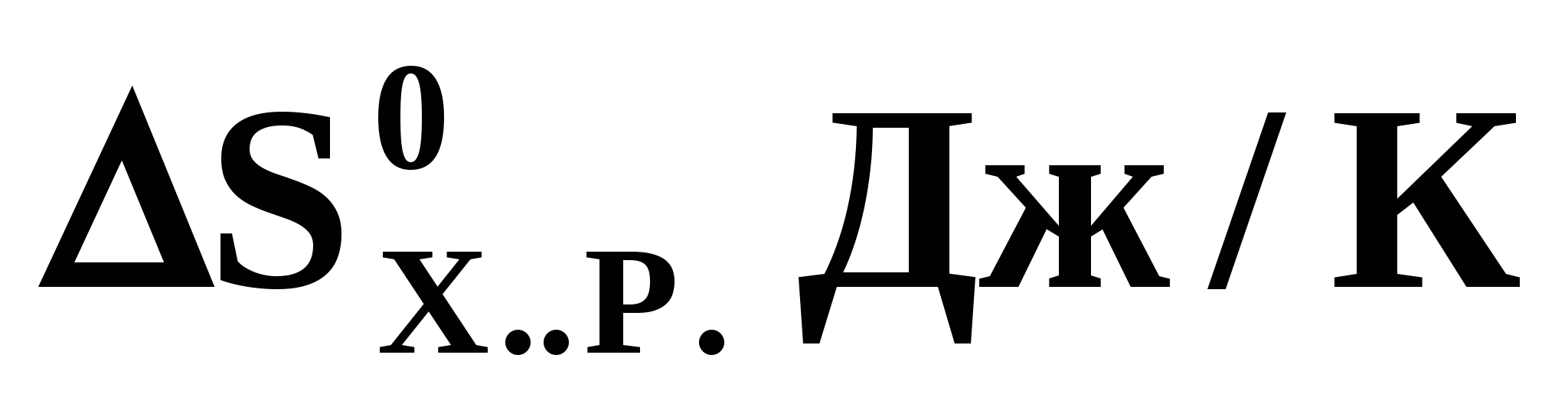 = +176 рассчитайте температуру, при которой равновероятны прямое и обратное направления данной реакции: = +176 рассчитайте температуру, при которой равновероятны прямое и обратное направления данной реакции:
а) 0,98К б)9,8К в) 98К г) 980К
В изолированной системе реакция может протекать самопроизвольно, если:
а) изменение энтропии системы положительно б) изменение энтропии системы отрицательно в) изменение энтальпии системы положительно г) изменение энергии Гиббса системы отрицательно
В открытой системе реакция может протекать самопроизвольно, если:
а) изменение энтропии системы положительно б) изменение энтропии системы отрицательно в) изменение энтальпии системы положительно г) изменение энергии Гиббса системы отрицательно
Б. Химическая кинетика и равновесие
Единицей измерения скорости реакции может быть:
а) моль/л·ч б) моль/ч в) г/моль·с г) м/моль·ч
От каких факторов не зависит константа скорости?
а )от природы б ) от растворителя в ) от t0C г) от концентрации реагирующих веществ.
Применение катализатора преследует:
а) смещение равновесия б) снижение энергии активации в) снижение расхода реагентов г) увеличение выхода продуктов
Как изменится скорость прямой реакции 2СО (г)+О2(г)↔2СО2(г), при увеличении концентрации [СО] в 3 раза?
а) увеличится втрое б) увеличится в 9 раз в) не изменится г) уменьшится в 3 раза
Как нужно изменить давление, чтобы увеличить скорость реакции получения аммиака в 16 раз?
а) в 9 раз б) в 2 раза в) в 4 раза г) не менять
Во сколько раз увеличится скорость прямой реакции 2H2 + O2  2H2O при увеличении давления в 3 раза? 2H2O при увеличении давления в 3 раза?
а) 9 б)27 в)18 г)не изменится
Чему равен температурный коэффициент, если при охлаждении на 300С скорость реакции уменьшилась в 8 раз.
а ) 2 б) 3 в) 4 г) 8
Температурный коэффициент γ=2. На сколько градусов нужно нагреть реакционную смесь для увеличения скорости реакции в 16 раз?
а) на 100С б) на 300С в) на 400С г) на 200С
Чему равна Кр реакции: Ат + В г ↔ Сг + Д т
а ) [С]/[В] б ) [В] / [С] в ) [С]·[Д] / А]·[В] г ) [А]В] / [С]·[Д]
Для реакции: N2 + O2  2NO правильным является выражение константы химического равновесия: 2NO правильным является выражение константы химического равновесия:
а )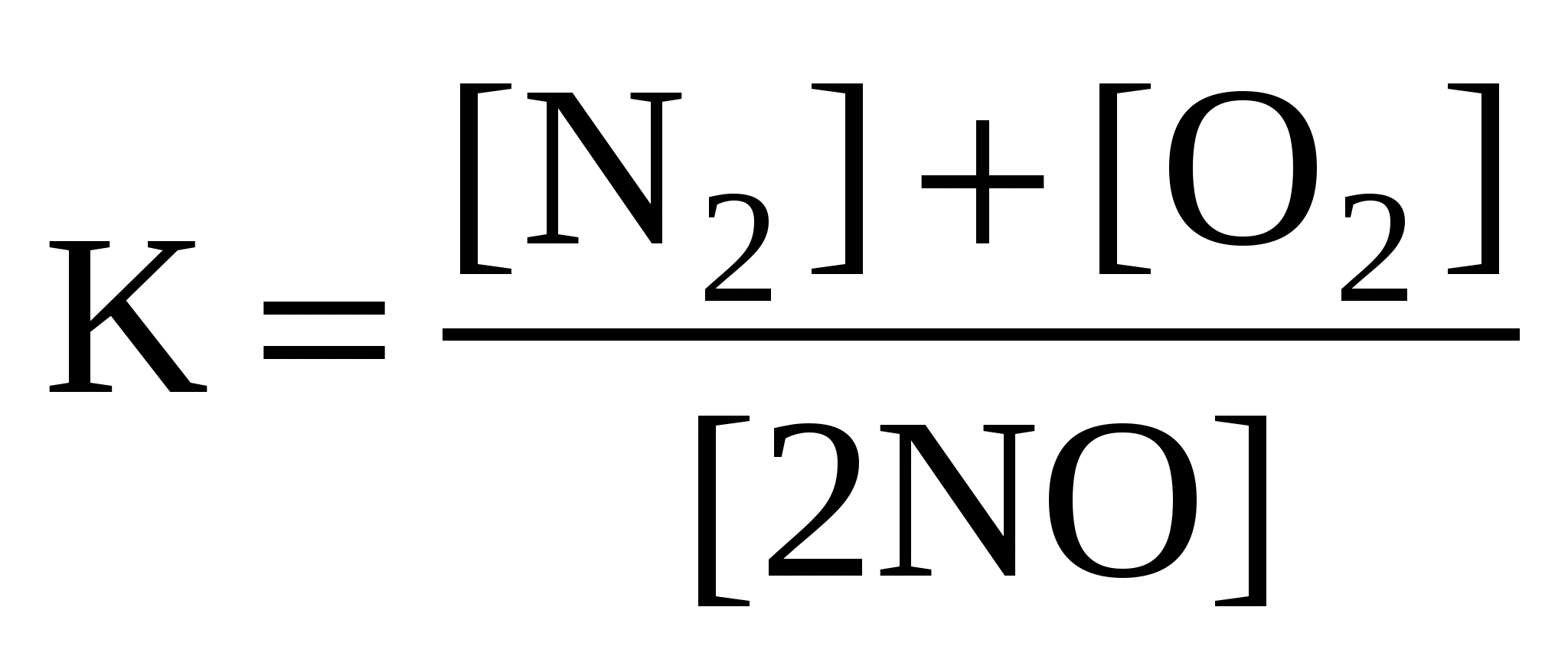 б) б)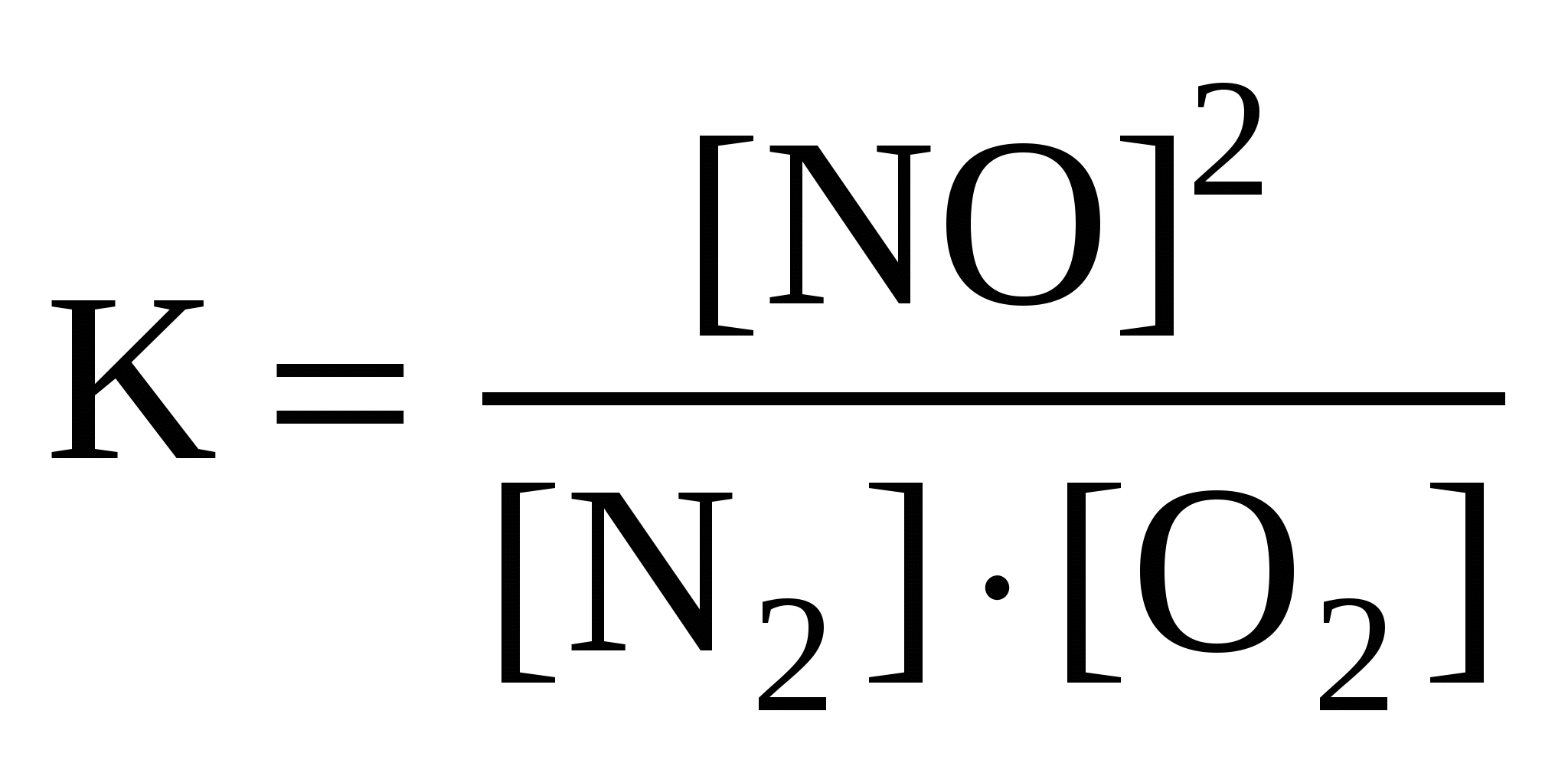 в) в)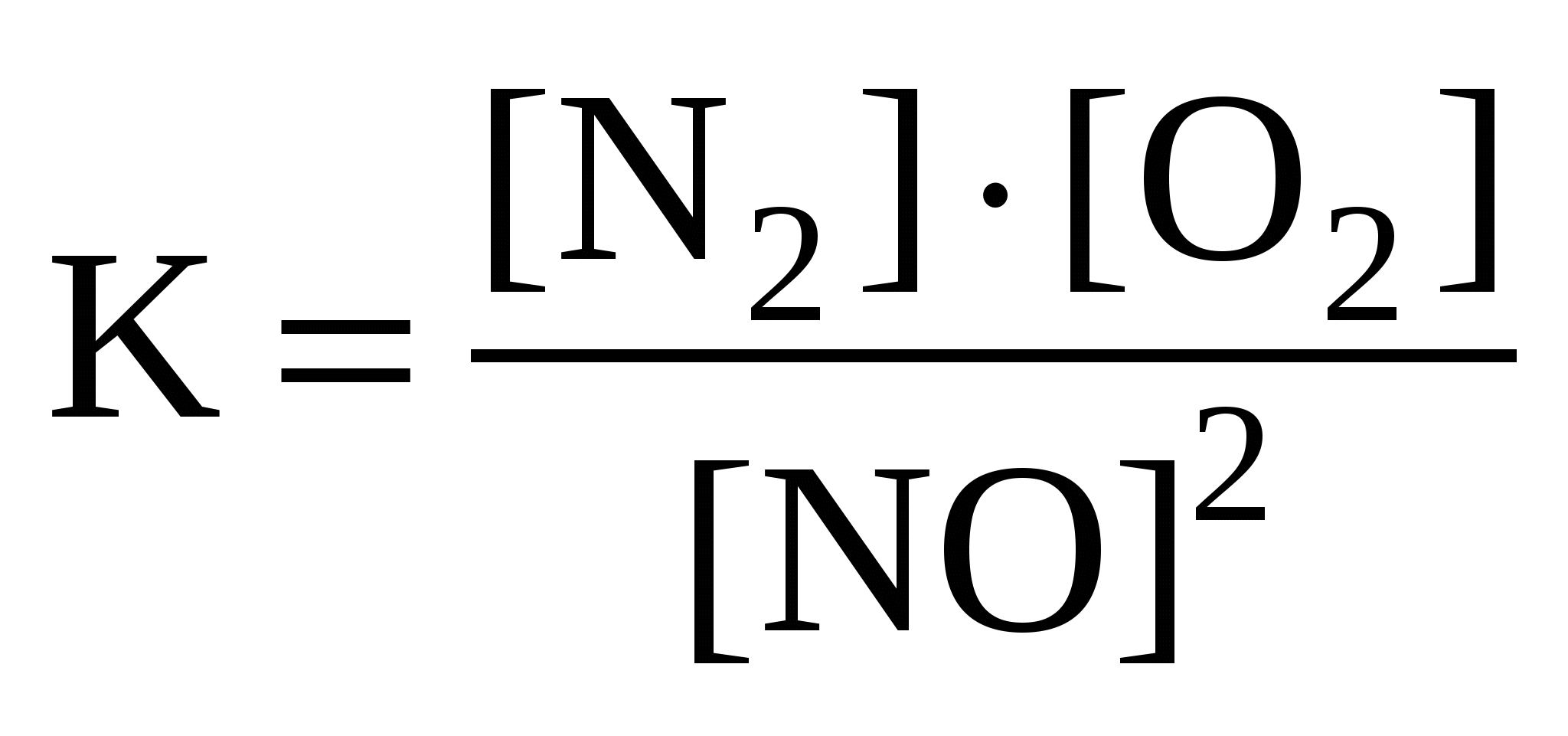 г) г)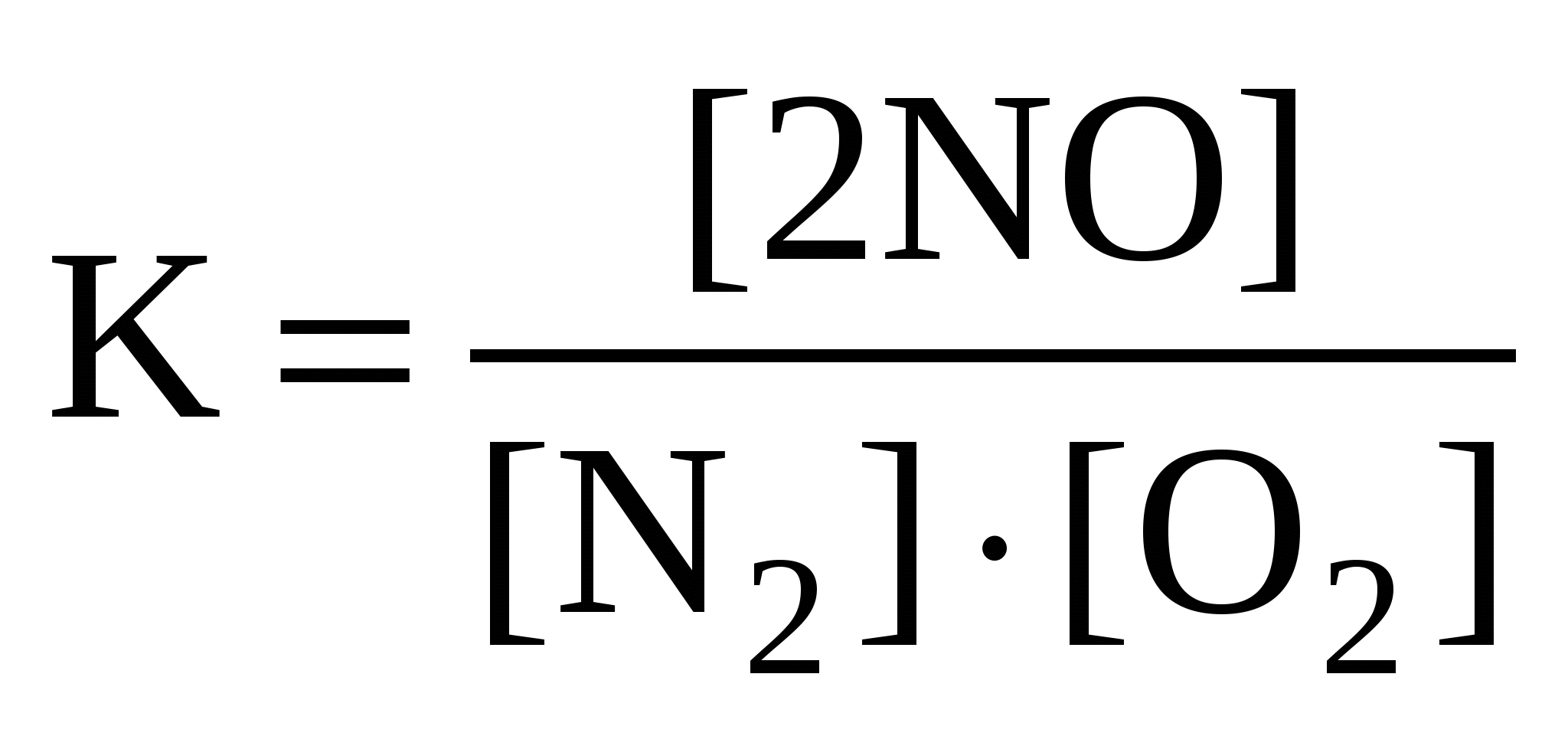
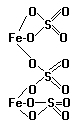
Для реакции Ag2S( к) + 2HCl( г) ↔ H2S( г) + 2AgCl( к) правильным является выражение константы химического равновесия:
а )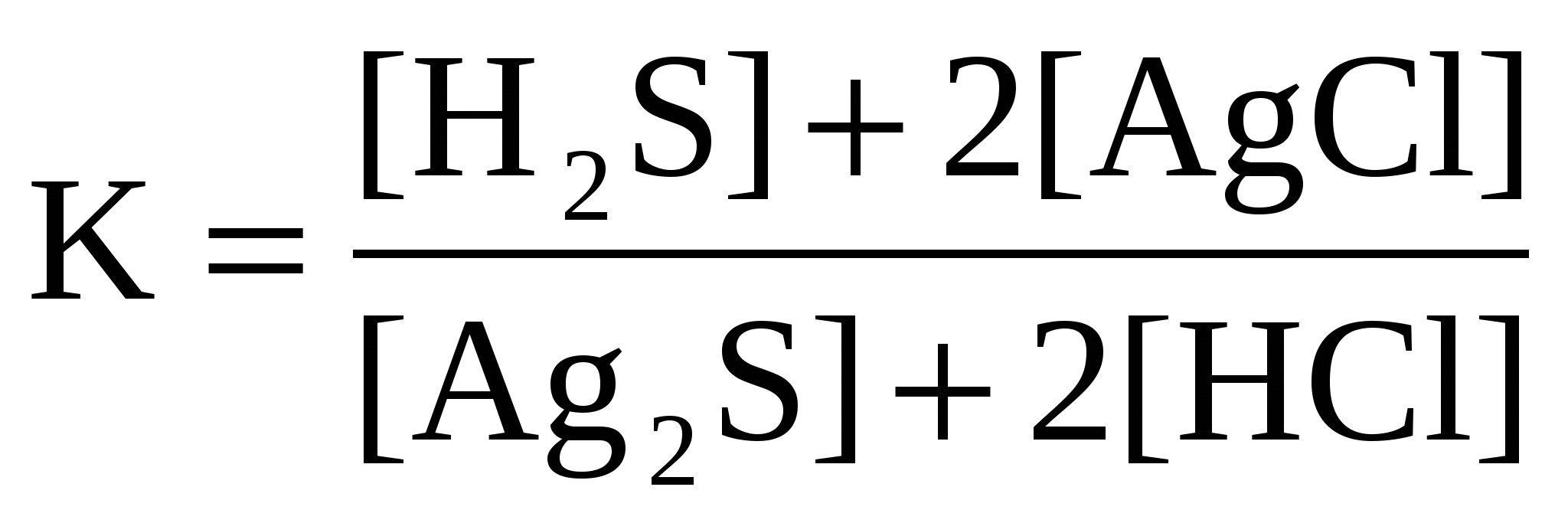 б) б) 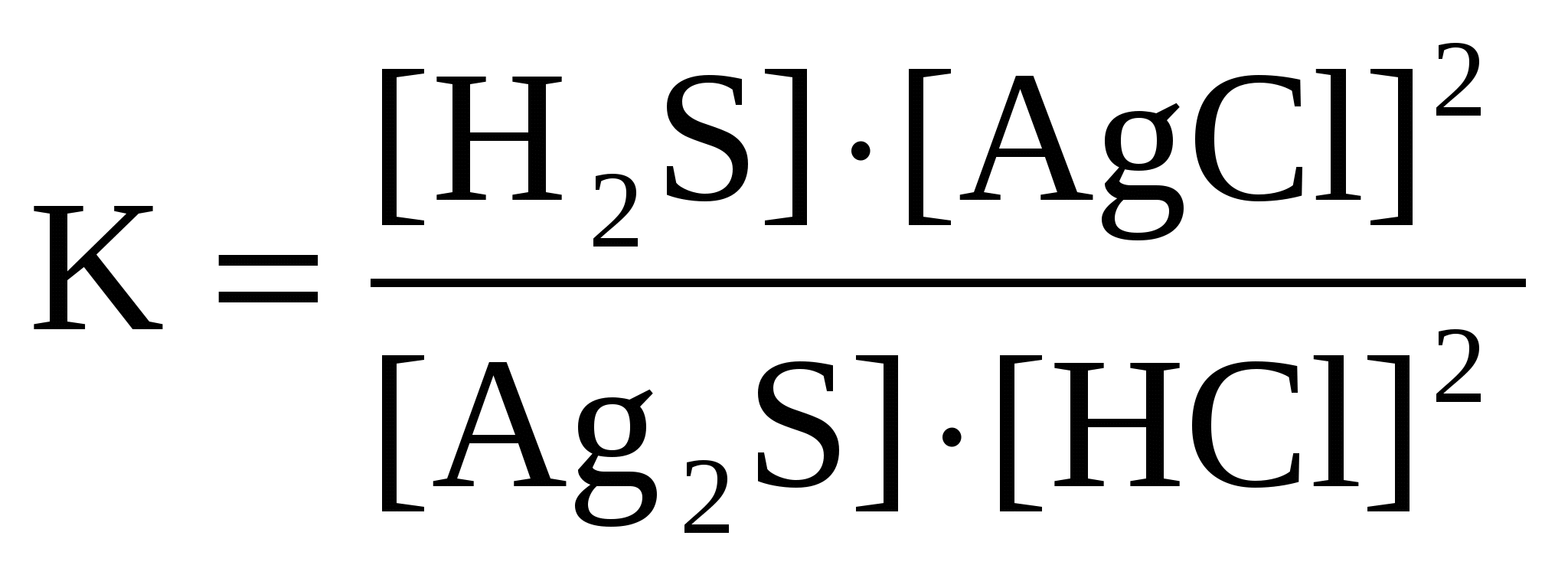 в) в) 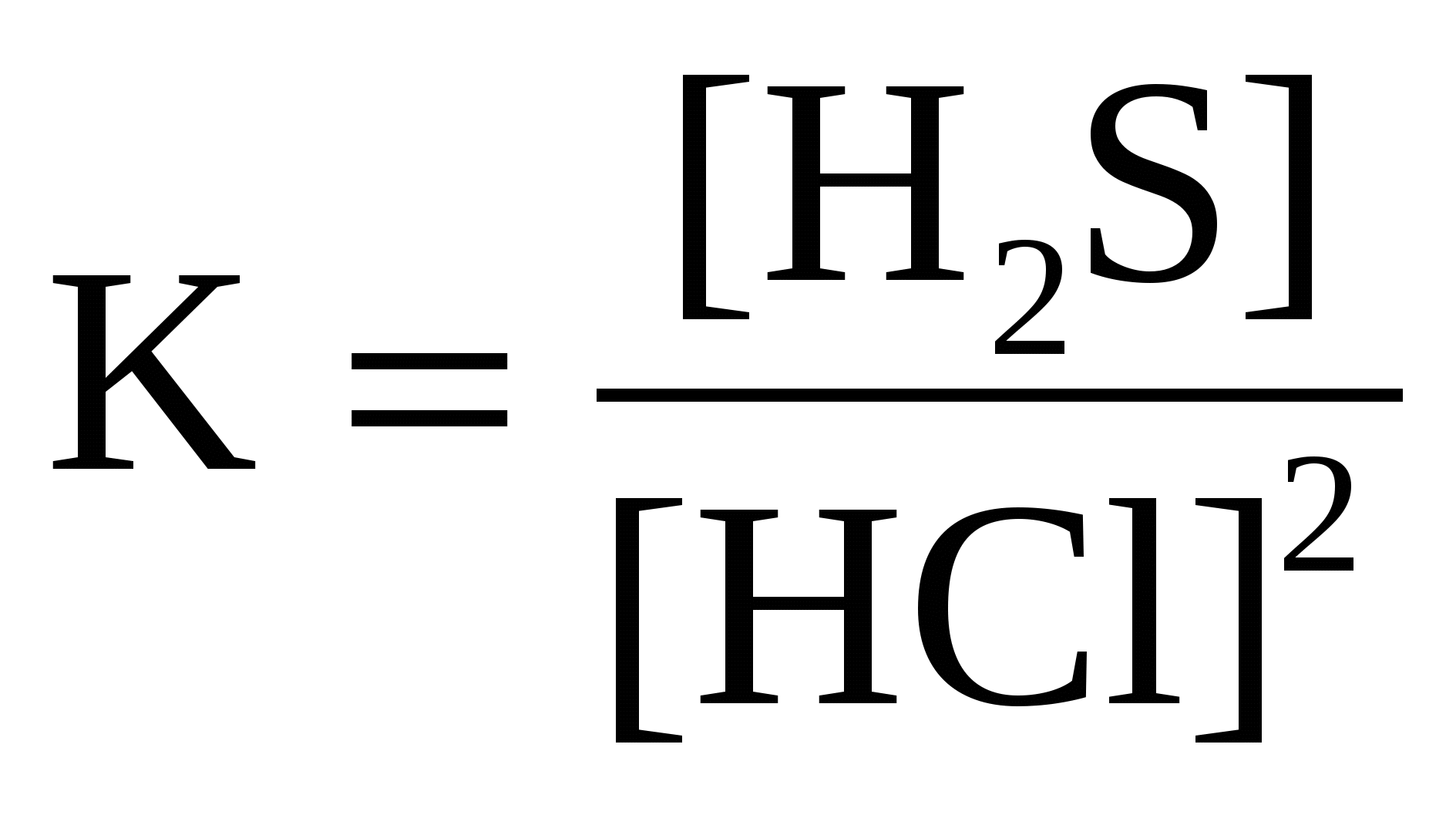 г) г) 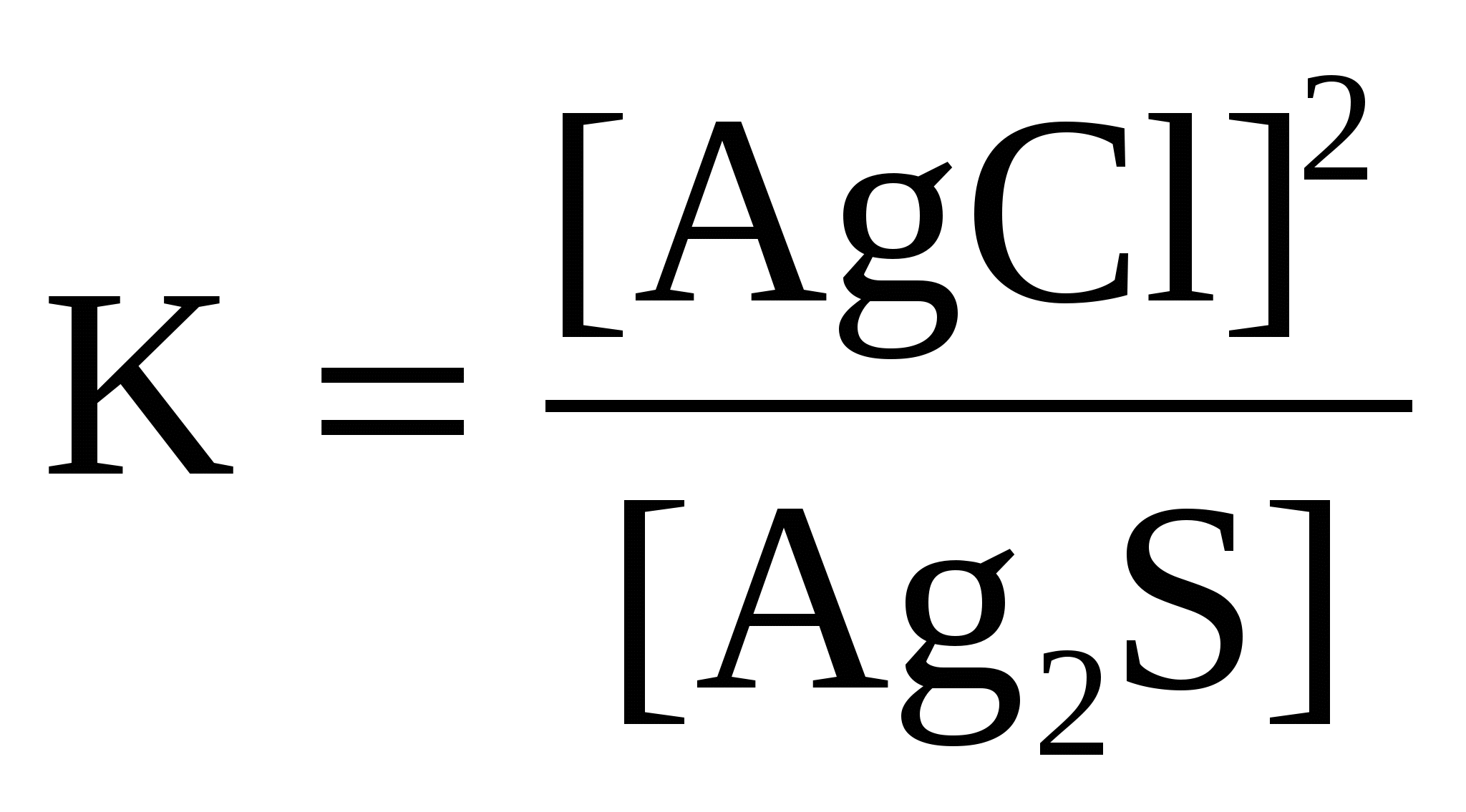
Константа равновесия N2O4 ↔ 2NO2 при 25°С равна 10-1 моль/л. При следующих концентрациях веществ (моль/л): С (NO2) = 0,1, С (N2O4) = 0,1 реакция протекает (указать направление):
а) вправо б) влево в) система находится в равновесии
Куда сместится равновесие: Ст+ О2(г)↔СО2(г) при увеличении давления?
а) влево б) вправо в) не сместится г) в сторону угла
Куда сместится равновесие: PCl5(г) ↔PCl3(г)+Cl2(г)при уменьшении температуры, если прямая реакция является эндотермической ?
а) влево б) вправо в) не сместится г) в сторону угла
В. Растворы. Свойства растворов
Какова процентная концентрация раствора, если в 200 г воды растворено 50 г вещества?
ٱ 25% ٱ 50% ٱ 20% ٱ 40%
Сколько воды надо добавить к 200 мл 0,1 м раствором NaCI, чтобы получить 0,01 м раствор?
а) 1000 мл б) 1800 мл в) 2000 мл г) 1500 мл.
Смешали 200 г 20%-ного и 300г 10%-ного растворов глюкозы. Концентрация полученного раствора будет:
а) 15% б) 18% в) 16%г) 14%.
Масса навески натрия гидроксида, необходимая для приготовления 230 мл раствора с концентрацией 0,6 моль/л равна:
а) 5,52 г б) 55,2 г в) 0,552 г г) 552 г
Объем 0,1 н раствора КОН, необходимый для нейтрализации 20 мл 0,15 н раствора НCl, равен, мл:
а) 20 б) 15 в) 45 г) 30.
При растворении 11,6 г вещества в 400 г воды температура кристаллизации раствора стала составлять 0,93°C. Молярная масса вещества равна, г/моль: а) 93 б) 58 в) 180 г) 342.
ЧЕМУ РАВЕН изотонический коэффициент для раствора электролита с концентрацией растворенного вещества 0,2М, если известно, что в 1 дм3 этого раствора содержится 2,18·1023частиц (молекул и ионов) растворенного вещества: а) 1,81 б) 0,55 в) 0,35 г) 2,39.
10% водный раствор какого вещества кипит при более высокой температуре
ٱС12Н22О11 (М = 342 г/моль) ٱ С6Н12О6 (М = 180 г/моль)
С3Н8О2 (М = 76 г/моль) ٱ С2Н5ОН (М = 46 г/моль)
Какой из растворов закипит при более высокой температуре?
а) глюкоза б )Na2SO4 в ) СН3СООNa г ) К3PO4
Какой из растворов замерзает при более низкой температуре, если молярные концентрации равны?
а) KI б) CuCI2 в) NaCI г) С12Н22О11
Необходимые условия осмоса:
а) разница концентрацииб) разница концентраций и наличие полупроницаемой мембраныв) наличие полупроницаемой мембраныг) броуновское движение
Какой раствор изотоничен крови?
а ) имеющий равные концентрации ионов К+ и Na+
б) имеющий равные значения рН
г) с рН=7,0 и рСО2=35 мм. рт.ст.
Осмотическое давление 0,1 м раствора К2СО3 равно 2,63 атм. При 00С. Рассчитать «i «.
а) 1,17 б) 2 в) 2,2 г) 1,5
В каком из растворов осмотическое давление будет минимальным при t=200C.
а )1м С6Н12О6 б) 1м NaCI в) 1м СН3СООNa г) 1м K3PO4
Осмотическое давление в растворе глюкозы рассчитывается по формуле:
а) СэRT б) СмRT в) С% RT г) PV=CRT
В каких случаях оба иона не могут находиться вместе в растворе в значительных количествах?
а) Cu2+, Cl- б) Mg2+, PO43- в) Na+, OH- г)K+, S2-
К растворам указанных солей прилили раствор кислоты. В каких случаях наблюдается выделение газа?
а ) Na2SO4 б ) CuSO4 в ) Na2S г ) HgS
Указать уравнение реакции, практически осуществимой в растворе:
а) Ва(NО3)2+ NaOH→
б) Fe2(SO4)3 + НNO3→
в) Na NO3+ НCl →
г) CuSO4+ NaOH →
Раствор, в 500 мл которого растворено 1,825 г НCl, имеет рН, равный:
а) 1 б) 4 в) 7 г) 13
рН раствора =6, [ОН-]=?
а) 10-6 б ) 10-8 в ) 10 -4 г ) 10-14
рН 1 М С6Н12О6=?
а ) 0 б ) 5,0 в ) 14 г ) 7
Вычислите рН 0,0005 М раствора H2SO4
а ) 3,3 б ) -3,3 в ) 3 г) 4,3
Щелочным является раствор, у которого:
ٱ pH = 7 ٱ [H+] = 10-9 моль/л ٱ [OH-] = 10-9 моль/л ٱ pOH = 10
pH=12, [H+]=?
а) 10-7 моль/л б ) 10-12 моль/л в ) 10-2 моль/л г) 10-6 моль/л
Чему равно ионное произведение воды в 0,9% растворе NaCI?
а)9 б) 10-7 в) 10-14 г) 9·10-1
Чему равно ионное произведение воды в 0,1 м растворе NaOH?
а ) 10-1 б) 10-13 в) 10-14 г) 10-7
Какая из указанных солей дает щелочную реакцию среды за счет гидролиза:
а ) Na2CO3 б) AlCl3 в) (NH4)2SO4 г)KNO3
Какая из солей подвергается гидролизу?
а )AlCl3 б) Na2SO4 в) KNO3 г) NaCl
Какие вещества нужно добавить к раствору AI2(SO4)3 для
смещения равновесия реакции гидролиза вправо?
a ) Na2SO4 ,б ) NaCI в ) HNO3 г ) Н2О
Добавление какого вещества сдвигает равновесие реакции
гидролиза SnCI2 влево?
а ) SnSO4 б ) K2SO4 в ) H2SO4 г ) Н2О
В какой смеси веществ возможна химическая реакция?
а ) Bi(OH)3 + NaOH ↔ б ) Bi(OH)3 + HCI
в ) Bi2S3 + H2O↔ г ) Bi2S3 + HCI ↔разб.
Указать продукты гидролиза К2СО3 по 1-ой ступени:
а ) КОН б ) КОН в ) КОН г ) не гидролизуется
КНСО3 Н2СО3 КНСО3 рН=7
рН>7 pH>7 pH <7
Продукты гидролиза по 1-ой ступени дихлорида цинка (ZnCI2)
a) ZnOHCI б) ZnOHCI в) Zn(OH)2 г) ZnOHCI
HCI HCI HCI HCI
pH<7 pH>7 pH<7 pH=7
ПРAgCI=1,8·10-13, ПРAgBr=0,5·10-13; ПРАgI=8·10-17, как изменяется растворимость веществ AgCI-AgBr-AgI.
а) растет б) не изменяется в) уменьшается г) равна 0.
Наименее растворима в воде соль:
а) BaCO3 б) CaSO4 в) CaC2O4
ПРAgCI=1,21·10-10. Рассчитать молярную растворимость:
а) 1,21·10-10моль/л б) 1,1·10-5моль/л в ) 2·10-5 моль/л
г) 1,2·10-3 моль/л
ПРCuS=9·10-36. Рассчитать молярную растворимость CuS.
2·10-18моль/л б) 3·10-16моль/л в) 9·10-36моль/л г) 6·10-18 моль/л
Растворимость BaCO3 равна 1,7·10-3 моль/л, рассчитать ПР BaCO3.
а)2,89·10-6 б) 1,7·10-3 в) 1,89·10-5 г) 28,9·10-7
ПР (BaSO4) =1·10-10, ПР (CaSO4) =6·10-5 ПР (PbSO4) =1, 8·10-8
Какой осадок при равных условиях образуется первым?
а) CaSO4 б) BaSO4 в) одновременно г) не образуется |
|
|
 Скачать 423 Kb.
Скачать 423 Kb.

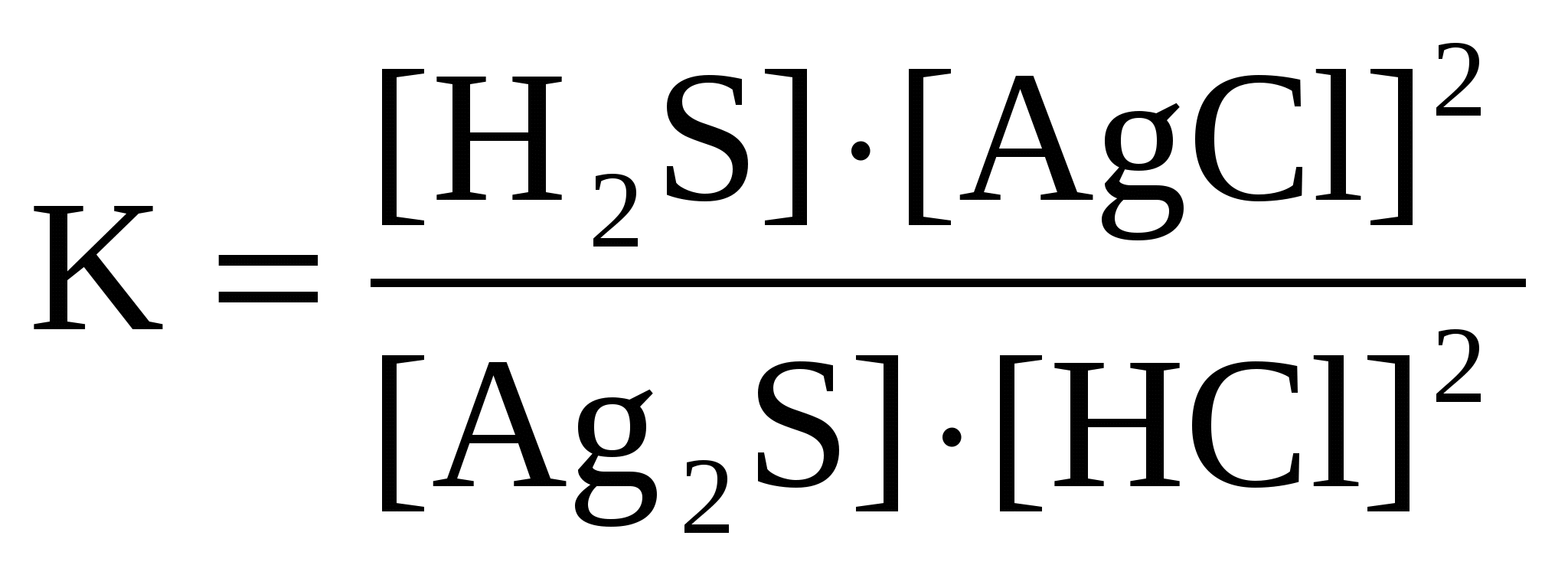 в)
в)