Тип урока Урок изучения нового материала. Дидактические и материальные оснащения ноутбук, таблица Гомологический ряд предельных углеводородов и их алкильных радикалов
 Скачать 133.26 Kb. Скачать 133.26 Kb.
|
|
Урок 4: Строение алканов. Гомологический ряд. Номенклатура и изомерия Цель: Ознакомить учащихся с составом и номенклатурой углеводородов ряда метана. Тип урока: Урок изучения нового материала. Дидактические и материальные оснащения: ноутбук, таблица «Гомологический ряд предельных углеводородов и их алкильных радикалов». ХОД УРОКА I. Организационный момент. II. Формирование новых знаний, умений и навыков. Предельными называются углеводороды, в молекулах которых все атомы углерода соединены между собой одинарной связью и полностью насыщены атомами водорода. Общее название предельных углеводородов по международной номенклатуре – алканы. Простейшими органическими соединениями являются углеводороды, состоящие из углерода и водорода. В зависимости от характера химических связей в углеводородах и соотношения между углеродом и водородом они подразделяются на предельные и непредельные (алкены, алкины и др.) Предельными углеводородами (алканами, углеводородами метанового ряда) называются соединения углерода с водородом, в молекулах которых каждый атом углерода затрачивает на соединение с любым другим соседним атомом не более одной валентности, причем, все не затраченные на соединение с углеродом валентности насыщены водородом. Все атомы углерода в алканах находятся в sp3 - состоянии. Предельные углеводороды образуют гомологический ряд, характеризующийся общей формулой СnН2n+2. Родоначальником этого ряда является метан. Изомерия. Номенклатура. Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами. Алканы с n=1,2,3 могут существовать только в виде одного изомера: 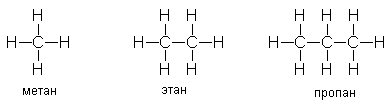 Начиная с n=4, появляется явление структурной изомерии. 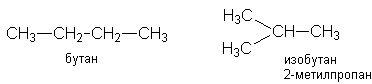 Число структурных изомеров алканов быстро растет с увеличением числа углеродных атомов, например, пентан имеет 3 изомера, гептан - 9 и т.д. Число изомеров алканов увеличивается и за счет возможных стереоизомеров. Начиная с C7Н16 возможно существование хиральных молекул, которые образуют два энантиомера. Номенклатура алканов. Доминирующей номенклатурой является номенклатура IUPAC. В тоже время в ней присутствуют элементы тривиальных названий. Так, первые четыре члена гомологического ряда алканов имеют тривиальные названия. СН4 - метан С2Н6 - этан С3Н8 - пропан С4Н10 - бутан. Названия остальных гомологов образованы от греческих латинских числительных. Так, для следующих членов ряда нормального (неразветвленного) строения используются названия: С5Н12 - пентан, С6Н14 - гексан, С7Н18 - гептан, С8Н18 - октан, С9Н20 - нонан, С10Н22 - декан, С11Н24 - ундекан, С12Н26 - додекан, С13Н28 - тридекан, С14Н30 - тетрадекан, С15Н32 - пентадекан и т.д. Основные правила IUPAC для разветвленных алканов: а) выбирают наиболее длинную неразветвленную цепь, название которой составляет основу (корень). К этой основе прибавляют суффикс “ан” б) нумеруют эту цепь по принципу наименьших локантов, в) заместитель указывают в виде префиксов в алфавитном порядке с указанием места нахождения. Если при родоначальной структуре находятся несколько одинаковых заместителей, то их количество указывают греческими числительными. В зависимости от числа других углеродных атомов, с которыми непосредственно связан рассматриваемый углеродный атом, различают: первичные, вторичные, третичные и четвертичные углеродные атомы. 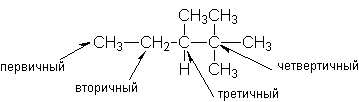 Пример: 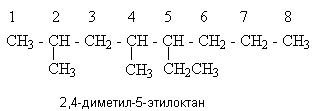 В качестве заместителей в разветвленных алканах фигурируют алкильные группы или алкильные радикалы, которые рассматриваются как результат отщепления от молекулы алкана одного водородного атома. Название алкильных групп образуют от названия соответствующих алканов путем замены последних суффикса “ан” на суффикс “ил”. СН3 - метил СН3СН2 - этил СН3СН2СН2 - пропил 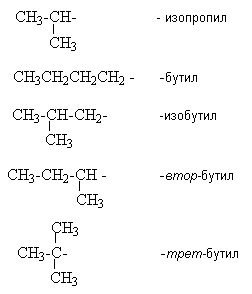 Для названия разветвленных алкильных групп используют также нумерацию цепи: 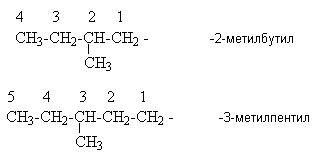 Начиная с этана, алканы способны образовывать конформеры, которым соответствует заторможенная конформация. Возможность перехода одной заторможенной конформации в другую через заслоненную определяется барьером вращения. Определение структуры, состава конформеров и барьеров вращения являются задачами конформационного анализа. 2. Химические свойства алканов (метана, этана): горение, замещение, разложение, дегидрирование. Все связи в алканах малополярные, по этому для них характерны радикальные реакции. Отсутствие пи-связей делает невозможными реакции присоединения. Для алканов характерны реакции замещения, отщепления, горения. 1. Реакции замещения А) с галогенами (с хлором Cl2 –на свету, Br2- при нагревании) реакция подчиняется правилу Марковника (Правила Марковникова) — в первую очередь галоген замещает водород у наименее гидрированного атома углерода. Реакция проходит поэтапно — за один этап замещается не более одного атома водорода. Труднее всего реагирует Йод, и притом реакция не идет до конца, так как, например, при взаимодействии метана с йодом образуется йодистый водород, реагирующий с йодистым метилом с образованием метана и йода(обратимая реакция): CH4 + Cl2 → CH3Cl + HCl (хлорметан) CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан) CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан) CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан) Б) Нитрование(Реакция Коновалова) Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова. Один из атомов водорода заменяется на остаток NO2 (нитрогруппа) и выделяется вода 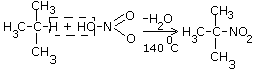 2. Реакции отщепления А) дегидрирование –отщепление водорода. Условия реакции катализатор –платина и температура. CH3- CH3→ CH2= CH2 + Н2 Б) крекинг процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью. При температуре 450–700 oС алканы распадаются за счет разрыва связей С–С (более прочные связи С–Нпри такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов C6H14 В) полное термическое разложение СН4 3. Реакции окисления А) реакция горения. При поджигании (t = 600oС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды. СnН2n+2 + O2 ––>CO2 + H2O + Q СН4 + 2O2 ––>CO2 + 2H2O + Q Б) Каталитическое окисление - при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–Спримерно в середине молекулы и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. Например, при неполном окислении бутана (разрыв связи С2–С3) получают уксусную кислоту 4. Реакции изомеризации характерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов. С4Н10 5. Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации, но всегда образуют 6-членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). 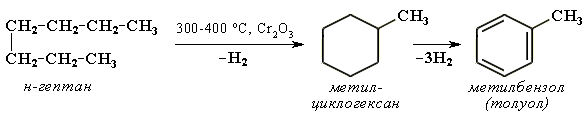 Для закрепления материала ответить на вопросы в конце параграфа, а также выполнить задания по задачнику Домашнее задание: §7-8, упр.4-5 стр.33-34. Задача №6,8. РЕШЕНИЕ: Задача 6  Задача 8  |
