2.1. Основы материаловедения. Учебнометодический комплекс тема Основы материаловедения Материаловедение
 Скачать 1.6 Mb. Скачать 1.6 Mb.
|
 ЭЛЕКТРОННЫЙ УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКС Тема 2.1. Основы материаловедения Материаловедение – наука о материалах, их строении и свойствах. Использование материалов всегда зависело от прочности, надёжности и долговечности выполненных из них деталей. Конструирование, изготовление, эксплуатация и ремонт машин и приборов связаны с машиностроительными материалами и их использованием. В связи с этим необходимо иметь представление: −о закономерностях формирования структуры материалов; −связях структуры и состава материалов с их эксплуатационными характеристиками; −требованиях, предъявляемых к материалам на всех этапах жизненного цикла продукции; −возможностях вторичного использования материалов. Вопросы строения и свойств металлов, сплавов, неметалличе- ских материалов, горюче-смазочных материалов и эксплуатационных жидкостей, применяемых в конструкциях и необходимых для их эксплуатации и ремонта, рассматривает материаловедение. Материалы– это исходные вещества для производства продукции и вспомогательные вещества для проведения производственных процессов. Различают следующие разновидности материалов: −сырьё, или сырые материалы, которые подлежат дальнейшей переработке (железная руда на металлургическом заводе, нефть на нефтеперерабатывающем комбинате); −полуфабрикат – переработанный материал, который должен пройти одну или несколько стадий обработки, для того чтобы стать изделием, годным к потреблению. Готовая продукция одного производства может служить полуфабрикатом для другого. Для успешного решения многих практических задач необходимы сведения о современных способах получения и обработки материалов, их свойствах и рациональном применении. Атомно-кристаллическое строение вещества  Рисунок 1. Атомно-кристаллическое строение Методы исследования металлов Металлы всегда занимали особое место в жизни человека, это заметно даже в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества в археологических находках металлических изделий (кованые, медные украшения, сельскохозяйственные орудия) и в повседневном использовании металлов и сплавов в современной технике. Металлы и их сплавы – являются важнейшими конструкционными материалами, широко применяющимися в машиностроении. Они обладают многими ценными свойствами, обусловленными в основном их внyтpeнним строением, которые отличают их от других материалов и делают во многих случаях незаменимыми. Мягкий и пластичный металл или сплав можно сделать твёрдым, хрупким, и наоборот. Для того чтобы сознательно изменять свойства металлов, необходимо знать основы их кристаллического строения. Как известно, все тела состоят из большого количества атомов, которые удерживаются силами сцепления, совершая колебания большой частоты возле точек равновесия. Поскольку атомы разных металлов различны, каждый металл имеет свои определённые свойства. Эти свойства зависят от расположения атомов между собой, характера их связей, от расстояния между ними. Если изменить расстояние между атомами или порядок их расположения, изменятся и свойства металла. Аморфные и кристаллические тела.  Таблица 1. Сравнительная характеристика кристаллов и аморфных тел Строение металлов и их свойства  Рисунок 2. Строение металлов Все существующие в природе твёрдые неорганические тела по своим свойствам делятся на два класса: кристаллические и аморфные. Кристаллические тела остаются твёрдыми, т.е. сохраняют свою форму, до вполне определённой температуры, при которой они переходят в жидкое состояние. При охлаждении процесс идёт в обратном направлении. При этом температура плавления остаётся постоянной, а процесс плавления или кристаллизации происходит в течение некоторого времени при постоянном значении температуры, о чём свидетельствует горизонтальный участок представленных графиков.  Рисунок 3. Температурные кривые кристаллического и аморфного вещества  Рисунок 4. Расположение атомов в кристаллическом (а) и аморфном (б) веществе Аморфныминазывают материалы, в которых расположение образующих их элементарных частиц (атомов или молекул) – хаотично, т.е. неупорядоченно. При нагреве аморфные тела размягчаются в большом температурном интервале; сначала они становятся вязкими и лишь затем переходят в жидкое состояние. К числу таких материалов относятся пластмассы, стекло, керамики, резины. В аморфных телах – смоле, стекле, канифоли и т.п. – атомы расположены беспорядочно. В металлах они находятся в определённом геометрическом порядке, образуя кристаллы, поэтому металлы являются кристаллическими телами. Металлы различаются не только порядком расположения атомов, но и кристаллической решёткой, которая представляет собой воображаемую пространственную сетку, состоящую из элементарных ячеек, в узлах которой находятся атомы. Макроструктура– строение, выявляемое невооружённым глазом или при небольших увеличениях с помощью лупы, при этом выявляются крупные дефекты: трещины, усадочные раковины, газовые пузыри и т.д., а также неравномерность распределения примесей в металле. Макроструктуру можно исследовать по излому и на специальных макрошлифах. Изучение излома – наиболее простой метод выявления кристаллического строения металлов. По излому можно судить о размере зерна, особенностях выплавки и литья, термической обработки, а следовательно, и о некоторых свойствах металла. Вид излома используют в качестве критерия при определении склонности стали к хрупкому разрушению. Исследование макроструктуры, несмотря на простоту, является очень ценным методом изучения материалов. Макрошлиф – это образец металла или сплава, одна из сторон которого отшлифована, тщательно обезжирена, протравлена растворами, содержащими щёлочи или кислоты, и рассматривается с помощью лупы. Научная цель макроанализа – установление закономерности влияния факторов на формирование макроструктуры. Макроанализ позволяет выявить форму, размеры и расположение зёрен в разных частях изделия, обнаружить макродефекты металла (раковины, пористость, газовые включения, расслоения). Микроанализвыявляет структуру металла или сплава по микрошлифам, приготовленным так же, как и для макроанализа, но дополнительно отполированным до зеркального блеска. Шлифы рассматриваются в отражённом свете под оптическим микроскопом. Из-за различной ориентировки зёрен металла они травятся не в одинаковой степени и под микроскопом свет также отражается неодинаково. Границы зёрен, благодаря примесям, травятся сильнее, чем основной металл, и выявляются более рельефно. В сплаве структурные составляющие травятся также различно. Этот важнейший анализ определяет размеры и форму зёрен, структурные составляющие, неметаллические включения и их характер – трещины, пористость и т.д., качество термической обработки. Зная микроструктуру, можно объяснить причины изменения свойств металла, она характеризует мелкие структурные составляющие, наблюдение которых возможно с помощью оптических микроскопов с увеличением от 60 до 1500–2000 раз.  Рисунок 5. Микроанализ металлов Микроанализ позволяет установить размеры и форму кристаллов, их распределение, форму инородных включений и микропустот, ориентацию кристаллов и т.п. Тонкая структура – позволяет определить расположение элементарных частиц в материале и электронов в атоме. Строение и свойства вещества на этом уровне определяются типом связей между элементарными частицами. Различают три основных типа связи: ионный, ковалентный и металлический. Образование ионной связи происходит путём передачи атомом одного элемента валентного электрона атому другого элемента. Это приводит к образованию положительного и отрицательного ионов, которые притягиваются друг к другу электростатически. Образование ионной связи удобно рассмотреть на примере соединения NaCl. Атом Na имеет один «лишний» валентный электрон. В то же время атому Cl, имеющему семь валентных электронов, для образования устойчивой оболочки, «не хватает одного электрона. Атом Na передаёт свой валентный электрон атому Cl, в результате образуется положительный ион Na + и отрицательный ион Cl, которые, притягиваясь, создают ионную связь. Ионные кристаллы обычно хрупкие, довольно тугоплавкие, у них низкая тепло- и электропроводность. Ковалентный тип связи осуществляется обобществлением (объединением) валентных электронов соседних атомов. Типичным телом с такой связью является – алмаз, состоящий из атомов углерода с четырьмя валентными электронами. При довольно высокой механической прочности связи все ковалентные кристаллы хрупкие, температура плавления, тепловые и электрические свойства колеблются у них в широком диапазоне. Металлическаясвязь образуется следующим образом. На внешних оболочках атомов металлов находится меньше четырёх валентных электронов, слабо связанных с атомным ядром. Поэтому при близком расположении атомов валентные электроны легко теряют связь с отдельными атомами и становятся общими, т.е. коллективизируются. При этом атомы превращаются в положительно заряженные ионы, а освободившиеся электроны свободно перемещаются между периодически расположенными ионами, не принадлежа (в отличие от ковалентной связи) ни отдельному атому, ни какой-либо их малой группе. Металлическая связь является ненаправленной, благодаря чему при пластической деформации, связь между ионами не нарушается и разрушение не происходит. Ионы как бы плавают в облаке электронного газа, образованного свободно перемещающимися электронами, что обусловливает высокую пластичность металлов. Наличие электронного газа объясняет также высокую электро- и теплопроводность элементов с металлической связью.  Рисунок 6. Металлическая связь Металлы– вещества, обладающие высокой тепло- и электропроводностью, ковкостью (пластичностью), блеском и другими свойствами, обусловленными наличием в них большого числа свободно перемещающихся электронов. Каждый металл отличается строением и свойствами, тем не менее, по некоторым признакам их можно объединять в группы. Прежде всего, металлы по цвету можно разделить на чёрные и цветные. Чёрные металлыимеют тёмно-серый цвет, большую плотность (кроме щелочноземельных), высокую температуру плавления, относительно высокую твёрдость и во многих случаях обладают полиморфизмом (способностью менять кристаллическое строение). Цветные металлычаще всего имеют характерную окраску: красную, жёлтую, белую. Обладают большой пластичностью, малой твёрдостью, относительно низкой температурой плавления, для них характерно отсутствие полиморфизма. Твёрдые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определённых точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решёткой. 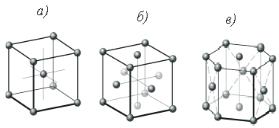 Рисунок 7. Кристаллическая решетка Различают следующие кристаллические решётки металлов с плотной упаковкой атомов: кубическую объёмно-центрированную, кубическую гранецентрированную и гексагональную. В ячейке кубической объёмно-центрированной решётки атомы расположены в вершинах и центре куба. Такая ячейка содержит девять атомов (хром, вольфрам, ванадий, молибден, литий, а при определённых температурах – железо и другие металлы). Типы кристаллических решёток. Вещество может находиться в трёх состояниях: газообразном, жидком и твёрдом, и при определённых условиях (давлении р, температуре Т) переходить из одного состояния в другое. Подавляющее большинство металлов имеет объёмно-центрированные решётки, гранецентрированные кубические решётки, либо гексагональные плотноупакованные. Краткие обозначения этих типов решёток – ОЦК, ГПУ и ГЦК соответственно. Кристаллические решётки характеризуются: 1) симметрией; 2) параметрами или периодами решётки; 3) координационными числами; 4) базисом решётки. Строение реальных металлов отличается от идеальных. В реальных кристаллах всегда содержатся дефекты, которые подразделяются по геометрическим признакам на точечные, линейные и поверхностные. Локальные несовершенства (дефекты) в строении кристаллов присущи всем металлам. Эти нарушения идеальной структуры твёрдых тел оказывают существенное влияние на их физические, химические, технологические и эксплуатационные свойства. Без использования представлений о дефектах реальных кристаллов невозможно изучить явления пластической деформации, упрочнение и разрушение сплавов и др. Наиболее дефектные участки в структуре – границы зёрен, т.е. места стыка зёрен. По границе, помимо примесей, концентрируются и дефекты кристаллической решётки: вакансии и дислокации.Дефекты кристаллического строения удобно классифицировать по их геометрической форме и размерам. Точечнымидефектами называются такие нарушения периодичности кристаллической решётки, размеры которых во всех трёх измерениях сопоставимы с размерами атома. К ним относят вакансии, межузельные атомы основного вещества, чужеродные атомы внедрения Линейнымидефектами называют такие нарушения в кристаллической решётке, которые имеют малые размеры в двух измерениях и большую протяжённость в третьем. Этот вид дефектов называется дислокациями(в пер. с англ. dislocation – смещение, сдвиг). Краевая дислокация образована краем «экстраплоскости» (лишней полуплоскости). Винтовая дислокация, как и краевая, представляет собой результат как бы сдвижения части одного участка в кристалле относительно другого. Она соответствует оси спиральной структуры в кристалле, характеризуемом искажением, которое присоединяется к нормальным параллельным плоскостям, вместе формирующим непрерывную винтовую наклонную плоскость (с одним периодом), вращающуюся относительно дислокации. Поверхностныедефекты малы только в одном направлении и имеют плоскую форму – это границы зёрен. Объёмныеимеют во всех трёх измерениях относительно большие размеры – это поры, трещины. Структурные несовершенства (дефекты) в кристаллах возникают в результате кристаллизации металла, термической обработки, пластической деформации и оказывают существенное влияние на упрочнение и разрушение металла при обработке. В кристаллической решётке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Чистые металлы получить технически очень трудно и по этой причине в металле присутствуют примеси различного происхождения. В зависимости от природы примесей и условий попадания их в металл они могут быть растворены в металле или находиться в виде отдельных включений. Если атомы примесей значительно меньше атомов основного металла, то они образуют растворы внедрения, а если больше – то образуют растворы замещения. В том и другом случаях решётка становится дефектной и искажения её влияют на свойства металла. Наличие дислокаций и несовершенство кристаллов, с одной стороны, оказывают ослабляющий эффект на металл, а при определённых условиях дефекты могут упрочнять металл. Поверхностные дефекты наблюдаются прежде всего на границах зёрен. Наклёп и рекристаллизация  Рисунок 8. Наклеп и рекристаллизация При пластической деформации изменяется не только форма и размеры металла, но также его внутреннее строение и механические свойства. Зёрна разворачиваются, деформируются и сплющиваются, вытягиваясь в направлении деформации. Образуется волокнистая структура. При этом прочность и твёрдость металла повышаются, а пластичность и вязкость снижаются. Явление упрочнения металла при пластической деформации называется наклёпом. Волокнистое строение и наклёп могут быть устранены при нагреве металла. Частичное снятие наклёпа происходит уже при небольшом нагреве (до 300…400 °С для железа). Но волокнистая структура при этом сохраняется. При нагреве до более высокой температуры в металле происходит образование новых равноосных зёрен. Этот процесс называется рекристаллизацией. Наклёп при этом снимается полностью. Если деформирование металла происходит при температуре, которая выше температуры рекристаллизации, то наклёп после деформации не возникает. Такая деформация называется горячей. При горячей деформации идут одновременно процессы упрочнения и рекристаллизации. Деформация, которая происходит ниже температуры рекристаллизации, называется холодной. |
