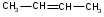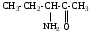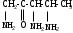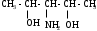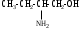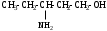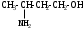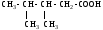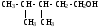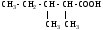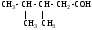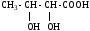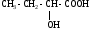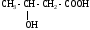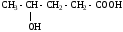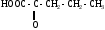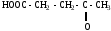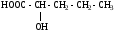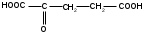Методичка. Методичка по биоорганической химии 2 семестр СТОМ 20-21 (1). Учебнометодическое пособие для подготовки и проведения лабораторнопрактических занятий для студентов, обучающихся по специальности Стоматология (31. 05. 03)
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
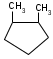
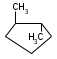
ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙВещества, имеющие одинаковый состав молекул (одну и ту же молекулярную формулу), но различное химическое строение и обладающие, поэтому разными свойствами называются изомерами, а явление называется изомерией. В и д ы и з о м е р и и1. Изомерия углеродного скелета (для многих классов органических соединений) Примеры: С5Н12
С5Н11 – ОН
С5Н10
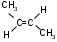
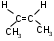
2. Положение кратких связей (для алкенов, алкинов и диеновых)
3. Положение функциональной группы
4. Межклассовая изомерия C4Н6
С2Н6О
С 4Н8О2
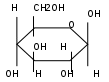
С6Н12О6
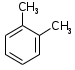
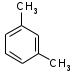
5. Изомерия взаимного положения заместителей (ароматические углеводороды)
Т а у т о м е р и я (существование одного вещества в разных формах).
цикло - оксо – таутомерия Геометрическая изомерия (пространственная)
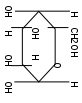
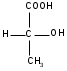
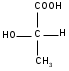
С т е р е о и з о м е р и я связана с различиями в пространственном расположении атомов в молекулах веществ, имеющих одинаковый состав и строение
Контрольные вопросы по теме Как классифицируют органические соединения? Дайте определение понятию функциональная группа. Приведите примеры представителей различных классов органических соединений. Какие правила номенклатуры органических веществ: международной, тривиальной? Что называют структурной изомерией? Опишите химическое строение, классификацию структурных изомеров. Какие типы химических связей существуют в органических соединениях? Какие виды гибридизации атома углерода существуют? Что такое ковалентные σ-связи и π-связи ? Задания для самостоятельного решения Используя заместительную номенклатуру ИЮПАК, выберите название, которое соответствует соединению 
2.Используя заместительную номенклатуру ИЮПАК, выберите структурную формулу, которая соответствует соединению З-аминопентанон-2
Используя заместительную номенклатуру ИЮПАК, выберите название, которое соответствует соединению 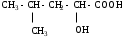
Используя заместительную номенклатуру ИЮПАК, выберите название, которое соответствует соединению H2N – CH2 – CH2 – OH
Используя заместительную номенклатуру ИЮПАК, выберите название, которое соответствует соединению 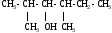
Используя заместительную номенклатуру ИЮПАК, выберите название, которое соответствует соединению 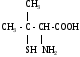
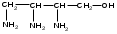
Используя заместительную номенклатуру ИЮПАК, выберите структурную формулу, которая соответствует соединению 3-аминобутанол-1
8. Используя заместительную номенклатуру ИЮПАК, выберите структурную формулу, которая соответствует соединению 3,4-диметилпентаналь
9. Используя заместительную номенклатуру ИЮПАК, выберите структурную формулу, которая соответствует соединению 2-гидроксибутановая кислота
10. Используя заместительную номенклатуру ИЮПАК, выберите структурную формулу, которая соответствует соединению 2-оксопентандиовая кислота
ТЕМА Взаимное влияние атомов в молекулах органических соединений и способы его передачи. Сопряжение. Ароматичность План занятия 1. Устный опрос и коррекция знаний 2. Подведение итогов занятия УЧЕБНЫЕ ЭЛЕМЕНТЫ ТЕМЫ В органических молекулах двойная связь, являющаяся сочетанием одной σ и π связей, может располагаться локализовано между двумя углеродными атомами, а также между атомом углерода и гетероатомом /О, N, S/. Так как электронная плотность π-связи охватывает только два ядра связываемых атомов, связь называется локализованной, двухцентровой. Такие связи часто встречаются в природных соединениях, например, в ненасыщенных высших карбоновых кислотах. Однако, особо большое значение в биологических процессах имеют сопряженные системы – соединения с чередующими двойными и одинарными связями. Образование сопряженной многоцентровой системы сопровождается: частичным выравниванием длин связей (нет «чистых» одинарных и «чистых» двойных); обобществлением p-электронов и делокализацией электронного облака. При этом происходит выделение энергии: система переходит на более низкий энергетический уровень, становясь более устойчивой и стабильной. Мерой термодинамической устойчивости такой системы является энергия сопряжения, которая, выражается разностью полной π-электронной энергии несопряженной системы (с локализованными связями) и π-электронной энергии всей сопряженной системы. Чем длиннее цеп сопряжения, тем больше выигрыш энергии при её образовании. Различают сопряженные системы с открытой и замкнутой цепью; с π,π или p,π сопряжением; с углеродной цепью или цепью, содержащей гетероатом. Сопряженные системы с замкнутой цепью. Ароматичность Для систем с замкнутой цепью наибольший интерес представляют соединения, обладающие ароматичностью, то есть совокупностью признаков, обуславливающих их повышенную термодинамическую устойчивость по сравнению с открытыми сопряженными системами. Критерии ароматичности (Хюкель 1931) - система обладает ароматичностью, если: молекула имеет циклическое строение и содержит чередующиеся двойные и одинарные связи; все атомы углерода находятся в состоянии sp2-гибридизации,они лежат в одной плоскости, образуя плоский σ–скелет молекулы; все pZ-орбитали перпендикулярны σ–скелету и параллельны друг другу, что обуславливает их взаимное перекрывание; образуется делокализованная π–электронная система с числом /4n+2/ π-электронов; n=1,2… (n-число циклов). Контрольные вопросы по теме Что называют взаимным влиянием атомов в молекулах органических соединений и каковы способы его передачи? Что называют сопряжением (π, π- и р, π-сопряжение) и энергией сопряжения? Что называют сопряженными системами с открытой (бутадиен-1,3;дивиниловый эфир; пропеновый альдегид) и замкнутой цепью (бензол, пиррол, фуран, тиофен, пиридин)? Какие соединения называют ароматическими (перечислите критерии Хюккеля)? Какие эффекты влияния заместителя существуют? Что такое индуктивный эффект? Что такое мезомерный эффект? Что такое электронодонорные и электроноакцепторные заместители? Задания для самостоятельного решения Укажите вид и знак электронных эффектов карбоксильной группы в бензойной кислоте. Обозначьте эффекты графически. Электронодонорным или электроноакцепторным является названный заместитель?  Укажите вид и знак электронных эффектов ОН-группы в феноле. Обозначьте эффекты графически. Электронодонорным или электроноакцепторным является указанный заместитель?  Укажите вид и знак электронных эффектов альдегидной группы в акролеине: О   H2C=CH-C Н Обозначьте эффекты графически. Электронодонорным или электроноакцепторным заместителем является альдегидная группа? Укажите вид и знак электронных эффектов атома хлора в хлорбензоле: 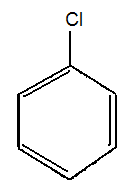 Обозначьте эффекты графически. Электронодонорным или электроноакцепторным является названный заместитель? Укажите вид и знак электронных эффектов нитрогруппы в нитробензоле.  Обозначьте эффекты графически. Электронодонорным или электроноакцепторным является данный заместитель?  Укажите вид и знак электронных эффектов атома хлора в хлористом виниле: CH2=CH-Cl Обозначьте эффекты графически. Электронодонорным или электроноакцепторным является данный заместитель? Укажите вид и знак электронных эффектов аминогруппы в анилине: 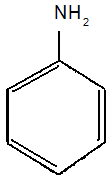 Обозначьте эффекты графически. Электронодонорным или электроноакцепторным является данный заместитель? Укажите вид и знак электронных эффектов карбоксильной группы в акриловой кислоте: CH2=CH-COOH Обозначьте эффекты графически. Электронодонорным или электроноакцепторным является данный заместитель? Укажите вид и знак электронных эффектов альдегидной группы в акролеине: О   H2C=CH-C Н Обозначьте эффекты графически. Электронодонорным или электроноакцепторным заместителем является альдегидная группа? ТЕМА Реакционная способность углеводородов Классификация органических реакций. Реакции электрофильного присоединения. Реакции электрофильного замещения План занятия 1. Устный опрос и коррекция знаний 2. Лабораторная работа № 1 3. Подведение итогов занятия УЧЕБНЫЕ ЭЛЕМЕНТЫ ТЕМЫ Способность вещества вступать в химическую реакцию и реагировать с определенной скоростью называется реакционной способностью. Вещество, которое подвергается воздействию и в котором у атома углерода происходит разрыв старой и образование новой связи, является субстратом. Воздействующее соединение – реагентом. Различают: радикальные реагенты (радикалы) – это электронейтральные частицы (атомы или группы атомов) с не спаренным электроном. электрофильные реагенты – это частицы с не полностью заполненным валентным электронным уровнем. нуклеофильные реагенты – это частицы, имеющие электронную пару на внешнем электронном уровне. I. В соответствии с природой реагента и характером разрыва связи в субстрате различают: а) радикальные, гомолитические реакции, в которых действуют радикальные реагенты и происходит гомолитический разрыв связи в субстрате: 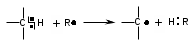 cубстрат реагент б) ионные, гетеролитические реакции, в которых действуют ионные реагенты (нуклеофильные или электрофильные) и происходит гетеролитический разрыв связи в субстрате:  электрофил а) электрофильные (Е): 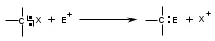 субстрат реагент  нуклеофил б) нуклеофильные (N): 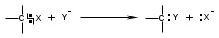 субстрат реагент В таких реакциях промежуточными частицами являются карбокатионы и карбанионы. При этом если электронная пара переходит к атому углерода, то образуется карбанион – отрицательно заряженная частица с избытком электронов. Если же электронная пара переходит к атому Х (функциональная группа), то образуется карбокатион – положительно заряженная частица с недостатком электронов: 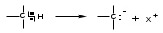 субстрат карбанион  субстрат карбокатион в) синхронные или согласованные реакции, в которых разрыв старых связей и образование новых происходит одновременно и без участия радикальных или ионных (заряженных) частиц. Такие реакции протекают при облучении или нагревании; для них теряют смысл понятия «субстрат» и «реагент»: 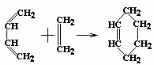 бутадиен-1,3 этилен циклогексен II. По направлению с учетом конечного результата органические реакции делятся на: а) реакции замещения (S): 1. радикального SR 2. ионного: а) электрофильного SE б) нуклеофильного SN б) реакции присоединения (А): 1. радикального AR 2. ионного: а) электрофильного AE б) нуклеофильного AN c) реакции отщепления или элиминирования (Е) д) реакции перегруппировки, при которых происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому. Например, в результате перегруппировки изменяется углеродный скелет молекулы, и пентан превращается в изопентан. е) реакции окисления и восстановления, при которых меняется степень окисления атома углерода, являющегося реакционным центром. III. По числу молекул, участвующих в лимитирующей стадии, т.е. стадии, определяющей скорость всего суммарного процесса, различают: мономолекулярные, бимолекулярные и тримолекулярные реакции. Последние встречаются крайне редко. Для веществ этого класса характерны реакции идущие по следующему механизму: 1. Реакции радикального замещения у насыщенного атома углерода (SR) В насыщенных углеводородах (алканах и циклоалканах) имеются только SP3-гибридизованные атомы углерода. Для них характерны прочные неполярные С−С и почти неполярные С−Н δ-связи. Эти связи не склонны к гетеролитическому разрыву под действием электрофильных или нуклеофильных реагентов. Поэтому для насыщенных углеводородов характерны реакции радикального замещения (SR). Они протекают по свободно-радикальному механизму при участии высокоэнергетических радикалных частиц. Так идет галогенирование насыщенных углеводородов при облучении. Рассмотрим реакцию монохлорирования метана, которая идет по механизму радикального замещения (SR): CH4 + Cl2  CH3Cl + HCl CH3Cl + HClПриведенное уравнение отражает суммарный процесс, который включает несколько стадий: Инициирование – гомолитический разрыв связи в реагенте под действием облучения, образование радикалов: Cl 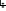 Cl → Cl• + Cl• Cl → Cl• + Cl•Рост цепи – атака радикалом молекулы субстрата; гомолитический разрыв связи С−Н в субстрате; образование новой молекулы и нового радикала: CH3 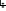 H + •Cl CH3• + HCl H + •Cl CH3• + HClCH3• + Cl 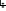 Cl CH3Cl + Cl• и т.д. Cl CH3Cl + Cl• и т.д.На каждой стадии роста цепи образуется продукт реакции и свободный радикал, который атакует новые молекулы, т.е. происходит цепная реакция. Обрыв цепи возможен при взаимодействии двух любых радикалов: Cl• + Cl• = Cl2; CH3• + Cl• = CH3Cl; CH3• + CH3• = C2H6 Галогенирование алканов, содержащих неэквивалентные количества атомов Н, происходит в соответствии с правилом региоселективности:  Предпочтительное протекание реакции по одному из нескольких возможных реакционных центров молекулы, называется региоселективностью. Радикальной атаке подвергаются третичные углеродные атомы, затем вторичные и в последнюю очередь первичные. 2.Реакции, идущие по механизму электрофильного присоединения (AE) Ненасыщенные углеводороды – алкены, циклоалкены, алкины проявляют способность к реакциям присоединения, т.к. содержат двойные и тройные связи. Однако, для многих биохимических процессов более важной является двойная связь – её возникновение и превращения. В связи с этим реакции электрофильного присоединения будут рассмотрены на примере алкенов. Механизм реакции: при сближении реагента с π-связью его молекула поляризуется с образованием активной электрофильной частицы. Эта частица затем атакует π-связь. В результате образуется устойчивый π-комплекс. Далее происходит: гетеролитический разрыв связи в реагенте; присоединение электрофила к молекуле; отщепление нуклеофильной частицы и образование σ-комплеса (карбокатиона). Затем образовавшийся нуклеофил атакует карбокатион и присоединяется в транс-положение. Так получается продукт реакции: нуклеофил   Е+ σ → У-σ E 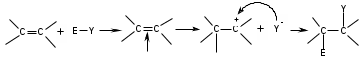  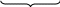  δ - комплекс 3.Реакции электрофильного замещения (SE) Механизм таких реакций включает следующие стадии: 1. генерирование электрофильной частицы с помощью катализатора: 2. атака электрофилом бензольного ядра и образование π-комплекса; 3. образование σ-комлекса: электрофил “забирает” два электрона π-системы и образует σ-связь с одним из атомов углерода бензольного кольца. Ароматичность нарушается, т.к. этот атом углерода переходит в sp3-гибридизованное состояние; 4. отщепление протона от σ-комплекса, восстановление ароматической системы; 5. связывание отщепившегося протона с нуклеофилом. 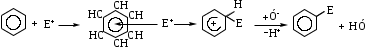 Место вступления электрофильного заместителя определяется характером уже присутствующих – одного или нескольких заместителей в бензольном цикле. Заместители делятся на 2 группы: а) заместители 1 рода (орто- пара-ориентанты), облегчают (ускоряют) вступление электрофильного заместителя в орто- и пара- положение по отношению к себе. Ориентанты даются в порядке убывающей ориентирующей способности. – Оˉ, −NR2; −NHR; −NH2; – OH; –OR; −CH3; алкины, алкены, −I; −Br; −Cl; −F. Эти группы, проявляющие положительный индуктивный эффект и положительный мезомерный эффект.  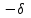 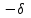 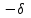 б) заместители 2-го рода (мета-ориентанты) затрудняют (замедляют) вступление электрофильного заместителя в мета - положение 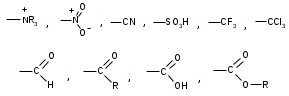 Это группы, проявляющие отрицательный индуктивный или отрицательный мезомерный эффекты.  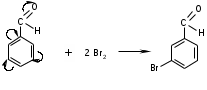  КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ Что такое реакционная способность, субстрат, реагент? Какие типы реагентов и способы разрыва ковалентной связи существуют? Какие классификации органических реакций существуют? Что называют реакциями радикального замещения: галогенирование алканов и циклоалканов? Что называют цепными процессами? В чем заключается правило региоселективности? Что называют реакциями электрофильного присоединения? В чем заключается правило Марковникова? Что называют ароматическими углеводородами? Критерии ароматичности. Как протекают реакции электрофильного замещения (галогенирование, нитрование, сульфирование, алкилирование, ацилирование аренов)? В чем заключается влияние электронодонорных и электроноакцепторных заместителей на направление и скорость реакции электрофильного замещения? Что называют ориентантами I и II рода? Какие представители ароматических углеводородов вам известны (бензол, толуол, ксилол, стирол)? Задания для самостоятельного решения Приведите уравнение реакции бромирования пропана. Назовите и напишите механизм реакции. Приведите уравнение реакции иодирования бутана. Назовите и напишите механизм реакции с получением дииодпроизводного бутана. Приведите уравнение реакции фторирования изобутана. Назовите и напишите механизм реакции. Приведите уравнение реакции хлорирования циклопропана. Назовите механизм реакции. Приведите уравнение реакции нитрования гексана. Приведите уравнение реакции бромирования пропана. Назовите и напишите механизм реакции с получением дибромпроизводного пропана. Приведите уравнение реакции хлорирования изобутана. Назовите и напишите механизм реакции. Запишите реакцию взаимодействия бензола с бромом. Опишите механизм реакции. Проведите сульфирование бензола. Опишите механизм реакции. Запишите реакцию нитрования толуола. Опишите механизм. Проведите хлорирование толуола по механизму. Опишите механизм данной реакции. Запишите реакцию взаимодействия нитробензола с Cl2. Опишите механизм реакции. МОДУЛЬ II. РЕАКЦИОННАЯ СПОСОБНОСТЬ СПИРТОВ, АЛЬДЕГИДОВ, КЕТОНОВ, КАРБОНОВЫХ КИСЛОТ ТЕМА Спирты и фенолы План занятия 1. Устный опрос и коррекция знаний 2. Лабораторная работа №2 3. Подведение итогов занятия УЧЕБНЫЕ ЭЛЕМЕНТЫ ТЕМЫ Спирты — это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами. Общая формула R - OH Биологически активные представители спиртов: Одноатомные: СН3ОН — метанол — обладает наркотическим действием; крайне токсичен, т.к. в организме преобразуется в яды — формальдегид и муравьиную кислоту. Уже в небольших дозах (10 мл) может вызывать слепоту. С2Н5ОН — этанол — естественный метаболит. В больших дозах оказывает опьяняющее и наркотическое действие. При этом воздействует на ЦНС вначале возбуждающе, а затем угнетающе, притупляя чувствительность, ослабляя функцию мозга и мышечной системы, ухудшая реакцию. Его длительное употребление приводит к алкоголизму. В медицине используется как антисептик и растворитель лекарственных средств.  — ментол — относится к терпенам. Входит в состав сердечно-сосудистых средств, зубных порошков и паст.  В природе также встречаются первичные спирты с числом углеродных атомов от 6 до 30. Они входят в состав бактерий. Многоатомные:  глицерин — важнейший биогенный спирт. В виде сложных эфиров высших жирных кислот входит в состав жиров, а также фосфатидной кислоты — родоначальника большинства липидов биологических мембран. В медицине применяется как увлажнитель фармацевтических препаратов. Н2С — СН — СН2 — | | | OH OH OH  — миоинозит — шестиатомный спирт циклогексанового ряда. Содержится в почках, печени, мышцах, мозгу. Это - витаминоподобное соединение; является фактором роста, а также структурным компонентом ряда биорегуляторов биохимических процессов. 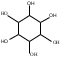 Наличие гидроксильных групп в молекуле повышает растворимость вещества в воде и увеличивает его токсичность и наркотическое действие. Эти свойства усиливаются с удлинением углеродной цепи, проходя через максимум при С6—С8; с разветвлением цепи, а также при переходе от первичных спиртов к вторичным и третичным. Присутствие галогенов или кратных связей в молекуле спирта тоже усиливает его наркотическое действие. Кроме того, причиной токсичности спиртов в организме могут служить продукты их метаболических превращений. Фенол - производные ароматических углеводородов, содержащие одну или более гидроксильных групп. Биологически активные представители фенолов: ОН 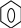 | | одноатомный фенол — карболовая кислота — антисептик, используется в производстве лекарственных средств. Антисептические свойства фенола и этанола объясняются их склонностью к образованию водородных связей. Данные соединения способны разрушать гидратную оболочку вокруг белков за счет разрыва существующих и образования новых водородных связей с протоно- и электродонорными группами белков, что и приводит к их денатурации. Однако, пары фенола ядовиты, а его раствор может вызвать ожоги тканей, поэтому карболовая кислота используется для дезинфекции помещений, мебели, посуды и т.д. Двухатомные фенолы: ОН  ОН — пирокатехин (ортодигидроксибензол) — структурный компонент катехоламинов (норадреналина и адреналина). ОН  — резорцин (метадигидроксибензол) в составе примочек и — резорцин (метадигидроксибензол) в составе примочек имазей используется для лечения кожных заболеваний. ОНОН  — гидрохинон (парадигидроксибензол) — участник — гидрохинон (парадигидроксибензол) — участникдыхательной цепи переноса электронов: ОН Фенолы образуются в организме в результате метаболизма ароматических аминокислот. Присутствие ОН-группы в ароматическом ядре обуславливает антисептические свойства, поэтому многие фенолы оказывают бактерицидное действие; применяются как дезинфицирующие средства. Контрольные вопросы по теме 1. Что называют спиртами и фенолами? 2. Какими кислотными свойства обладают спирты и фенолы? 3. По какому механизму протекают реакции в ряду гидроксисоединений? 4. Как записать уравнения внутри – и межмолекулярной дегидротации спиртов? 5.Какие продукты реакции образуются при окисление спиртов? Приведите примеры. 6. Какие фенолы называются одно-, двух- и трехатомные? Приведите примеры и их медико-биологическое значение. ЗАДАНИЯ для II ЭТАПА ЭКЗАМЕНА (Напишите структурные формулы следующих соединений) Спирты Одноатомные: метанол, этанол, пропанол-2, бутанол-2,пентанол-2, пентанол-3. Многоатомные: этандиол-1,2 (этиленгликоль), инозит (миоинозит), пропантриол-1,2,3 (глицерин). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

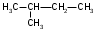
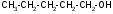

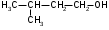

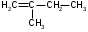
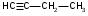
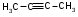
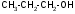
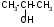
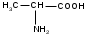
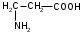
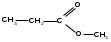
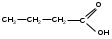
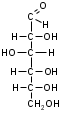
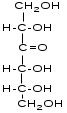 фруктоза
фруктоза