1. Вопросы, которые необходимо изучить и уметь дать на них ответ:
1.1. Что изучает химическая термодинамика и ее раздел "термохимия".
1.2. Какие величины являются термодинамическими функциями состояния системы, а какие являются параметрами; каковы обозначения и размерности этих величин.
1.3. Каковы признаки изобарных, изохорных и изотермических процессов; как выражается первый закон термодинамики для изобарных и изохорных процессов.
1.4. В чем состоит сущность термодинамической функции "энтальпия системы", от чего она зависит и почему является функцией состояния.
1.5. Какова взаимосвязь между энтальпией и тепловым эффектом реакции.
1.6. Что называется стандартной энтальпией, энтропией и энергией Гиббса образования сложного вещества (H0298, S0298, G0298 соответственно), в каких единицах они выражаются.
1.7. Какие уравнения реакций называются термохимическими; какое значение имеет изменение энтальпии при экзо- и эндотермических реакциях?
1.8. Как формулируются закон Гесса и следствия из него, каково их практическое значение; как они используются при расчете изменения энтальпии, энтропии и энергии Гиббса химических и физико-химических процессов и для определения устойчивости веществ.
1.9. Какова сущность понятия "энтропия системы"; какова взаимосвязь между энтропией и термодинамической вероятностью системы; как изменяется энтропия в системе в случае самопроизвольно протекающих химических или физико-химических процессов при Н=0.
1.10. Что понимается под энтальпийным и энтропийным факторами.
1.11. Каковы сущность понятия "энергия Гиббса" и математическое выражение для ее расчета. Почему энергия Гиббса называется движущей силой процессов; какие по знаку значения G являются критерием самопроизвольного протекания химических и физико-химических процессов; при каких сочетаниях знаков величин Н и T∙S процесс всегда возможен, а при каких невозможен.
1.12. Чем характеризуется состояние термодинамического равновесия; каково выражение для расчета температуры, при которой в системе устанавливается термодинамическое равновесие.
2. Письменное задание для контроля усвоения темы:
Для данной в Вашем варианте реакции (табл. 3.18):
2.1. Составьте по закону Гесса и следствию из него общие выражения для расчета изменений энтальпии, энтропии и энергии Гиббса применительно к данной химической реакции при стандартных условиях (H0х.р., S0х.р., G0х.р.).
2.2. Рассчитайте значения величин ΔН0, ΔS0, ΔG0 для данной реакции, использовав термодинамические характеристики соответствующих веществ, приведенных в таблице 3.19. Укажите размерности всех рассчитанных величин.
2.3. Охарактеризуйте сущность термодинамических величин Н, S, G и их изменений ΔН, ΔS, ΔG.
2.4. Укажите, каково соотношение между ΔН и Q и каков тепловой эффект данной реакции; к какому термохимическому типу она относится (экзо- или эндотермическая) и почему.
2.5. На основании проведенных расчетов определите, возможно или нет самопроизвольное протекание данной реакции при стандартных условиях в прямом направлении и обоснуйте свой ответ.
2.6. Приведите уравнение для расчета ΔG при различных значениях температуры. Рассчитайте ΔG в данной реакции при 500 К и определите, в прямом или обратном направлении будет проходить данная реакция при этой температуре.
2.7. Охарактеризуйте состояние термодинамического равновесия; каково значение ΔG при его достижении; рассчитайте значение температуры, при которой достигается термодинамическое равновесие (Травн.), и укажите, для чего можно использовать её значение.
2.8. Укажите, какое из подчеркнутых в уравнении данной реакции веществ является более термодинамически устойчивым. Обоснуйте это с приведением соответствующих термодинамических величин и формулировки одного из следствий закона Гесса.
2.9. Укажите, при каких соотношениях и знаках величин H и Т∙S самопроизвольное протекание реакции: а) возможно; б) невозможно и обоснуйте свой ответ.
Таблица 3.18
Ва-
ри-
ант
|
Реакция
|
Ва-
ри-
ант
|
Реакция
|
1
|
4 NH3(г) + 5 О2(г) = 4 NO(г) + 6 H2O(г)
|
19
|
2 СН3ОН(ж) + 3 О2(г) = 2 СО2(г) + 4 Н2О(ж)
|
2
|
2 C2H6(г) + 7 О2(г) = 4 СО2(г) + 6 Н2О(г)
|
20
|
NH3(г) + HCl(г) = NH4Cl(к)
|
3
|
2Н2S(г) + 3 О2(г) = 2 SO2(г) + 2 Н2О(г)
|
21
|
2 SO2(г) + О2(г) = 2 SO3(г)
|
4
|
Н2S(г) + I2(г) = 2 НI(г) + S(к)
|
22
|
H2S(г) + О2(г) = 2 Н2О(г) + 2 S(к)
|
5
|
Fe2O3(к) + 3 H2(г) = 2 Fe(к) + 3 H2O(г)
|
23
|
Li2O(к) + Н2О(ж) = 2 LiOH(к)
|
6
|
СО(г) + 3 Н2(г) = СН4(г) + Н2О(г)
|
24
|
CuO(к) + 2 НCl(г) = CuCl2(к) + H2O(ж)
|
7
|
С2Н5ОН(ж) + 3 О2(г) = 2 СО2(г) +
3 Н2О(ж)
|
25
|
Cr2O3(к) + 2 Al(к) = Al2O3(к) + 2 Сr(к)
|
8
|
2 С2Н2(г) + 5 О2(г) = 4 СО2(г) + 3 Н2О(г)
|
26
|
NH3(г) + 3 О2(г) = 2 N2(г) + 6 Н2О(ж)
|
9
|
СО2(г) + 4 Н2(г) = СН4(г) + 2 Н2О (г)
|
27
|
3 NO2(г) + Н2О(ж) = 2 HNO3(ж) + NO(г)
|
10
|
СаСО3(к) = СаО(к) + СО2(г)
|
28
|
2 NO(г) + О2(г) = 2 NO2(г)
|
11
|
Fe(к) + 2HCI(ж) = FeCI2(к) + H2(г)
|
29
|
4 NO2(г) + 2 Н2О(ж) + О2(г) = 4 HNO3(ж)
|
12
|
СаО(к) + Н2О(ж) = Са(ОН)2(к)
|
30
|
Fe2O3(к) + MnO2(к) + 5 С(к) = 2 Fe(к) + Mn(к) + 5 СО(г)
|
13
|
2 СН4(г) = С2Н2(г) + 3 Н2(г)
|
31
|
2 FeCl2(к) + Cl2(г) = 2 FeCl3(к)
|
14
|
2 Н2О2(ж) = 2 Н2О(ж) + О2(г)
|
32
|
Mg(к) + 2 НCl(г) = MgCl2(к) + Н2(г)
|
15
|
Al2O3(к) + Н2(г) = Al(к) + Н2О(г)
|
33
|
Na2CO3(к) + 2 HCl(г) = 2 NaCl(к) +
Н2О(ж) + СО2(г)
|
16
|
NH4Cl(к) =NH3(г) + HCl(г)
|
34
|
Br2(ж) + H2S(г) = HBr(г) + S(к)
|
17
|
СН4(г) + СО2(г) = 2 СО(г) + 2 Н2(г)
|
35
|
HCl(г) + NaOH(к) = NaCl(к) + Н2О(г)
|
18
|
С2Н4(г) + 3 О2(г) = 2 СО2(г) + 2 Н2О(ж)
|
36
|
MgO(к) + Н2(г) = Mg(к) + Н2О(г)
|
Таблица 3.19 – Термодинамические характеристики веществ, приведенных в таблице 3.18
Вещество
|
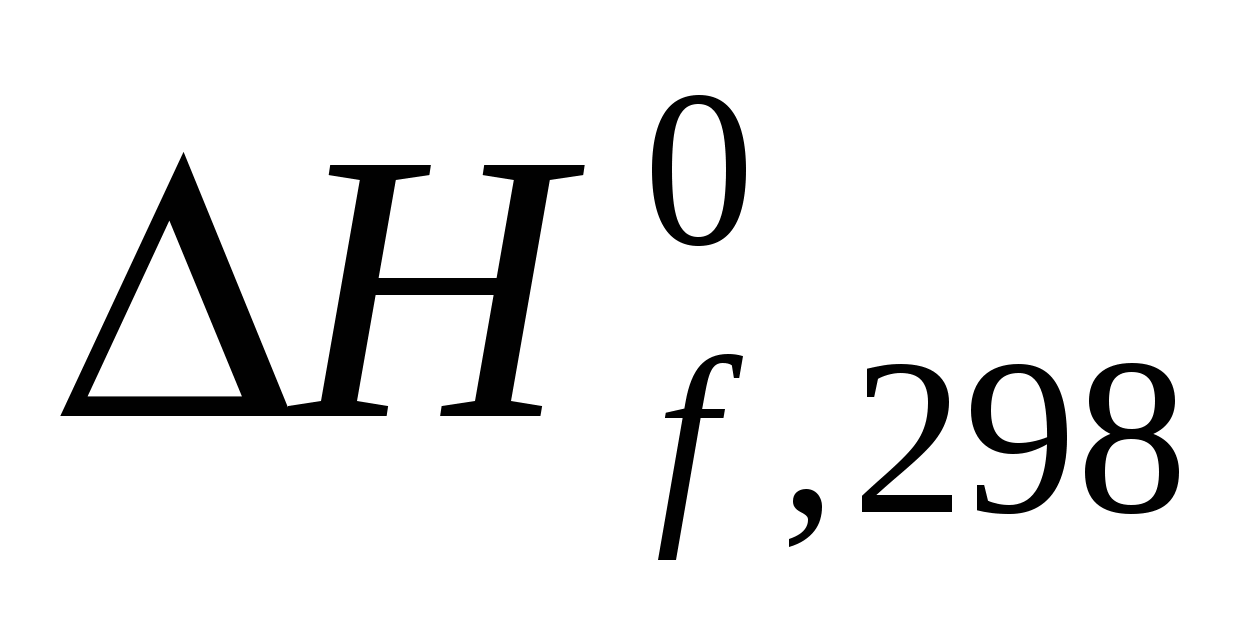
кДж/моль
|

кДж/моль
|
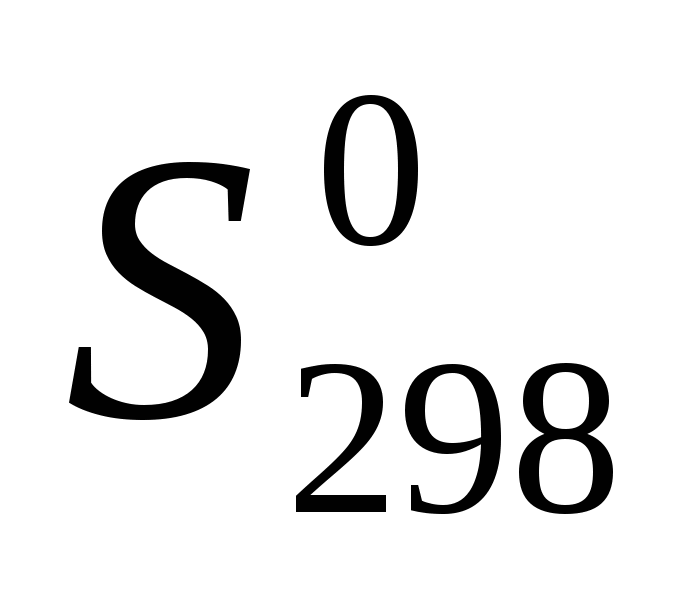
Дж/(моль ·К)
|
Al (к)
|
0,00
|
0,00
|
28,32
|
Al2O3 (к, корунд)
|
-1676,0
|
-1580,0
|
50,94
|
Br2 (ж)
|
0,00
|
0,00
|
152,3
|
С (к, графит)
|
0,00
|
0,00
|
5,74
|
СО (г)
|
-110,5
|
-137,14
|
197,54
|
СО2 (г)
|
-393,51
|
-394,38
|
213,68
|
СН4 (г)
|
-74,85
|
-50,79
|
186,19
|
С2Н2 (г)
|
226,75
|
209,2
|
200,8
|
С2Н4 (г)
|
52,28
|
68,11
|
219,4
|
С2Н6 (г)
|
-84,68
|
-32,89
|
229,5
|
СН3ОН (ж)
|
-238,6
|
-166,23
|
126,8
|
С2Н5ОН (ж)
|
-277,7
|
-174,76
|
160,7
|
CaCО3 (к, кальцит)
|
-1207,1
|
-1128,76
|
92,88
|
CaO (к)
|
-635,5
|
-604,2
|
39,7
|
Ca(OH)2 (к)
|
-986,2
|
-898,5
|
83,4
|
Cl2 (г)
|
0,00
|
0,00
|
222,96
|
Продолжение таблицы 3.19
Вещество
|
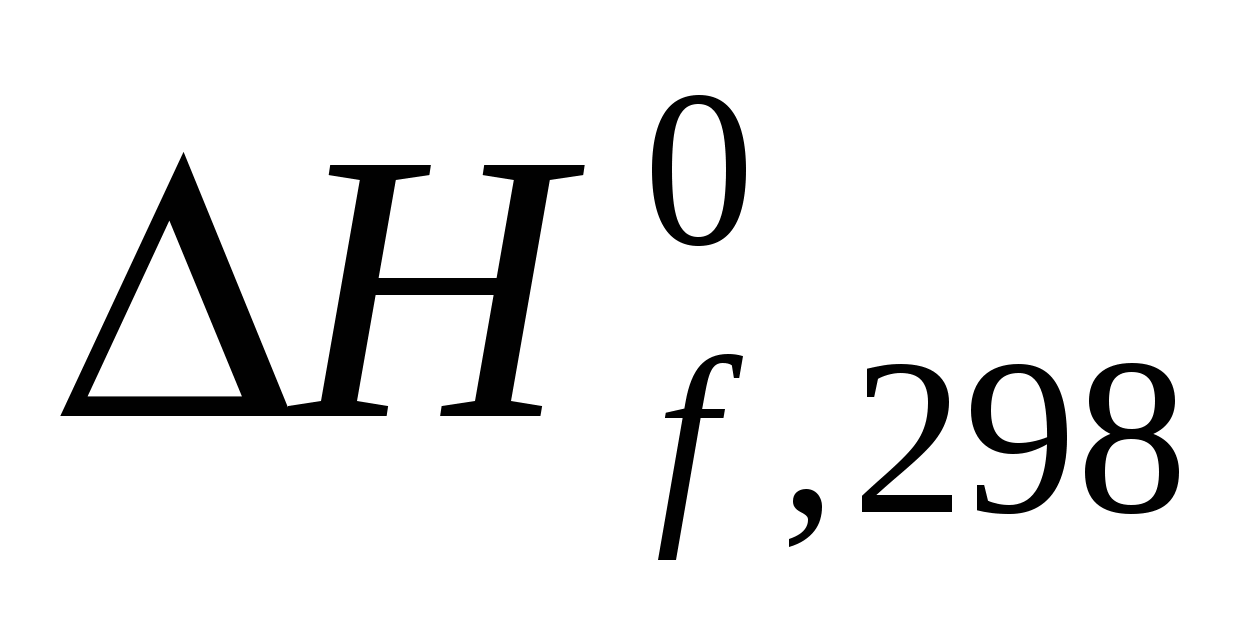
кДж/моль
|

кДж/моль
|
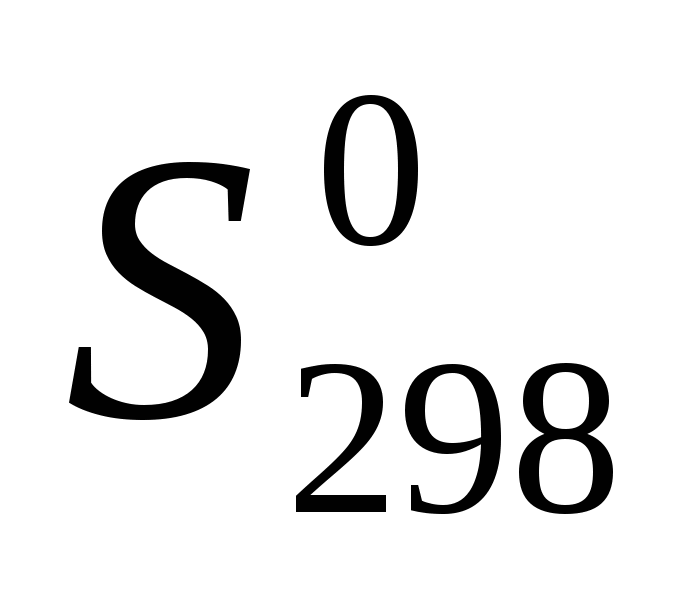
Дж/(моль ·К)
|
Cr (к)
|
0,00
|
0,00
|
23,76
|
Cr2O3 (к)
|
-1141
|
-1058
|
81,1
|
CuCl2 (к)
|
-172,4
|
131,4
|
118,8
|
CuO (к)
|
-165,0
|
-127,0
|
42,64
|
Fe (к)
|
0,00
|
0,00
|
27,15
|
FeCl2 (к)
|
-341,0
|
-301,7
|
120,1
|
FeCl3 (к)
|
-390,8
|
-328,7
|
154,4
|
Fe2O3 (к)
|
-822,16
|
-740,98
|
89,96
|
H2 (г)
|
0,00
|
0,00
|
130,58
|
HBr (г)
|
-35,98
|
-53,5
|
198,5
|
HCl (г)
|
-92,3
|
95,27
|
186,69
|
HI (г)
|
25,94
|
1,3
|
206,3
|
HNO3 (ж)
|
-174,3
|
-80,3
|
156,6
|
H2O (г)
|
-241,82
|
-228,61
|
188,7
|
H2O (ж)
|
-285,84
|
-237,2
|
70,08
|
H2O2(ж)
|
-187,8
|
-120,4
|
109,6
|
H2S (г)
|
-20,17
|
-33,01
|
205,6
|
I2 (г)
|
62,24
|
19,4
|
260,58
|
LiOH (к)
|
-487,8
|
-443,9
|
42,7
|
Li2O (к)
|
-598,7
|
-562,1
|
37,9
|
Mg (к)
|
0,00
|
0,00
|
32,55
|
MgCl2 (к)
|
-641,6
|
-592,1
|
89,6
|
MgO (к)
|
-601,24
|
-569,4
|
26,94
|
Mn (к)
|
0,00
|
0,00
|
30,02
|
MnO2 (к)
|
-519,4
|
-464,8
|
53,14
|
N2 (г)
|
0,00
|
0,00
|
191,5
|
NH3 (г)
|
-46,19
|
-16,66
|
192,5
|
NH4Cl (к)
|
-314,4
|
-203,0
|
94,6
|
NO (г)
|
90,37
|
86,71
|
210,62
|
NO2 (г)
|
33,50
|
51,8
|
240,45
|
NaCl (к)
|
-410,9
|
-384,0
|
72,33
|
NaOH (к)
|
-427,8
|
-381,1
|
64,18
|
Na2CO3 (к)
|
-1130,9
|
-1047,7
|
136,0
|
O2 (г)
|
0,00
|
0,00
|
205,04
|
S (к, ромб.)
|
0,00
|
0,00
|
31,88
|
SO2 (г)
|
-296,9
|
-300,4
|
248,1
|
SO3 (г)
|
-395,2
|
-370,4
|
256,23
|
Комплексное тестовое задание 2 по теме "Химическая термодинамика"
Правильные ответы по п. А приведены в конце пособия в таблице 4.1.
А. Выберите правильный ответ (1, 2 или 3) из задания по Вашему варианту в таблице 3.20 и приведите его.
Б. Обоснуйте ответ по п. А, сопроводив его необходимыми объяснениями. Приведите формулировку закона Гесса, 1-го и 2-го следствий из него. Укажите сущность, математические выражения, размерность термодинамической функции или другого понятия, рассматриваемых в Вашем варианте.
Таблица 3.20 – Тестовое задание 11 (Т-11)
Ва-ри-ант
|
Задание
|
Варианты ответа
|
1
|
2
|
3
|
1
|
1. Что изучает термохимия?
|
тепловые эффекты химических реакций
|
скорость протекания реакций
|
степень упорядоченности системы
|
2
|
Как называется величина, обозначаемая H?
|
энтропия
|
изменение энта-льпии
|
энергия Гиббса
|
3
|
Термохимические расчеты проводятся на основе:
|
закона Гесса
|
закона действую-щих масс
|
закона Ома
|
4
|
Термодинамическая функция, обозначаемая S0, называется:
|
внутренняя энергия
|
энтальпия
|
энтропия
|
5
|
В ходе химической реакции энергия систкмы:
|
всегда понижается
|
всегда повышается
|
может или повышаться, или понижаться
|
6
|
Эндотермической реакцией является:
|
CaO + H2O = Ca(OH)2, + Q
|
2KMnO4 = MnO2 + K2MnO4 + O2, H0298 > 0
|
H2 + Cl2 = 2HCl, H0298 < 0
|
7
|
Химическая реакция является экзотермической, если разность между суммой значений энергий связей в исходных веществах и суммой значений энергий связей в продуктах реакции:
|
больше нуля
|
меньше нуля
|
равна нулю
|
8
|
Реакция, протекающая с поглощением тепла, называется:
|
экзотермической
|
изотермической
|
эндотермической
|
Продолжение таблицы 3.20 – Тестовое задание 11 (Т-11)
Ва-ри-ант
|
Задание
|
Варианты ответа
|
1
|
2
|
3
|
9
|
Реакция, протекающая по уравнению 3H2 + N2 = 2NH3; -H, является:
|
обратимой экзотермической
|
необратимой экзотермической
|
обратимой эндотермической
|
10
|
Реакция, уравнение которой 2H2O + 2Na 2NaOH + H2, -H, относится:
|
к экзотермическим реакциям замещения
|
к экзотермическим реакциям присоединения
|
к эндотермическим реакциям замещения
|
11
|
Стандартные значения энтальпии образования простых веществ:
|
больше нуля
|
равны нулю
|
меньше нуля
|
12
|
Степень упорядоченности системы характеризует величина, называемая:
|
энтальпией
|
энтропией
|
энергией Гиббса
|
13
|
При испарении энтропия системы в парообразном состоянии:
|
не изменяется
|
увеличивается
|
уменьшается
|
14
|
Самопроизвольное протекание химической реакции возможно, если:
|
U0 > 0
|
G0 > 0
|
G0 < 0
|
15
|
При каком условии в системе наступает состояние термодинамического равновесия?
|
H0 = 0
|
S0 = 0
|
G0 = 0
|
16
|
Какой знак имеет S0 в процессе возгонки:
CO2 (тв) = CO2 (г) :
|
больше нуля
|
меньше нуля
|
равно нулю
|
17
|
Каким символом обозначают изменение свободной энергии в ходе химического процесса?
|
S
|
G
|
H
|
18
|
Какое математическое выражение отражает 1-й закон термодинамики для изобарных процессов:
|
G = H – ТS
|
Q = U + pV
|
H = H2 – H1
|
19
|
1-ое следствие из закона Гесса отражается математическим уравнением:
|
-H образования вещества из простых веществ = H разложения вещества на простые вещества
|
Q = -H
|
Q = U
|
20
|
Равенство энтальпийного и энтропийного факторов (H0 298 = TS0 298) характерно для:
|
начала реакции
|
термодинамического равновесия
|
окончания реакции
|
Продолжение таблицы 3.20 – Тестовое задание 11 (Т-11)
Ва-ри-ант
|
Задание
|
Варианты ответа
|
1
|
2
|
3
|
21
|
Стандартные значения энтропии образования простых веществ:
|
равны нулю
|
меньше нуля
|
не равны нулю
|
22
|
Какое выражение соответствует изменению энтальпии химической реакции 2СО(г) + O2 (г) = 2СО2(г) ?
|
H0 реакции =
2H0СО2(г) –
2H0СО(г)
|
H0 реакции =
2H0СО2(г) –
(2H0СО(г) +
H0О2 (г))
|
H0 реакции =
2H0СО(г) –
2H0СО2(г)
|
23
|
Формулировка какого закона приведена: «Тепловой эффект химической реакции не зависит от пути, по которому она протекает, а определяется только природой и состоянием исходных веществ и продуктов реакции»?
|
закона Гесса
|
второго закона термодинамики
|
первого закона термодинамики
|
24
|
В каких единицах выражается тепловой эффект реакции?
|
кДж
|
градус Цельсия
|
градус Кельвина
|
25
|
Термохимические уравнения отличаются от химических тем, что в них указываются:
|
агрегатные состояния веществ
|
степени окисления элементов
|
агрегатные состояния веществ и тепловой эффект
|
26
|
Какие условия в термохимии являются стандартными?
|
Т = 298 К;
р = 101,3 кПа;
С = 1 моль/кг
|
Т = 273 К;
р = 101,3 кПа;
С = 1 моль/кг
|
Т = 298 К;
р = 101,3 кПа;
С = 0,5 моль/кг
|
27
|
Математическое выражение изменения свободной энергии:
|
G = H – ТS
|
Q = U
|
Q = -H
|
28
|
Термохимическим уравнением является:
|
S(тв) + O2(г) = SO2 (г), H0298 =
-297 кДж/моль
|
S(тв) + O2(г) = SO2 (г)
|
S + O2 = SO2,
H0298 =
-297 кДж/моль
|
29
|
Согласно закону Гесса, тепловой эффект химической реакции зависит:
|
от присутствия катализатора
|
от пути перехода системы из одного состояния в другое
|
от начального и конечного состояния химической системы
|
30
|
В результате реакции, протекающей с уменьшением объема газообразных веществ, энтропия системы:
|
увеличивается
|
остается неизмен-ной
|
уменьшается
|
Продолжение таблицы 3.20 – Тестовое задание 11 (Т-11)
Ва-ри-ант
|
Задание
|
Варианты ответа
|
1
|
2
|
3
|
31
|
Наиболее термодинамически устойчивым является соединение:
|
СО (г)
H0СО(г) =
-110,5 кДж/моль
|
СО2 (г)
H0СО2(г) =
-393,51 кДж/моль
|
СН4 (г)
H0СН4(г) =
-74,85 кДж/моль
|
32
|
В прямом направлении при стандартных условиях процесс протекает самопроизвольно, если:
|
S>0; H>0,
при этом
H>ТS
|
S>0; H<0
|
G>0
|
33
|
Система находится в состоянии термодинамического равновесия, если:
|
S<0; H>0
|
S>0; H<0
|
H = ТS
|
34
|
Физико-химические процессы при стандартных условиях не могут протекать в прямом направлении при стандартных условиях, если:
|
S<0; H>0
|
S>0; H<0
|
S<0; H<0,
при этом
H>ТS
|
35
|
В каких единицах выражается изменение энтропии реакции?
|
кДж/(моль·К)
|
Дж/(моль·К)
|
кДж/моль
|
Задание 6. Химическая кинетика и химическое равновесие (по разделам стандартов: химическое равновесие, скорость реакции и методы ее регулирования, катализаторы и каталитические системы)
Рекомендуемая литература: [1], гл. 6, разд. 6.2; [2], гл. V, § 5.5, гл. VI, § 6.1, гл. 7; [3], гл. VI; [4], гл. 5, §§ 3-11; лекции.
|
 Скачать 3.51 Mb.
Скачать 3.51 Mb.