Химическая связь. Учебное пособие Рябухин Ю. И. Астрахань Астрахан гос техн унт, 2013. 40 с. Предназначено для студентов инженернотехнических нехимических специальностей
 Скачать 0.94 Mb. Скачать 0.94 Mb.
|
|
Насыщаемость Каждый атом способен образовывать определённое число ковалентных связей, благодаря этому молекулы имеют определённый состав: Н2, H2O, PCl5, СН4. Число возможных ковалентных связей, образуемых данным атомом, зависит при обменном механизме от числа неспаренных электронов на внешнем энергетическом уровне атома в основном и в возбуждённом состояниях, а при донорно-акцепторном — ещё и от числа свободных орбиталей на внешних уровнях. При определении числа ковалентных связей, которые атом данного элемента может образовывать по обменному механизму, следует учитывать, что при переходе атома в возбуждённое состояние число его неспаренных электронов может увеличиваться в результате распаривания некоторых электронных пар и перехода электронов на более высокие энергетические подуровни. Если энергия, затраченная на возбуждение атома, невелика, то она может компенсироваться энергией образующейся химической связи, и возбуждённое состояние атома стабилизируется. Небольшими затратами энергии сопровождаются переходы электронов на более высокие энергетические подуровни внутри уровня. Переходы электронов с энергетических подуровней одного уровня на подуровни другого уровня требуют больших затрат энергии, поэтому возбуждённые состояния у атомов элементов первых трёх периодов Периодической системы химических элементов Д. И. Менделеева, возникающие в результате таких переходов, не могут стабилизироваться химическими связями. Определим валентности2 атомов элементов первого и второго периодов периодической системы химических элементов в основном и возбуждённом состояниях. Атом водорода имеет один электрон, поэтому его валентность всегда равна I. В атоме гелия два электрона занимают ls-орбиталь. Распаривание и переход одного из этих электронов на более высокий энергетический уровень требует больших затрат энергии, поэтому атом гелия является химически инертным. Валентности атомов лития Li, азота N, кислорода O, фтора F и неона Ne равны числу неспаренных электронов в основном состоянии, так как распаривание электронных пар атомов этих элементов возможно только при переходе электрона на более высокий энергетический уровень: Из приведённых схем электронных формул видно, что валентность атома лития равна I, азота – III, кислорода – II, фтора – I, неона – 0. В атомах бериллия Be, бора B и углерода C может происходить распаривание электронных пар и переход электронов с 2s-подуровня на вакантные орбитали 2р-подуровня. Переход на более высокий энергетический подуровень внутри уровня не требует большой затраты энергии, и она может быть скомпенсирована за счёт образования химической связи. И поэтому такие переходы осуществляются в условиях обычных химических реакций. Поэтому валентности II, III и IV, присущие соответственно атомам Be, В и С в возбуждённом состоянии, более характерны, чем валентности I и II соответственно атомов В и С, определяемые числом неспаренных р-электронов в их основном состоянии: Начиная с третьего периода, у атомов р-элементов при возбуждении электроны внешних s- и р-подуровней могут переходить на вакантный d-подуровень, что обуславливает увеличение числа возможных химических связей. Именно этим объясняется способность атомов фосфора Р образовывать пять химических связей (PCl5), атомов серы S – четыре (SO2) или шесть (SO3), а атомов хлора Cl – три, пять и даже семь (происходит, так называемое расширение октета): 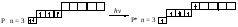 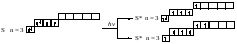 Направленность Орбитали атомов, участвующие в образовании молекулярных орбиталей, имеют разную форму и разную ориентацию в пространстве. Это обусловливает направленность ковалентных связей, поскольку соединяемые атомы стремятся к максимальному перекрыванию их орбиталей. Направленность ковалентных связей характеризуется валентными углами (углами между соседними связями). Например, молекулы СН4, NH3, H2O имеют строго определённые значения валентных углов. Длина и валентные углы ковалентных связей определяют пространственную структуру (геометрию) молекул и многоатомных ионов. Геометрия молекулы— это взаимное пространственное расположение её атомов, которое определяется длинами связей и валентными углами. Геометрия молекулы во многом определяет физические и химические свойства вещества. Представления метода валентных связей позволяют объяснить геометрию многих молекул. Например, атомы элементов VIA-группы в основном состоянии имеют по два неспаренных р-электрона, облака которых вследствие электростатического отталкивания располагаются перпендикулярно друг другу (рис. 6 а).При образовании молекул водородных соединений (гидридов) H2S, H2Se и H2Te две р-орбитали атомов соответствующих элементов перекрываются с s-орбиталями атомов водорода, образуя ковалентные связи, угол между которыми близок к 90°(табл. 1). Исключение составляет молекула воды, у которой валентный угол Н–О–Н равен 104,5°. Талица 1. Валентные углы в молекулах гидридов элементов IV–VIA-групп
Из рис. 6 бвидно, что близки к 90° и углы в молекулах гидридов элементов VA-группы (РН3, AsH3, SbH3), что хорошо согласуется с взаимным расположением трёх р-орбиталей, содержащих по одному электрону. Исключение составляет молекула аммиака, у которой валентные углы H–N–H равны 107,78° (табл. 1). Рис. 6. Схема перекрывания аомных рбиталей в молекулах гидридов серы, селена, теллура (а), фосфора, мышьяка и сурьмы (б); пунктирными линиями изображены атомные ns- и пр-орбитали,на которых находятся не связывающие электронные пары Труднее объяснить с позиций метода валентных связей геометрию молекул гидридов элементов IVA-группы. Атомы этих элементов в возбуждённом состоянии имеют четыре неспаренных электрона: один на s-орбитали и три на р-орбиталях. В гидридах СН4, SiH4, GeH4, SnH4 имеется четыре ковалентные связи. Три из них образованы за счёт перекрывания р-орбиталей атомов элементов IVA-группы и s-орбиталей атомов водорода. Эти связи должны иметь равную длину и энергию и располагаться под углом 90° друг к другу. Образование четвёртой ковалентной связи могло осуществиться за счёт перекрывания s-орбиталей атомов углерода и водорода, и она должна была бы отличаться от других связей по длине и энергии и располагаться по отношению к любой из них под углом около 125°. Однако установлено, что структура молекул гидридов элементов IVA-группы имеет форму тетраэдра с углами между связями, равными 109,5°, и при этом все ковалентные связи равноценны по длине и энергии. Таким образом, геометрию молекул гидридов элементов IVA-группы (воды, аммиака и других веществ) невозможно объяснить с позиций только положений метода валентных связей. Для объяснения пространственного строения молекул или многоатомных ионов с учётом направленности ковалентных связей Л. Полинг предложил концепцию гибридизации атомных орбиталей. Гибридизация атомных орбиталей Гибридизацией называется гипотетический процесс смешения различного типа, но близких по энергии орбиталей данного атома с возникновением того же числа новых (гибридных1) орбиталей, одинаковых по энергии и форме. Гибридизация атомных орбиталей происходит при образовании ковалентных связей. Гибридные орбитали имеют форму объёмной несимметричной восьмёрки, сильно вытянутой в одну сторону от атомного ядра: . Такая форма обусловливает более сильное, чем в случае чистых атомных орбиталей, перекрывание гибридных орбиталей с орбиталями (чистых или гибридных) других атомов и приводит к образованию более прочных ковалентных связей. Поэтому энергия, затрачиваемая на гибридизацию атомных орбиталей, с избытком компенсируется выделением энергии за счёт образования более прочных ковалентных связей с участием гибридных орбиталей. Название гибридных орбиталей и тип гибридизации определяются числом и типом участвующих в гибридизации атомных орбиталей, например: sp-, sp2-, sp3-, sp2d- или sp3d2-гибридизация. Направленность гибридных орбиталей, а следова тельно, и геометрия молекулы зависят от типа гибридизации. На практике обычно решается обратная задача: вначале экспери ментально устанавливается геометрия молекулы, после чего описывается тип и форма гибридных орбиталей, участвующих в её образовании. sp-Гибридизация.Две гибридных sp-орбитали в результате взаимного отталкивания располагаются относительно атомного ядра таким образом, что угол между ними составляет 180° (рис. 7). 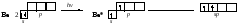 Рис. 7. Взаимное расположение в пространстве двух sp-гибридных орбиталей одного атома: а - поверхности, охватывающие области пространства, где вероятность пребывания электрона составляет 90 %; б - условное изображение. В результате такого расположения гибридных орбиталей молекулы состава АХ2, где А является центральным атомом, имеют линейное строение, то есть ковалентные связи всех трёх атомов располагаются на одной прямой. Например, в состоянии sp-гибридизации находятся валентные орбитали атома бериллия в молекуле ВеС12 (рис. 8). Линейную конфигурацию вследствие sp-гибридизации валентных орбиталей атомов имеют также молекулы ВеН2, Ве(СН3)2, ZnCl2, CO2, HC≡N и ряд других. Рис. 8. Трёхатомная линейная молекула хлорида бериллия ВеС12 (в газообразном состоянии): 1 — 3р-орбиталь атома Cl; 2 — две sp-гибридные орбитали атома Be. sр2-Гибридизация.Рассмотрим гибридизацию одной s- и двух р-орбиталей. В этом случае в результате линейной комбинации трёх орбиталей возникают три гибридные sр2-орбитали. Они располагаются в одной плоскости под углом 120° друг к другу (рис. 9). sр2-Гибридизация характерна для многих соединений бора, который, как показано выше, в возбуждённом состоянии имеет три неспаренных электрона: один s- и два р-электрона. При перекрывании sр2-орбиталей атома бора с орбиталями других атомов образуются три ковалентные связи, равноценные по длине и энергии. Молекулы, в которых валентные орбитали центрального атома находятся в состоянии sр2-гибридизации, имеют треугольную конфигурацию. Углы между ковалентными связями равны 120°. В состоянии sр2-гибридизации находятся валентные орбитали атомов бора в молекулах BF3, BC13, атомов углерода и азота в анионах СО32-, NO3-. Рис. 9. Взаимное расположение в пространстве трёх sр2-гибридных орбиталей. sр3-Гибридизация.Очень большое распространение имеют вещества, в молекулах которых центральный атом содержит четыре sр3-орбитали, образующиеся в результате линейной комбина ции одной s- и трёх р-орбиталей. Эти орбитали располагаются под углом 109˚28′ друг к другу и направлены к вершинам тетраэдра, в центре которого находится атомное ядро (рис. 10 а). Образование четырёх равноценных ковалентных связей за счёт перекрывания sр3-орбиталей с орбиталями других атомов характерно для атомов углерода и других элементов IVA-группы; это обуславлиает тетраэдрическую структуру молекул (СН4, CC14, SiH4, SiF4, GeH4, , GeBr4 и др). Рис. 10. Влияние несвязывающих электронных пар на геометрию молекул: a – метана (несвязывающих электронных пар нет); б – аммиака (одна несвязывающая электронная пара); в – воды (две несвязывающие пары). Неподелённые электронные пары гибридных орбиталей. Во всех рассмотренных примерах гибридные орбитали были "заселены" одиночными электронами. Однако нередки случаи, когда гибридная орбиталь "заселена" электронной парой. Это оказывает влияние на геометрию молекул. Поскольку несвязывающая электронная пара испытывает воздействие ядра только своего атома, а связывающая электронная пара находится под действием двух атомных ядер, несвязывающая электронная пара находится ближе к атомному ядру, чем связывающая. В результате этого несвязывающая электронная пара сильнее отталкивает связывающие электронные пары, чем те отталкивают друг друга. Графически для наглядности большую отталкивающую силу, действующую между несвязывающей и связывающими электронными парами, можно изобразить большей по объёму электронной орбиталью несвязывающей пары. Несвязывающая электронная пара имеется, например, у атома азота в молекуле аммиака (рис. 10 б). В результате взаимодействия со связывающими электронными парами валентные углы Н—N—Н сокращаются до 107,78° по сравнению со 109,5°, характерными для правильного тетраэдра. Ещё большее отталкивание испытывают связывающие электронные пары в молекуле воды, где у атома кислорода имеются две несвязывающие электронные пары. В результате чего валентный угол Н—О—Н в молекуле воды равен 104,5° (рис. 10 в). Если несвязывающая электронная пара в результате образования ковалентной связи по донорно-акцепторному механизму превращается в связывающую, то силы отталкивания между этой связью и другими ковалентными связями в молекуле выравниваются; выравниваются и углы между этими связями. Это происходит, например, при образовании катиона аммония: Участие в гибридизации d-орбиталей.Если энергия атомных d-орбиталей не очень сильно отличается от энергий s- и р-орбиталей, то они могут участвовать в гибридизации. Самым распространённым типом гибридизации с участием d-орбиталей является sр3d2-гибридизация, в результате которой образуются шесть равноценных по форме и энергии гибридных орбиталей (рис. 11 а), расположенных под углом 90˚ друг к другу и направленных к вершинам октаэдра, в центре которого находится атомное ядро. Октаэдр (рис. 11 б) – является правильным восьмигранником: все рёбра в нём равной длины, все грани – правильные треугольники. Рис. 11. sр3d2-Гибридизация Реже встречается sр3d-гибридизация с образованием пяти гибридных орбиталей (рис. 12 а), направленных к вершинам тригональной бипирамиды (рис. 12 б).Тригональная бипирамида образуется соеинением двух равнобедренных пирамид общим основанием - правильным треугольником. Полужирными штрихами на рис. 12 б показаны рёбра равной длины. Геометрически и энергетически sр3d-гибридные орбитали неравноценны: три «экваториальные» орбитали направлены к вершинам правильного треугольника, а две «аксиальные» — вверх и вниз перпендикулярно плоскости этого треугольника (рис. 12 в). Углы между «экваториальными» орбиталями равны 120°, как при sр2-гибридизации. Угол между «аксиальной» и любой из «экваториальных» орбиталей равны 90°. Соответственно этому ковалентные связи, которые образуются с участием «экваториальных» орбиталей отличаются по длине и энергии от связей, в образовании которых участвуют «аксиальные» орбитали. Например, в молекуле РС15 «аксиальные» связи имеют длину 214 пм, а «экваториальные» - 202 пм. Рис. 12. sр3d-Гибридизация Таким образом, рассматривая ковалентные связи как результат перекрывания атомных орбиталей, можно объяснить геометрию возникающих при этом молекул и ионов, которая зависит от числа и типа атомных орбиталей, участвующих в образовании связей. Концепцию гибридизации атомных орбиталей, необходимо понимать, что гибридизация представляет собой условный приём, позволяющий наглядно объяснить геометрию молекулы посредством комбинации АО. | |||||||||||||||||||||||||||||||||
