Химическая связь. Учебное пособие Рябухин Ю. И. Астрахань Астрахан гос техн унт, 2013. 40 с. Предназначено для студентов инженернотехнических нехимических специальностей
 Скачать 0.94 Mb. Скачать 0.94 Mb.
|
        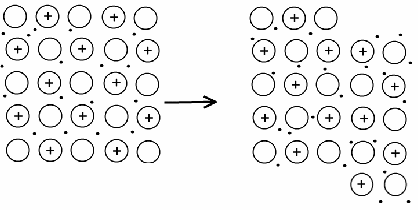  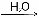 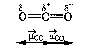 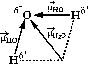 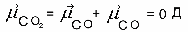 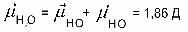 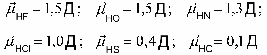 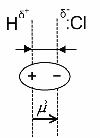 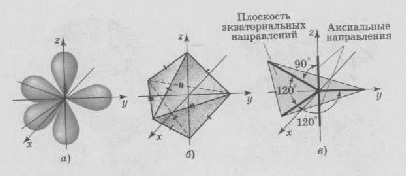 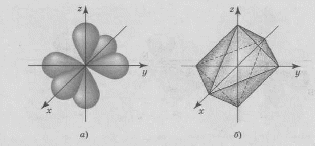 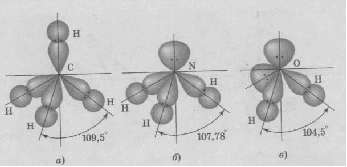      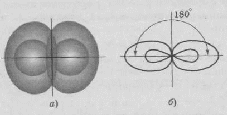 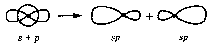  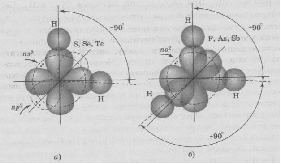 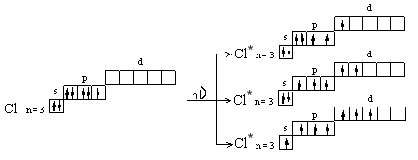 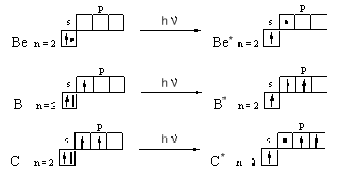 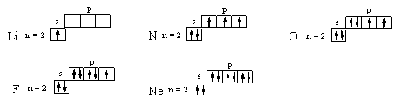    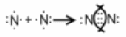 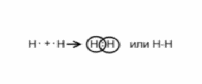  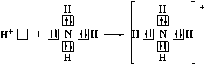 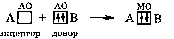 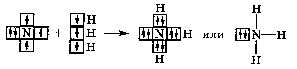  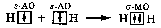 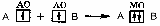  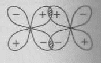   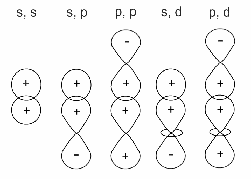 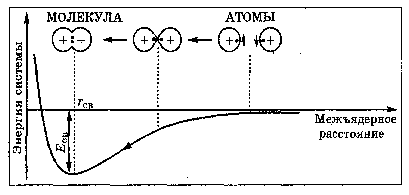 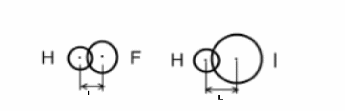 АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ • • Рябухин Ю.И. Химическая связьУчебное пособие Астрахань2013УДК 546 ББК Р98 Химическая связь: Учебное пособие / Рябухин Ю. И. – Астрахань: Астрахан. гос. техн. ун-т, 2013. – 40 с. Предназначено для студентов инженерно-технических нехимических специальностей. Соответствует государственным образовательным стандартам высшего профессионального образования Ил.: 15 рис., табл.: 1, библиография: 6 назв., прилож. Печатается по решению кафедры «Общая, неорганическая и аналитическая химия» (протокол №__ от _________ 2013 г.) Рецензент: канд. хим. наук, доцент Лебедева А.П. © Рябухин Ю.И., 2013 © АГТУ, 2013 ВВЕДЕНИЕ В природе химические элементы в виде свободных атомов (за исключением благородных газов – элементов VIIIА-группы) практически не встречаются. Обычно атомы какого-либо химического элемента взаимодействуют либо друг с другом, либо с атомами других элементов, образуя химические связи с возникновением соответственно простых или сложных веществ. В то же время и молекулы разных веществ взаимодействуют друг с другом. Учение о химической связи составляет основу всей теоретической химии. Химическая связь1– это совокупность сил, связывающих атомы друг с другом в более устойчивые структуры – молекулы или кристаллы. Образование молекул и кристаллов обусловлено главным образом кулоновским притяжением между электронами и атомными ядрами. Природа химической связи была уяснена лишь после открытия законов квантовой (волновой) механики, управляющих микромиром. Современная теория отвечает на вопросы, почему возникает химическая связь и какова природа её сил. Образование химических связей — процесс самопроизвольный; в противном случае не существовало бы ни простых, ни сложных веществ. С термодинамической точки зрения причиной образования химической связи является уменьшение энергии системы. Образование химической связи сопровождается выделением энергии, а её разрыв требует затраты энергии. Характеристиками химической связи являются её энергия и длина. Энергия химической связи — это энергия, выделяющаяся в процессе её образования и характеризующая её прочность; энергию связи выражают в кДж на моль образовавшегося вещества (Есв, кДж/моль)1. Чем больше энергия химической связи, тем связь прочнее. Энергию химической связи двухатомной молекулы оценивают, сравнивая с состоянием, предшествующим её образованию. Для многоатомных молекул с одинаковым типом связи рассчитывают среднюю энергию химической связи (например, для Н2О или СН4). Средняя энергия химической связи определяется делением энергии образования молекулы на число её связей. Длиной химической связи называют расстояние между ядрами атомов в молекуле. Длина связи обусловлена размерами связывающихся атомов и степенью перекрывания их электронных оболочек. Например для фтороводорода и иодоводорода: lHF < lHI В зависимости от типа соединяемых частиц (атомов или молекул) различают внутримолекулярные связи, за счёт которых образуются молекулы, и межмолекулярные связи, приводящие к образованию ассоциатов из молекул или к связыванию атомов отдельных функциональных групп в молекуле. Эти виды связей резко отличаются по величине энергии: для внутримолекулярных связей энергия составляет 100–1000 кДж/моль1, а для межмолекулярных связей она обычно не превышает 40 кДж/моль. Рассмотрим образование внутримолекулярной химической связи на примере взаимодействия атомов водорода. При сближении двух атомов водорода между их электронами с антипараллельными спинами происходит сильное обменное взаимодействие, приводящее к появлению общей электронной пары. При этом увеличивается электронная плотность в межъядерном пространстве, что способствует притяжению ядер, взаимодействующих атомов. В результате энергия системы уменьшается и система становится более устойчивой - между атомами возникает химическая связь (рис. 1). Рис. 1. Энергетическая диаграмма образования химической связи между атомами водорода Система имеет минимум энергии при определённом расстоянии между ядрами атомов; при дальнейшем сближении атомов энергия увеличивается вследствие возрастания сил отталкивания между ядрами. В зависимости от того, каким образом взаимодействует общая электронная пара с ядрами соединяемых атомов, различают три основных типа химической связи: ковалентную, ионную и металлическую, а также водородную связь. 1. КОВАЛЕНТНАЯ СВЯЗЬ Слово "ковалентная" буквально означает "объединённая". Ковалентная связь является наиболее универсальным типом химической связи. Она осуществляется в подавляющем большинстве веществ. Химическая связь, осуществляемая за счёт одной или не скольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов, называется ковалентной связью. Идея об образовании химической связи с помощью пары электронов, принадлежащих обоим соединяемым атомам, была высказана в 1916 г. американским учёным Дж. Льюисом. Ковалентная связь образуется между атомами, электроотрицательности которых одинаковы или различаются на небольшую величину. Например, в молекулах H2, F2, HF, СН4 (метан), С2Н6 (этан), С2Н4 (этилен), С2Н2 (ацетилен), СО2, H2S, H2O, SO2, NН3, S8 или в кристаллах алмаза, кремния и его карбида SiC. 1.1. МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ1 При образовании ковалентной связи за счёт перекрывания электронных орбиталей взаимодействующих атомов (АО) возникает молекулярная орбиталь (МО). Отличие молекулярной орбитали от атомной заключается в том, что она охватывает ядра обоих соединяемых атомов. Как и на атомной орбитали, на молекулярной орбитали (согласно принципу Паули) может находиться 1 электрон или 2 электрона с противоположными спинами (↑↓). В ковалентной связи электронная плотность между ядрами соединяемых атомов значительна, что является следствием сильного взаимодействия общей электронной пары с ядрами обоих атомов. В зависимости от характера распределения электронной плотности различают σ- и π- молекулярные орбитали. Молекулярная орбиталь, в которой максимальная электронная плотность сосредоточена на прямой, соединяющей ядра атомов, называетсяσ-молекулярной орбиталью (σ-МО). σ-Молекулярная орбитальобразуется при перекрывании двух s-атомных орбиталей (молекула H2), s- и р-орбиталей (молекула HF) или двух р-орбиталей (молекула F2). Если ковалентная связь образуется с участием гибридных орбиталей (связи С–Н и С–С в молекуле этана CH3CH3), то также возникает σ-молекулярная орбиталь. Ковалентная связь, при которой движение общей электронной пары описывается σ-молекулярной орбиталью, называется σ-связью. Между двумя атомами может быть только одна σ-связь. Варианты перекрывания атомных орбиталей, приводящие к образованию σ-связи: Молекулярная орбиталь, (которая возникает) возникающая в результате бокового перекрывания орбиталей взаимодействующих атомов, так, что её максимальная электронная плотность сосредоточена в плоскости, перпендикулярной оси, соединяющей ядра этих атомов, называется π-молекулярной орбиталью (π-МО). Ковалентная связь, при которой движение электронной пары описывается π-молеклярной орбиталью, называется π-связью. Варианты перекрывания атомных орбиталей, приводящие к образованию π-связи:
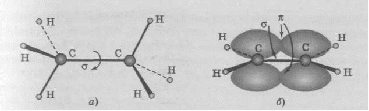
Таким образом, s-орбитали участвуют в образовании только σ-связи, р-орбитали – σ- и π-связей; d-орбитали могут участвовать в образовании σ-, π-, а так же δ-связей. В последнем случае d-орбитали, расположенные в параллельных плоскостях, перекрываются всеми четырьмя лопастями. Образование π-связи между атомами происходит в том случае, если они соединены σ-связью. Например, в молекуле этилена H2C=CH2 (рис. 4): Рис. 4. Образование π-молекулярной орбитали в молекуле этилена. Между атомами совместно с σ-связью могут быть одна или две π-связи: >С=С<, >С=О, −N=N−, −С≡С−, −C≡N, N≡N Реакционная способность π-связи больше, чем σ-связи, так как общая электронная пара, находящаяся на π-молекулярной орбитали, из-за большого удаления от ядер соединяемых атомов слабее взаимодействует с ними, чем в случае σ-молекулярной орбитали. Между σ- и π-связями имеется существенное различие. Оно заключается в том, что вокруг σ-связи возможно практически свободное осевое вращение (рис. 5а). Напротив, вращение вокруг π-связи невозможно, так как каждая π-связь имеет две области перекрывания, и осевое вращение привело бы к отсутствию перекрывания и, следовательно, π-связи (рис. 5б). Рис. 5. Свободное вращение вокруг оси σ-связи в молекуле этана (а) и невозможность вращения вокруг оси π-связи в молекуле этилена (б) 1.2. МЕХАНИЗМЫ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ Ковалентная связь, в зависимости от того, как возникает общая электронная пара, может образовываться по обменному или донорно-акцепторному механизму. Обменный механизм реализуется в тех случаях, когда в возникновении общей электронной пары от каждого соединяемого атома участвуют и атомная орбиталь, и электрон, находящийся на этой орбитали. Например, при образовании молекулы водорода атомы, содержащие на s-орбиталях одиночные электроны с противоположными спинами, образуют общую электронную пару, движение которой описывается σ-молекулярной орбиталью, возникающей при перекрывании двух s-атомных орбиталей: При образовании молекулы аммиака атом азота, имея на четырёх гибридных орбиталях внешнего энергетического уровня три одиночных электрона и одну электронную пару, образует с электронами трёх атомов водорода три общие электронные пары, движение которых описываются тремя σ-молекулярными орбиталями, каждая из которых возникает при слиянии трёх орбиталей атома азота с s-орбиталями трёх атомов водорода: Таким образом, в молекуле аммиака атом азота связан тремя σ- связями с атомами водорода и имеет неподелённую электронную пару. Донорно-акцепторный механизм образования ковалентной связи реализуется в тех случаях, когда электронейтральный атом или отрицательно заряженный ион (донор) имеет электронную пару на орбитали внешнего энергетического уровня, а другой нейтральный атом или положительно заряженный ион (акцептор) — сво бодную (вакантную) орбиталь. При перекрывании атомных орбиталей возникает молекулярная орбиталь, на которой находится общая электронная пара, ранее принадлежавшая атому-донору: По донорно-акцепторному механизму происходит, например, образование ковалентной связи между молекулой аммиака и ионом водорода с возникновением иона аммония [NH4]+. В молекуле аммиака у атома азота на орбитали внешнего энергетического уровня имеется электронная пара, что позволяет этому атому выступать в роли донора. У положительно заряженного атома водорода (акцептора)имеется свободная s-орбиталь. За счёт перекрывания орбиталей атомов азота и водо рода возникает σ-молекулярная орбиталь, а свободная электронная пара атома азота становится общей для соединяемых атомов: или В ионе аммония [NH4]+ ковалентная связь N—H, образовавшаяся по донорно-акцепторному механизму, равноценна (по энергии и длине) трём другим связям N—H, образовавшимся по обменному механизму. Атом бора образует молекулу фторида бора BF3 за счёт перекрывания трёх из четырех орбиталей, занятых в возбуждённом состоянии неспаренными электронами, с электронными орбиталями фтора. При этом у атома бора остаётся вакантная орбиталь, за счет которой (как акцептора) может образоваться четвёртая ковалентная связь с фторид - ионом (донором). BF3 + F- → [BF4]- 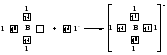 Связь, образованную по донорно-акцепторному механизму, часто называют донорно-акцепторной, координационной или координативной. Однако это не особый тип связи, а лишь иной механизм образования ковалентной связи. Донорно-акцепторный механизм образования ковалентной связи характерен для комплексных (координационных) соединений: роль акцептора обычно выполняют атомы d-металлов, которые могут предоставлять две, четыре или шесть свободных атомных орбиталей s-, p-, d-типа, что расширяет их возможности образовывать ковалентные связи. Например, атомы (ионы) Ag+ и Сu2+ как акцепторы соответственно предоставляют две и четыре свободные орбитали, а донором электронных пар могут быть, например, молекулы аммиака или цианид - иона: Акцептор Донор 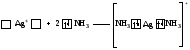 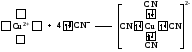 В данных случаях между донорами и акцептором возникают ковалентные связи с образованием комплексных катиона (аммиаката серебра) или аниона (тетрацианида меди). 1.3. ОСОБЕННОСТИ КОВАЛЕНТНОЙ СВЯЗИ Помимо характеристик, общих для любой химической связи (энергия, длина), ковалентная связь имеет дополнительные особенности: кратность, насыщаемость, направленность, сопряжение, полярность и поляризуемость. Кратность Между соединяемыми атомами могут образоваться одна, две или три ковалентные связи. Кратность (или порядок) ковалентной связи характеризуется числом общих электронных пар между соединяемыми атомами. Пару электронов между атомами изображают соединительной чертой – валентным штрихом. При наличии одной электронной пары между соединяемыми атомами говорят о простой (ординарной, или одинарной) ковалентной свя зи. Например, в молекулах Н2, F2, HF, Н2О, NH3, СН4, CH3СН3 или сложных ионах ОН-, [NH4]+, [Zn(OH)4]2-, [Cu(NH3)4]2+ все связи между атомами ординарные и являются σ-связями. При наличии у соединяемых атомов двух или трёх общих электронных пар между ними имеется соответственно двойная или тройная ковалентная связь, при этом одна связь – обязательно σ-связь, остальные – π-связи. 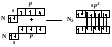 Примерами могут служить молекулы или многоатомные ионы, где между атомами есть кратные (двойные или тройные) связи: N≡N (азот), Н2С=СН2 (этилен), H2C=O (формальдегид), НС≡СН (ацетилен), О=N-O-, C≡N- (цианид - ион). С увеличением кратности ковалентной связи уменьшается её длина и повышается прочность:
Однако увеличение энергии ковалентной связи, как видно из приведённых значений, не пропорционально увеличению её кратности, что указывает на различие в энергиях σ- и π-связи, причём Еσ > Еπ. Это обусловлено тем, что эффективность перекрывания атомных орбиталей при образовании σ-молекулярной орбитали выше, чем при образовании π-молекулярной орбитали. |
