качество и безопасность продуктов питания. КАЧЕСТВО И БЕЗОПАСНОСТЬ ПРОДУКТОВ ПИТАНИЯ (1). Учебное пособие Минск 2008 Авторы З. В. Ловкис, докт техн наук, профессор
 Скачать 7.39 Mb. Скачать 7.39 Mb.
|
|
§2.7. Минеральные вещества Минеральные вещества в большинстве случаев составляют 0,7–1,5% (в среднем 1%) съедобной части пищевых продуктов. Исключение составляют те продукты, в которые добавляют пищевую соль (чаще 1,5–3%). Содержание минеральных веществ в пище (как макро-, так и микроэлементов) небольшое, но их биологическая активность в организме весьма высока. Минеральные вещества не обладают энергетической ценностью, однако без них жизнь человека невозможна. Многие элементы в виде минеральных солей, комплексных соединений и органических веществ входят в состав живой материи и являются незаменимыми нутриентами, которые должны ежедневно потребляться с пищей. Содержание минеральных веществ в основных продуктах питания приведено в таблице 2.4. Таблица 2.4. – Минеральный состав основных продуктов питания (по данным И.М.Скурихина, М.Н.Волгарева «Химический состав пищевых продуктов», 1987)
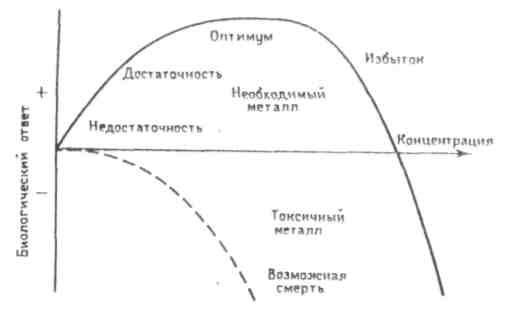
Ежедневное поступление химических элементов с пищей должно находиться на определенном уровне и столько же химических элементов должно ежесуточно выводиться из организма, поскольку их содержание в нем находится в относительном постоянстве. Минеральные вещества выполняют пластическую функцию в процессах жизнедеятельности человека, участвуя в обмене веществ практически любой ткани человека. Особенно велика их роль в построении костной и зубной ткани, где преобладают такие элементы, как фосфор и кальций. Минеральные вещества участвуют в важнейших обменных процессах организма: водно-солевом, кислотно-щелочном, содержатся в цитоплазме и биологических жидкостях, играют основную роль в обеспечении постоянства осмотического давления, что является необходимым условием для нормальной жизнедеятельности клеток и тканей. Минеральные вещества входят в состав сложных органических соединений (гемоглобина, гормонов, ферментов). В виде ионов минеральные вещества участвуют в передаче нервных импульсов, обеспечивают свертывание крови. Многие ферментативные процессы в организме невозможны без участия тех или иных минеральных веществ. Как уже говорилось, в зависимости от количества минеральных веществ в организме человека и пищевых продуктах, минеральные вещества разделяются на две группы: макроэлементы (десятки, сотни мг/кг в продуктах питания, а в организме массовая доля превышает 0,01%; Ca, P, Mg, K, Na, Cl, S) и микроэлементы (в организме ниже 10–5%; в продуктах единицы и менее мг на 100 г продукта Fe, Zn, I, F). Микроэлементы условно делят на две группы: абсолютно или жизненно необходимые (кобальт, железо, медь, цинк, марганец, йод, бром, фтор) и так называемые вероятно необходимые (алюминий, стронций, молибден, селен, никель, ванадий и некоторые другие). Характерным признаком необходимого элемента является колокообразный вид кривой зависимости ответной реакции организма от дозы элемента (рис. 2.1).
При малом поступлении данного элемента организму наносится существенный ущерб (сплошная кривая). Он функционирует на грани выживания. В основном это объясняется снижением активности ферментов, в состав которых входит данный элемент. Сплошная кривая указывает на немедленный положительный ответ с увеличением концентрации, начиная с нулевой отметки (предполагается, что поступающее необходимое вещество насыщает места своего связывания и не вступает ни в какие иные взаимодействия, которые на самом-то деле вполне возможны). Эта сплошная кривая описывает оптимальный уровень, охватывающий широкий интервал концентраций для многих ионов металлов. Кривая проходит через максимум и начинает падать до отрицательных величин: биологический ответ организма становится негативным, а металл переходит в разряд токсичных веществ, т.е. при дальнейшем увеличении дозы проявляется токсическое действие избытка данного элемента, в результате чего не исключается и летальный исход. Штриховая кривая на рисунке 2.1 демонстрирует биологический ответ организма на совершенно вредное вещество, не проявляющее эффектов необходимого или стимулирующего вещества. Эта кривая идет с некоторым запаздыванием, которое свидетельствует о том, что живой организм способен «мириться» с небольшими количествами токсичного вещества (пороговая концентрация) до тех пор, пока не станет преобладать его токсическое действие. На рисунке 2.1 представлена, конечно, некая обобщающая картина; каждое вещество имеет свою собственную специфическую кривую в координатах биологический ответ – концентрация. Из рисунка 2.1 следует также, что необходимые вещества могут стать даже токсичными при избытке их потребления. Почти любое вещество в избытке неизбежно становится опасным (даже если это действие непрямое), например, по причине ограничения усвояемости других необходимых веществ. К наиболее дефицитным минеральным веществам в питании современного человека относятся кальций и железо, к избыточным – натрий и фосфор. Биологическая активность и токсичность s-элементов. Среди s-элементов наиболее важные биохимические функции выполняют катионы металлов 3-го и 4-го периодов. По содержанию в живых организмах, в т.ч. и в организме человека, элементы IA группы натрий и калий принадлежат к олигобиогенным элементам в отличие от лития, рубидияи цезия,которые относятся к ультрамикробиогенным элементам. Соединения щелочных металлов входят в состав тканей и жидкостей организмов человека, животных и растений. Натрий и калий относятся к жизненно необходимым элементам. Физиологическая и биохимическая роль лития, рубидия и цезия выяснена недостаточно, и они могут быть отнесены к примесным элементам. Катионы s-элементов 3-го и 4-го периодов, а также некоторые неорганические анионы являются основными компонентами, определяющими физико-химические свойства биологических жидкостей. Электролитный состав жидкостей организма характеризуется главным образом содержанием Na, К, Mg, Ca, S, С, Р, С1 и некоторых других элементов в виде соответствующих ионов и различается для внутриклеточной и внеклеточной жидкостей. Состав внеклеточной жидкости близок к составу морской воды в предкембрийскую эпоху, когда появились животные с замкнутой системой кровообращения. С тех пор соленость моря продолжала возрастать, тогда как состав внеклеточной жидкости остался постоянным. Основным катионом во внеклеточной жидкости является ион Na+, а из анионов преобладают Сl– и HCO3–. Внутри клеток преобладают катион К+ и анион НРО42–. Для соблюдения физико-химического закона электронейтрапьности, которому подчиняется любой живой организм в целом, некоторый недостаток неорганических анионов компенсируется анионами органических кислот (молочной, лимонной и др.) и кислых белков, несущих отрицательный заряд при физиологических значениях рН. Если вне клетки органические анионы компенсируют незначительную нехватку отрицательного заряда, то внутри клетки они должны компенсировать около 25% положительных зарядов, создаваемых неорганическими катионами. Поскольку клеточные мембраны легко проницаемы для воды, то они могут разрушаться при незначительных различиях в давлении жидкости внутри и снаружи клеточной мембраны. Поэтому осмотическое давление внутри клетки должно быть равно таковому во внеклеточной жидкости, т.е. живая клетка подчиняется закону изоосмоляльности. Повышенное содержание катионов по отношению к концентрации анионов во внеклеточных жидкостях в сравнении с внутриклеточными средами приводит к тому, что наружная поверхность мембран клеток оказывается заряжена положительно относительно ее внутренней поверхности, и это имеет огромное биологическое значение. В биологических жидкостях концентрацию осмотически активных частиц (независимо от их заряда, размера и массы) выражают в единицах осмоляльности – миллиосмомолях на 1 кг воды. Так как главные катионы и анионы внутриклеточных жидкостей многозарядные, то (при одинаковых осмоляльностях) концентрация электролитов, выраженная в миллиэквивалентах на 1 л, будет значительно выше внутри клетки, чем во внеклеточных жидкостях, где в основном содержатся однозарядные ионы. Биологическая активность и токсичность p-элементов. Среди р-элементов в биологических системах наиболее распространены неметаллы водород, углерод, азот, кислород, фосфор, сера и хлор,важные биологические функции выполняют микроэлементы: иод, кремний, бор, селен, фтор, мышьяк и бром. р-Металлы в большинстве случаев токсичны для организма, что объясняется тем, что, проявляя свойства мягких кислот, их ионы образуют прочные связи с кислород- и серосодержащими группами таких биолигандов, как белки (в т.ч. ферменты), нуклеиновые кислоты и т.д. Биологическая активность и токсичность d-элементов. d-Блок Периодической системы включает 32 элемента 4–7-го больших периодов, для которых строение внешних электронных оболочек атомов можно выразить общей формулой: (п – 1)dansb,
Для d-металлов наиболее характерно образование координационных соединений с разнообразными, в т.ч. и биогенными, лигандами, что в основном и определяет их биологическую активность. Наличие d-орбиталей, лишь частично заполненных электронами, позволяет катионам этих металлов взаимодействовать с лигандами – анионами или электродонорными молекулами. Геометрия образующихся комплексов зависит от природы иона металла-комплексообразователя. Комплекс может иметь структуру тетраэдра, плоского квадрата, тригональной бипирамиды или октаэдра. При анализе структуры, физико-химических и биохимических свойств этих комплексов особое внимание обращается на природу связи и на геометрию комплекса. В координационных соединениях ионы d-металлов способны образовывать кроме σ-связей прямые и обратные дативные π-связи. Это обусловливает высокую комплексообразующую способность и непостоянство координационных чисел d-металлов. Как правило, в биокомплексах это четные координационные числа от 4 до 8, реже 10 и 12. Можно утверждать, что в биосистемах свободных ионов d-металлов практически нет, так как они или гидролизуются, или находятся в составе координационных соединений. Чаще всего d-элементы участвуют в биохимических реакциях в составе комплексов с лигандами – аминокислотами, пептидами, белками, гормонами, нуклеиновыми кислотами и т.д. Наиболее распространенные металлоферменты, такие, как карбоангидраза, ксантинооксидаза, цитохромы и др., представляют собой биокомплексы d-металлов. Простетические группы гемоглобина, трансферрина и других сложных белков также представляют собой хелатные комплексы d-металлов. Жизненно необходимые металлы Zn, Cu, Fe, Mn, Со, Мо («металлы жизни») входят в состав различных металлоферментов, катализирующих кислотно-основные и окислительно-вос- становительные биохимические реакции. Многие соединения d-элементов, особенно производные Cd, Hg, V, Ag, Ni и Zn, оказывают на живые организмы токсическое действие, механизмы которого будут рассмотрены на конкретных примерах далее. Большинство методов определения минеральных веществ (микроэлементов) в пищевых продуктах можно разделить на три типа. Тип I – наиболее точные и сложные, которые могут использоваться только в исследовательских лабораториях) например, нейтронно-активационный анализ); Тип II – арбитражные, которые требуют весьма сложного оборудования, но могут быть использованы на производстве (например, ААС) Тип III – альтернативные (для текущих анализов), которые не требуют сложного оборудования, но по точности не уступают методам II типа (колориметрические, полярографические). Для анализа минеральных веществ в основном используются физико-химические методы – оптические и электрохимические. Оптические методы. Фотометрический анализ.Фотометрический анализ (молекулярная абсорбционная спектроскопия) основан на поглощении молекулами вещества излучений в ультрафиолетовой, видимой и инфракрасной областях электромагнитного спектра (медь, железо, хром, никель и др.). Фотоэлектроколориметрия – основана на измерении поглощения окрашенными растворами монохроматического излучения в видимой области спектра. Измерение с помощью фотоэлектроколориметров, снабженных узкополосными светофильтрами. Спектрофотометрия – измерение поглощения монохроматического излучения в УФ, видимой и ИК областях спектра. Измерения с помощью спектрофотометров, где в качестве монохроматоров – диспергирующие призмы и дифракционные решетки. Количественный анализ обычно проводят методом градуировочного графика. Эмиссионный спектральный анализ. Эмиссионный спектральный анализ основан на измерении длины волны, интенсивности и других характеристик света, излучаемого атомами и ионами вещества в газообразном состоянии. Эмиссионный спектральный анализ позволяет определить элементарный состав неорганических и органических веществ. Интенсивность спектральной линии определяется количеством возбужденных атомов в источнике возбуждения, которое зависит не только от концентрации элемента в пробе, но и от условий возбуждения. При стабильной работе источника (электрическая дуга, искра, пламя) возбуждения связь между интенсивностью спектральной линии и концентрацией – линейна и можно использовать метод градуировочного графика. Методом определяют свыше сорока элементов (щелочные, щелочно-земельные, медь, марганец и др.) Атомно-абсорбционная спектроскопия. Метод основан на способности свободных атомов элементов в газах пламени поглощать световую энергию при характерных для каждого элемента длинах волн. Практически полностью исключена возможность наложения спектральных линий различных элементов, т.к. их число в спектре значительно меньше, чем в эмиссионной спектроскопии. Уменьшение интенсивности резонансного излучения подчиняется экспоненциальному закону. Аналогичному закону Бугера-Ламберта-Бера. Разработаны методики более чем для 70 элементов. Арбитражный метод для большинства микроэлементов. Иногда необходимо предварительное концентрирование или использование графитовой кюветы, или и то и другое. Электрохимические методы. Ионометрия. Ионометрия используется для определение ионов K, Na, Ca, Mg, F, I, Cl и т.д. Метод основан на использовании ионселективных электродов, мембрана которых проницаема для определенного типа ионов (отсюда высокая селективность, как правило). Используют либо калибровочный график (Е-рС), либо метод добавок. Полярография. Переменно-токовую полярографию используют для определения ртути, кадмия, свинца, меди, железа. Метод основан на изучении вольтамперных кривых, полученных при электролизе окисляющегося или восстанавливающегося вещества. Электрод – чаще всего ртутный капельный, иногда – платиновый, графитовый. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||