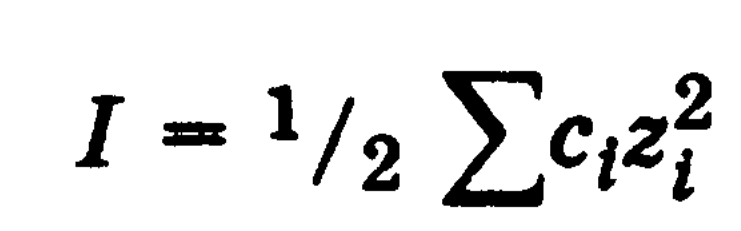Учение о растворах. Основные типы химических равновесий и процессов в жизнедеятельности
А) Свойства растворов, зависящие от концентрации кинетически самостоятельных единиц и независящие от их природы, называют коллигативными.
К таким коллигативным свойствам относятся:
Скорость диффузии
Осмотическое давление
Давление насыщенного пара растворителя над раствором
Температура кипения растворов
Температура замерзания растворов
Б) Коллигативные свойства растворов электролитов зависят от степени ионизации веществ и взаимодействия ионов и молекул в растворе, а в растворах неэлектролитов этим можно пренебречь.
2. А) Самопроизвольный процесс переноса вещества, в результате которого устанавливается равновесие и распределение концентраций вследствие беспорядочного теплового движения молекул, атомов, ионов в газах, жидкостях или твердых телах, называется диффузией.
Диффузия играет важнейшую роль в поглощении питания и насыщении кислородом крови, в поступлении воды и минеральных веществ из почвы в корни, стебли и листья растений.
Б) Всякая живая клетка окружена мембраной, которая служит для защиты и регуляции внутриклеточной среды. Вещества проходят через мембраны по двум основным механизмам: путем обычной диффузии, не связанной с затратой химической энергии -пассивный транспорт и за счет энергетически активированного переноса на основе гидролиза АТФ или переноса электронов по дыхательной цепи митохондрий, что подразумевает активный транспорт.
В) Закон Фика: скорость диффузии вещества пропорциональна поверхности мембраны, через которую переносится вещество, и градиенту концентрации вещества. Для описания диффузии веществ через клеточные мембраны пользуются не математическим выражением закона Фика: An/At = -DS• (Ас/Ах), а более простым уравнением (т. к. концентрационный градиент (Ас/Ах) клеточной мембраны определить трудно):
Am/At = -PS(CrC2), [1] где С и С2 - концентрации по разные стороны мембраны; Р - коэффициент проницаемости, зависящий от свойств мембраны.
Г) В пассивном транспорте различают: а) простую диффузию; б) перенос через поры, каналы; в) транспорт с помощью переносчиков - на основе диффузии переносчика вместе с веществом в мембране, т. е. эстафетной передаче (временная цепочка поперек мембраны).
3. А) Изоосмия -, относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ.
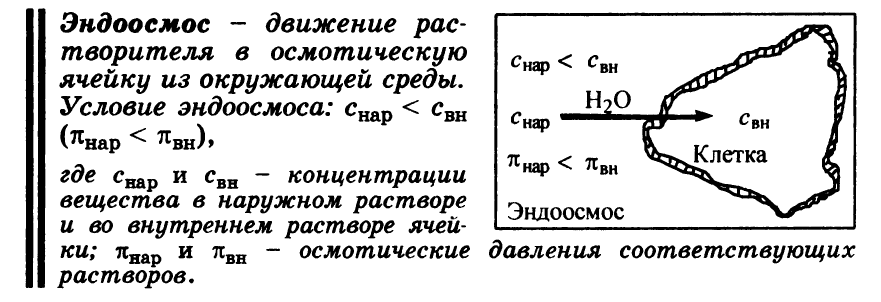
Эндоосмос – движение растворителя в осмотическую ячейку (клетку) из окружающей среды.
При этом концентрация в-ва в окр.среде должна быть меньше конц.в-ва в клетке, осмотическое давление в окр.среде так же меньше, чем в клетке.
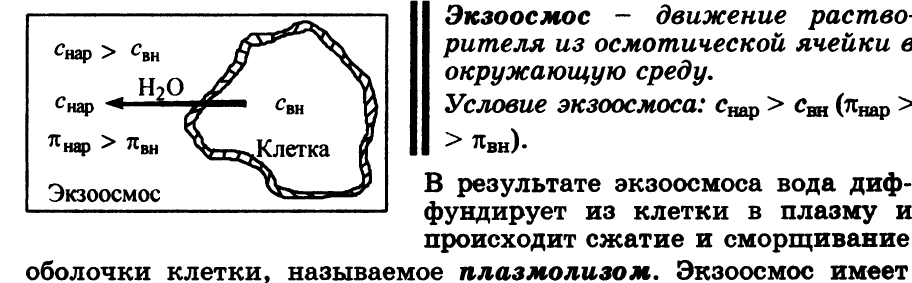
Экзоосмос – движение растворителя из осмотической ячейки в окружающую среду.
Конц.в-ва и осмотическое давление в окр.среде (межклет.жидкости) должны быть больше, чем в клетке.
4) Гемо́лиз — разрушение эритроцитов крови с выделением в окружающую среду гемоглобина. Гемолиз наступает при попадании эритроцита в среду, где его внутриклеточное содержимое будет гипертоничным по отношению к контактирующему раствору.
Плазмолиз – сжатие и сморщивание оболочки клетки в результате экзоосмоса.
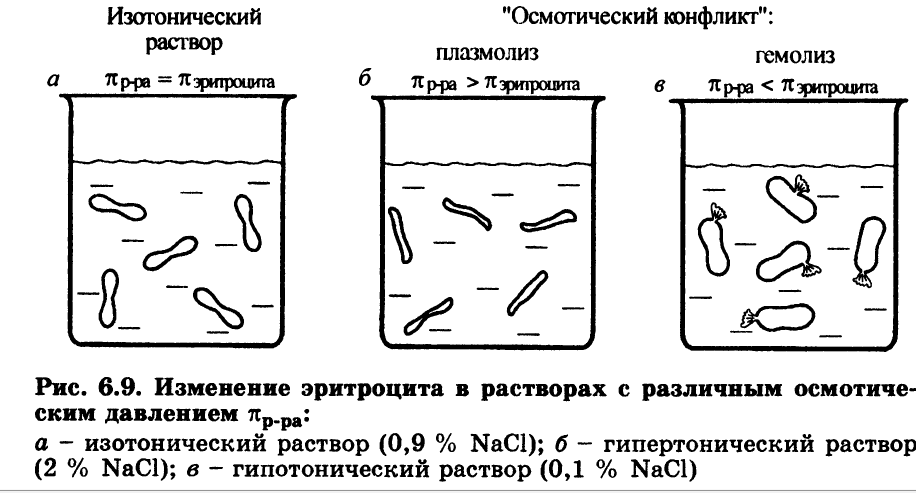
5) А) Изотонические растворы – р-ры, с одинаковым осмотичским давлением.
Гипертонический раствор — раствор, осмотическое давление которого выше нормального.
Гипотонический раствор - раствор, осмотическое давление которого ниже нормального.
Осмотический шок - нарушения в клетке, возникающие при переносе ее в гипертонический или гипотонический раствор
Растворы лекарственных препаратов, вводимые подкожно или внутривенно во избежание осмотического конфликта, должны быть изотоничны биосредам. Все растворы, использующиеся в качестве плазмозамещающих при острых кровопотерях, шоке различного происхождения, нарушениях микроциркуляции, интоксикациях и других процессах, связанных с изменением гемодинамики, должны быть изотоничны крови.
Б) В медицинской практике для очищения ран от гноя применяют гипертонические растворы (3-5-10%) NaCl) в виде марлевых повязок. Ток жидкости в таких марлевых повязках направлен в сторону большего осмотического давления - наружу марли. Для усиления мочевыделения при острых отравлени¬ях, аллергических реакциях, глаукоме, при острой почечной недостаточности, при различных отеках используют осмотические диуретики: натрия ацетат, ман-нит, мочевину.
С изменением осмотического давления связано действие солевых слабительных средств (карловарской соли, натрия сульфата, магния сульфата).
6) А) Осмос – самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью из раствора с меньшей концентрацией в раствор с большей концентрацией.
Осмос является одной из причин, обусловливающих поступление воды и растворенных в ней веществ из почвы по стеблю или стволу растения к листьям. Осмос обеспечивает распределение воды и веществ в клетках живых организмов.
Б) Закон Вант-Гоффа гласит: "Осмотическое давление разбавленного раствора равно давлению, которое проявляло бы растворенное вещество, если бы оно было газообразным и занимало объем, равный объему раствора". Уравнение для описания осмотического давления для растворов неэлектролитов можно записать так:
p = (m/MV)-RT = C-RT, [2]
где р - осмотическое давление, кПа;
С - молярная концентрация, моль/л;
R - универсальная газовая постоянная, равная 8,31 (кПа-л)/(моль-К); Т - абсолютная температура, К.
Концентрация кинетически самостоятельных частиц в растворах электролитов всегда больше, чем это следует из аналитической концентрации. С тем, чтобы свойства растворов электролитов удовлетворительно описывались уравнениями, выражающими следствие из закона Рауля, Вант-Гоффом был введен поправочный эмпирический коэффициент, называемый сейчас изотоническим или коэффициентом Вант-Гоффа (i):
p=iCRT
7) Концентрация кинетически самостоятельных частиц в растворах электролитов всегда больше, чем это следует из аналитической концентрации. С тем, чтобы свойства растворов электролитов удовлетворительно описывались уравнениями, выражающими следствие из закона Рауля, Вант-Гоффом был введен поправочный эмпирический коэффициент, называемый сейчас изотоническим или коэффициентом Вант-Гоффа (i)
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
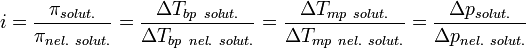
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания).
Коэффициент Вант-Гоффа учитывает ионизацию веществ и взаимодействие ионов и молекул в растворе. Значение i для раствора данного электролита увеличивается по мере разбавления, стремясь в пределе к целому значению, равному числу ионов, возникающих при диссоциации структурной единицы электролита.
8) В растворах, содержащих смесь электролитов, расчет числа кинетически самостоятельных частиц затруднен. В связи с этим в прикладных областях химии, в частности в медицине, в последнее время широко применяются понятия осмолярность и осмоляльность.
Под осмолярностью (осмоляльностью) понимают активную концентрацию частиц, не проникающих через идеальную полупроницаемую мембрану. Единицы измерения в системе СИ: осмолярности - моль/л, осмоляльности - моль/кг. Для разбавленных растворов численные значения осмоляльности и осмолярнос¬ти совпадают. Последнее время чаще применяется такая единица измерения, как осмоль.
Учет этих величин особенно важен в тех случаях, когда применение лекарственных средств сопряжено с протеканием процессов, связанных с осмотическим давлением. Так, при введении лекарственных растворов в кровь, необходимо, чтобы осмолярная концентрация раствора для инъекции совпадала с осмолярной концентрацией плазмы крови (0,3 осмоль/л). Это значит, что растворы изотоничны. Часто под изоосмией понимают способность организма поддерживать постоянство осмолярности биологических жидкостей.
9) А) Явление преимущественно одностороннего проникновения растворителя (диффузию) через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией называется осмосом.
Осмотическое давление - давление на раствор, отделенный от чистого растворителя мембраной, проницаемой только для молекул растворителя (полупроницаемая мембрана), при котором прекращается осмос. Для электролитов рассчитывается по формуле:
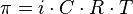
где i — изотонический коэффициент раствора; C — молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м3, а не в привычных моль/л; R — универсальная газовая постоянная; T — термодинамическая температура раствора.
Для неэлектролитов:
p = (m/MV)-RT = CRT
Онкотическое давление – это осмотическое давление, создаваемое за счет наличия белков в биожидкостях организма.
10) А) Первый закон Рауля:
При постоянной температуре относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества:
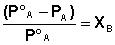
Б) Насы́щенный пар — это пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава.
В) Растворение нелетучего вещества будет затруднять испарение растворителя, вследствие:
Уменьшения подвижности молекул растворителя за счет взаимодействия его молекул с растворенным веществом
Уменьшения поверхности испарения, т.к. часть её будет занята молекулами нелетучего вещества
Уменьшения концентрации молекул растворителя в растворе
11) А) Температура кипения – это температура, при которой давление насыщенного пара над жидкостью становится равным внешнему давлению.
Температура замерзания – это температура, при которой давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над кристаллами этой жидкости.
Б) Второй закон Рауля:
Повышение температуры кипения или понижение температуры замерзания идеальных растворов нелетучих веществ прямо пропорционально моляльной концентрации раствора:
Δtкип = Ккип·Сm, Δtкp = Ккр·Сm.
Здесь Сm -моляльная концентрация раствора (моль/кг); Ккип - эбуллиоскопическая константа или константа кипения растворителя; Ккр - криоскопическая константа или константа кристаллизации растворителя.
В) Растворение нелетучего вещества в растворителе приводит к расширению температурного диапазона существования жилкой фазы: раствор замерзает при более низкой температуре, а кипит при более высокой температуре по сравнению с растворителем, т.к. моляльная концентрация раствора повышается.

12) А) Электролиты – вещества, расплавы и растворы которых содержат подвижные ионы и проводят электрический ток.
Электролитическая диссоциация – процесс распада вещества на ионы вследствие взаимодействия его молекул с полярными молекулами растворителя.
Степень электролитической диссоциации (ионизации) – отношение количества электролита, распавшегося на ионы к общему количеству растворенного электролита.
Б) На степень электролитической диссоциации влияют след.факторы:
Полярность и поляризуемость хим.связи в соединении. Увеличение полярности хим.связи (напр.CH3COOH и HNO3) и особенно её поляризуемости (HI и HF) увеличивает степень диссоциации.
Свойства среды. Среда с большим значением диэлектрической проницаемости ослабляет связь между ионами и затрудняет их диссоциацию
Степень электролитической диссоциации возрастает с уменьшением концентрации раствора, т.к. это способствует диссоциации электролита и затрудняет процесс ассоциации его ионов
Процесс электролитической диссоциации обычно эндотермический, поэтому степень диссоциации увеличивается с повышением температуры
В) Все электролиты по величине степени диссоциации (а) делятся на сильные и слабые.
Сильные электролиты - α>0,7, являются кислоты, щелочи, большинство солей (H2SO4, HCl, HNO3, KOH, NaOH, Ba(OH)2, NaCl, KNO3)
Слабые электролиты - α<0,1 являются слабые кислоты и слабые основания (CH3COOH, HCN, H2CO3, HF, HNO2, NH2*H2O)
13) А) Константа диссоциации — количественное выражение электролитического равновесия в растворах слабых электролитов.
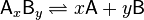
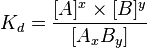
Б) Kd зависит от:
Природы вещества
Природы растворителя (с увеличением диэлектрической проницаемости Kd увеличивается)
Температуры (при повышении температуры Kd возрастает)
В) 
14) А) В 1923 году Дебай и Хюккель выдвинули теорию, согласно которой
В растворах сильных электролитов каждый ион окружен со всех сторон ионами противоположенного знака, вследствие чего движение ионов ограничено.
Ионы сильного электролита в растворе взаимодействуют между собой благодаря наличию значительных электростатических сил, в результате чего ионы одного знака образуют вокруг иона другого знака так называемую ионную атмосферу. Необходимо также учитывать сольватацию ионов.
Ионная атмосфера и сольватная оболочка замедляют движение ионов в растворе и являются причиной кажущейся неполной ионизации.
Кроме того, в растворах сильных электролитов при высоких концентрациях может происходить ассоциация ионов.
Для учета этих влияний состав растворов электролитов следует характеризовать не аналитической концентрацией, а эффективной концентрацией, называемой активностью (Льюис, 1907).
Б) Активность иона (а) – эффективная концентрация иона, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов.
Коэффициент активности иона (f) – показывает во сколько раз активность иона отличается от его истинной концентрации в растворе сильного элеткролита.
В) Между активностью и аналитической концентрацией ионов существует связь:
a = f-C, [6]
где f - коэффициент активности, зависящий от концентрации (обычно f < 1); а - активность, моль/л; С - концентрация электролита, моль/л.
В разбавленных растворах сильных электролитов f = 1, тогда а = с.
15) А) Ионная сила раствора (I) – величина, характеризующая интенсивность электростатического поля всех ионов в растворе, которая равна полу-сумме произведений молярной концентрации (с) каждого иона на квадрат его заряда (z):
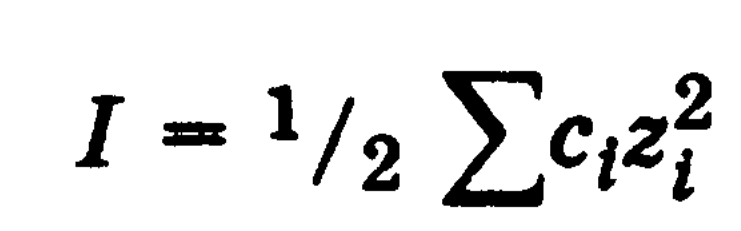
В биологических системах широко распространены межионные взаимодействия, которые сильно зависят от ионной силы растворов, что прежде всего сказывается на значениях констант диссоциации ионогенных групп биологических субстратов, так как они определяются активностями ионов, а не их концентрациями. Незначительное увеличение ионной силы раствора вызывает изменение степени ионизованности белков или нуклеиновых кислот, вследствие чего меняется их конформация, а следовательно, и биологические функции. Поэтому при использовании растворов электролитов в биологических экспериментах крайне необходимо, чтобы их ионная сила была равна ионной силе соответствующей биологической системы. Так, ионная сила плазмы крови человека равна 0,15 М, поэтому физиологический раствор -простейший заменитель плазмы крови - должен иметь соответствующую концентрацию NaCl (0,15 М, или 0,9 %).
Б) Электролиты являются составной частью жидкостей и тканей живых организмов. Для нормального протекания физиологических и биохимических процессов необходимы катионы натрия, калия, кальция, магния, водорода, анионы хлора, сульфат-ионы, гидрокарбонат-ионы, гидроксид-ионы и др. Концентрации этих ионов в организме человека различны. Так, например, концентрации ионов натрия и хлора весьма значительны и ежедневно пополняются. Концентрации ионов водорода и гидроксид-ионов очень малы, но играют большую роль в жизненных процессах, способствуя нормальному функционированию ферментов, обмену веществ, перевариванию пищи и т.д.
Теория кислот и оснований. Водородный показатель. Значение рН.
А) Кислота - это, частица, способная выступать в роли донора-протона (Н+).
Б) Протолиты (кислоты и основания) могут быть нейтральными или молеку-
лярными, катионными и анионными:
|
Молекулярные
или нейтральные
|
Катионные
|
Анионные
|
|
НС1 (
|
nh4
|
hso4-
|
Кислоты
|
H2SO4
|
НO3+
|
H2ро4 -
|
|
|
|
|
н3ро4
|
[Zn(h20)]2+
|
|
|
н2о
|
[Cu(h20)]2+
|
нсо3-
|
Основание - это частица, способная принять протон (Н+), быть акцептором протона (Н+) в данной реакции.
Протолиты (кислоты и основания) могут быть нейтральными или молеку-
лярными, катионными и анионными: Таблица №6
|
Молекулярные
или нейтральные
|
Катионные
|
Анионные
|
Основания
|
nh3
н2о с2н5он
|
[Zn(oh)(h20)j+ [Cu(oh)(h20)j+
|
s2-, со32-, С1-, Н2ро4-, СН3соо-
4 5 3 5
он-, нсо3-
|

а) HPO42 + H3O + H3O  H2PO4 H2PO4  + H2O + H2O
б) HPO42 + OH + OH 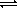 PO43 PO43 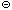 + H2O + H2O



Значение постоянства pH биосред:
Ионы H – катализаторы биохимических процессов
Ферменты и гормоны биологически активны только в определенном интервале pH
Ионы H влияют на осмотическое давление клетки
К протолитическим реакциям относят реакции нейтрализации, гидролиза, ионизации (диссоциации) кислот и оснований.
Реакцией нейтрализации называется протолитическое взаимодействие кислоты и основания, в результате которого образуется соль и вода:
НС1 + NaOH = NaCl + Н20
Реакции ионизации (диссоциации):
сн3соон+н2о = н3о++сн3соо-
кис. осн. сопр. кис. сопр. осн.
а) гидролиз по аниону:
CH3COONa + НОН = СН3СООН + NaOH
сн3соо-+ НОН = сн3соон+ он-
осн. кис. сопр. кис. сопр. осн.
б) гидролиз по катиону:
NH4C1 + НОН = NH4OH + НС1
NH4 + НОН = NH4ОН + Н+
Кис. Осн. Сопр.осн сопр.кис
Гидролитические процессы вместе с процессами растворения играют важную роль в обмене веществ. С ними связано поддержание на определенном уровне кислотности крови и других физиологических жидкостей.
Допишите уравнения протолитических реакций:
а) СН3СОО- + Н2О→СН3СООH + OH- (гидролиз по аниону)
осн. Кисл. С.к. с.о.
б) НСО3- + 〖ОН〗^- →H2O + CO3- (реакция нейтрализации)
кисл. Осн. С.к. с.о
нсо3-+ н2о =н2со3+ он-
осн. кис. с. к. с.o .
HCO3 + H2O = СО3 + H3O+
Кисл. Осн. С.о. с.к.
Общая кислотность – это сумма концентраций всех катионов H+ (свободных и связанных), находящихся в растворе. Общая кислотность равна сумме молярных концентраций эквивалентов всех кислот, находящихся в растворе:
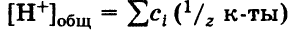
Активная кислотность – это концентрация свободных ионов Н+, имеющихся в растворе при данных условиях. Мерой активной кислотности является значение pH раствора:
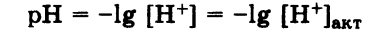
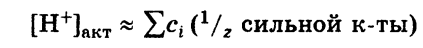
Потенциальная кислотность - это концентрация ионов Н+, связанных в молекулы или ионы слабых кислот, имеющихся в растворе.
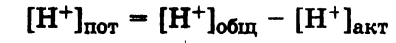
. Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары. Это, например, ионы водорода — протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот.
Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода, спирты, галогены.
Принцип ЖМКО касается взаимодействий, рассматриваемых в теории кислот и оснований Льюиса. Эффективность взаимодействия кислоты и основания Льюиса зависит от их химического состава и электронного строения.
Согласно Пирсону, жёсткие кислоты — это акцепторы электронной пары, обладающие малым размером, большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Жёсткие основания — это доноры с аналогичными свойствами (с большим отрицательным зарядом, большой электроотрицательностью и низкой поляризуемостью). Мягкие кислоты — это кислоты Льюиса с малым положительным зарядом, большим размером, низкой электроотрицательностью и высокой поляризуемостью. Мягкие основания — это основания Льюиса с теми же свойствами. Жёсткость кислоты или основания означает его склонность образовывать связи преимущественно ионного характера, а мягкость кислоты или основания — склонность к образованию связей ковалентного характера.
На основании справочных данных рКа(NH4+) = 9,62, рКа (СН3СОН) =16, рКа(НСООН)=3,7, определите, чем будут являться по отношению к NH3 метанол и муравьиная кислота. Допишите уравнение протолитической реакции:
NH3+ НСООН→ … +… Укажите сопряженные кислотно- основные пары.
Чем меньше pKa, тем сильнее кислота и слабее сопряженное ей основание.
Т.к. рКа(NH4+) = 9,62, иона аммония – слабая кислота, поэтому аммиак (с.о.) является сильным основанием.
рКа(NH4+) < рКа (СН3СОН), СН3СОН по отношению к NH3 – основание
рКа(NH4+) > рКа(НСООН), НСООН по отношнию к NH3 – кислота
NH3+ НСООН→ NH4 + HCOO-
О. к. с.к. с.о.
Объясните с точки зрения теории Льюиса следующие кислотно- основные взаимодействия: NH3 + H+ → [ NH4+ ]; BF3 + F- → [BF3]-. Что называется кислотой и основанием согласно теории Льюиса?
Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары.
Основание Льюиса — это молекула или ион, способные быть донором электронных пар
В реакции
NH3 + H+ → [ NH4+ ]
Ион H+ способен принять электронную пару от NH3, следовательно H+ - кислота Льюиса, аммиак – основание Льюиса.
BF3 + F- → [BF4]-
BF3 способен принять электронную пару от F-: BF3 – кислота Льюиса, F- - основание Льюиса.
Буферные системы крови. Кислотно-основное состояние организма.
А) Буферная система – протолитическая равновесная система, способная поддерживать постоянное значение рН при разбавлении или добавлении небольшого количества кислоты или щелочи.
Буферный раствор – раствор, содержащий буферную систему.
Буферное действие - это способность поддерживать концентрацию ионов в растворе в определённых границах.
Б) Буферные системы делятся на кислотные и основные.
Кислотные буферные системы содержать слабую кислоту и соль это кислоты (напр. Ацетатная – CH3COO-/CH3COOH, гидрокарбонатная HCO3-/H2CO3, гидрофосфатная – HPO4/H2PO4)
Основные БС содержат слабое основание и соль этого основания (н-р: аммиачная – NH3*H2O/NH4+)
В) БС организма:
Гидрокарбонатная: HCO3-/H2CO3
Главное значение гидрокарбонатного буфера заключается в нейтрализации кислот
Гидрофосфатная: – HPO4/H2PO4
Нейтрализует кислоты и основания, продукты обмена выводятся через почки
Катионная : +H3N-Prot-COOH/+H3N-Prot-COO-
Поддерживает величину pH в физиологических средах с pH<6
Анионная: H2N-Prot-COO-/+H3N-Prot-COO-
Поддерживает величину pH в средах c pH>6
Гемоглобиновая БС: Hb-/HHb
Оксигемоглобиновая БС: HbO2-/HHbO2
Имеют большое значение в процессах дыхания, транспорта кислорода в ткани и поддержании постоянства pH в эритроцитах
Анионная БС:
H2N-CH2-COO-/ +H3N-CH2-COO-
Действует при pH<6
При добавлении кислоты:
H2N-CH2-COO- + H+ = +H3N-CH2-COO-
При добавлении щелочи:
+H3N-CH2-COO- + OH- = H2N-CH2-COO- + H2O
КатионнаяБС:
+H3N-CH2-COOH/ +H3N-CH2-COO-
Действует при pH>6
При добавлении кислоты:
+H3N-CH2-COO- + H+ = +H3N-CH2-COOH
При добавлении щелочи:
+H3N-CH2-COOH + OH- = +H3N-CH2-COO- + H2O
А) Гидрокарбонатная БС: HCO3-/H2CO3
Н2СO3 ↔HCO3 + H+
KHCO3→HCO3 + K+
Ka – константа диссоциации
Ka = [HCO3-]*[H+] / [H2CO3]
[H+] = Ka * [H2CO3] /[ HCO3-]
-lg [H+] = -lgKa - lg [H2CO3] /[ HCO3-]
pH = pKa + lg [HCO3-]/ [H2CO3]
pH = pKa + lg [акцептор протона]/ [донор протона] – уравнение Гендерсона-Гассельбаха
Б) pH буферного раствора зависит от:
Природы компонентов
Соотношения концентраций компонентов
От температуры
А) Буферной емкостью (В) – называют число моль-эквивалнетов сильной кислоты или щелочи, которые нужно добавить к 1л буферного раствора, чтобы изменить значение pH на единицу:

Буферная емкость зависит от:
Абсолютной концентрации компонентов, а следовательно от разбавления
Соотношения компонентов
От pH буферного раствора
Б) Способность буферного раствора сохранять значение рН по мере прибавления сильной кислоты или щелочи приблизительно на постоянном уровне далеко не беспредельна и ограничена величиной буферной емкости.
Плазма крови (рН =7,4), буферная емкость (в %)
Буферная емкость гидрокарбонатной системы - 35%
Буферная емкость белковой системы - 7%
Буферная емкость фосфатной системы - 2%
Таким образом, 44%) общей буферной емкости приходится на плазму крови.
Эритроцит (рН =7,25), буферная емкость в %
Буферная емкость гемоглобиновой системы 35%
Буферная емкость гидрокарбонатной системы 18%)
Буферная емкость фосфатной системы 3%
Таким образом, 56% общей буферной ёмкости.
В) Зона буферного действия – это отрезок на шкале pH, в пределах которого функционирует данная БС.
Любая БС эффективно функционирует если соблюдается следующее соотношение:
0,1 < C(акцептор протона) / С(донор протона) < 10

)БС организма:
• Гидрокарбонатная: HCO3-/H2CO3
Главное значение гидрокарбонатного буфера заключается в нейтрализации кислот
• Гидрофосфатная: – HPO4/H2PO4
Нейтрализует кислоты и основания, продукты обмена выводятся через почки
• Белковые БС.
Катионная : +H3N-Prot-COOH/+H3N-Prot-COO-
Поддерживает величину pH в физиологических средах с pH<6
Анионная: H2N-Prot-COO-/+H3N-Prot-COO-
Поддерживает величину pH в средах c pH>6
• Гемоглобиновая БС: Hb-/HHb
Оксигемоглобиновая БС: HbO2-/HHbO2
Имеют большое значение в процессах дыхания, транспорта кислорода в ткани и поддержании постоянства pH в эритроцитах
Гидрокарбонатная БС: HCO3-/H2CO3
В клетке: KHCO3/ H2CO3
В плазме крови и межклеточной жидкости: NaHCO3/H2CO3
Механизм действия.
При увеличении концентрации ионов Н:
H+ + HCO3- ↔ H2CO3 ↔ CO2↑ + H2O
CO2↑ выводится через легкие
При поступлении в кровь оснований:
OH- + H2CO3 ↔ HCO3- + H2O
Уравнение расчета pH:
pKa (H2CO3)= 6,11
pH = 6,11 + lg [HCO3-]/ spCO2
где
pCO2 – парциальное давление
s – коэффициент Генри, учитывает растворимость газов в жидкости
Фосфатная БС:
HPO4 2-/H2PO4-
В клетке: K2HPO4/KH2PO4
В плазме крови и межклеточной жидкости: Na2HPO4/ NaH2PO4
Механизм действия:
В результате переработки мясной пищи (при увеличении концентрации ионов Н):
H+ + HPO4 2- ↔ H2PO4-
H2PO4- выводится через почки, рН мочи уменьшается
При употреблении растительной пищи (увеличении ионов ОН-):
OH- + H2PO4- ↔ HPO4 2- + H2O
HPO4 2- выводится через почки, рН мочи повышается
Фосфатная БС нейтрализует кислоты и основания, продукты обмена выводятся через почки
Уравнение расчета рН:
pKa (H2PO4-) = 6,8
pH = 6,8 + lg [HPO4 2-]/ [H2PO4-]
Оксигемоглобиновая БС:
HbO2-/HHbO2
В клетке: КHbO2/HHbO2
Действует в эритроцитах, при рН = 7,42 – 7,46
Механизм действия:
При увеличении концентрации ионов Н+:
H+ + HbO2- → HHbO2 ↔ HHb + O2
O2 из эритроцитов в ткани организма
При увеличении концентрации ионов OH-:
OH- + HHbO2 → H2O + HbO2-
Имеет большое значение в процессах дыхания, транспорта кислорода в ткани и поддержании постоянства pH в эритроцитах
А) Гемоглобинова БС:
Hb-/HHb
Механизм действия:
По мере перемещения крови в периферические отделы происходит отдача кислорода ионизированной формой оксигемоглобином:
HbO2- ↔ Hb- + O2
Кровь из артериальной становится венозной.
Избыток протонов, образующийся при действии гидрокарбонатной БС в эритроцитах, связывается с гемоглобинат-ионами в слабую кислоту:
H+ + Hb- ↔ HHb
При увеличении к крови ионов OH-:
HHb + OH- ↔ Hb- + H2O
Б) Состояния, характеризующиеся отклонением значения рН крови от нормы, называют ацидемией (уменьшение рН) и алкалиемией (увеличение рН).
В) Большинство буферных систем организма имеет буферную емкость по кислоте больше, чем по основанию, т.к. в результате метаболизма в организме человека образуется больше кислотных продуктов, чем основных, поэтому для нейтрализации кислот БС организма должны обладать большой буферной емкостью по кислоте.
Щелочной резерв крови – число мл CO2, содержащееся в 100мл крови (главным образом в виде ионов HCO3-). Норма – 50-70% по объему или 25-30 ммоль/л
В патологии, при ацидозе (уменьшение pH крови) щелочной резерв уменьшается (потеря HCO3-), при алкалозе (увеличение рН крови) щелочной резерв увеличивается (накопление HCO3-).
Вследствие рвоты и диареи у больного произошло падение рН крови до 7, 59 из-за потери H+, что характерно для метаболического алкалоза.
Ацидоз – уменьшение кислотной буферной емкости физиологической системы по сравнению с нормой.
Различают компенсированный и некомпенсированный, метаболический и респираторный ацидоз. При компенсированном ацидозе, несмотря на отклонение от нормы, рН крови сохраняет значение в пределах 7,35 < рН <7,4
Некомпенсированный ацидоз сопровождается уменьшением кислотной буферной емкости и снижением рН крови 6,8 < рН <7,35
Метаболический ацидоз – характеризуется недостатком HCO3- или избытком нелетучих кислот в межклеточной жидкости.
Причины:
Введение или образование стойких кислот (молочная кислота при изжоге)
Кислородное голодание тканей
Потеря HCO3- при заболеваниях ЖКТ
Неполное удаление кислот при почечной недостаточности
Дыхательный (респираторный) ацидоз – избыток CO2 вследствие пониженной легочной вентиляции (гиповентиляции легких)
Причины:
Нарушение регуляции дыхания при травмах и опухолях мозга, кровоизлиянии в мозг
Введение транквилизаторов
Отравление морфином, алкоголем
Пневмония, отек легких, попадание инородных предметов в дыхательные пути
Алкалоз - увеличение кислотной буферной емкости физиологической системы по сравнению с нормой.
Различают компенсированный и некомпенсированный, метаболический и респираторный алкалоз. При компенсированном алкалозе, несмотря на отклонение от нормы, рН крови сохраняет значение в пределах 7,4 < рН <7,45
Некомпенсированный алкалоз сопровождается увеличением кислотной буферной емкости и повышением рН крови 7,45 < рН <7,9
Метаболический алкалоз – характеризуется накоплением HCO3- или удалением нелетучих кислот из организма.
Причины:
Потери Н+ при рвоте и кишечной непроходимости
Увеличение HCO3- при введении солей органический кислот (лимонной, молочной, уксусной, яблочной)
Длительный прием щелочной пищи или минеральной воды
Дыхательный (респираторный) алкалоз – недостаток CO2 в связи с повышением легочной вентиляции (гипервентиляции легких)
Причины:
Вдыхание разреженного воздуха
Тепловая одышка
Лихорадочное состояние, истерия
Норма рН крови – 7,4. Снижение рН крови до 7,3, увеличение сахара и кетоновых тел в крови – признаки кетоацидоза.
Названы симптомы сахарного диабета.
Причиной падения значения рН крови при недостатке кислорода в крови и тканях новорожденного является избыток CO2 вследствие гипововентиляции легких (респираторный ацидоз).
Кислотная буферная емкость крови уменьшается, происходит накопление кислотных продуктов.
При менингите у детей (менингит – воспаление мозговых оболочек разной этиологии) и при истерии у взрослых, наблюдается частое дыхание, головокружение, в конечном счете, может произойти потеря сознания.
При этом в организме наблюдается недостаток CO2, увеличение кислотной буферной емкости крови, т.е. накапливаются основные продукты обмена, рН крови увеличивается. |
 Скачать 1.06 Mb.
Скачать 1.06 Mb.