Юмагузина. Учреждение высшего образования башкирский государственный медицинский университет министерства здравоохранения российской федерации
 Скачать 1.4 Mb. Скачать 1.4 Mb.
|
|
2.5. Постановка референтного метода в планшетах 1. В вышеуказанной последовательности отдельным наконечником внести 100 мкл соответствующего разведения антибиотика в лунки полипропиленового планшета с плоским дном. 2. В 11-ю лунку для контроля роста всех проверяемых штаммов микроорганизмов обязательно ставить положительный контрольный образец (ПКО), содержащий 100 мкл бульона и 100 мкл инокулюма соответствующего микроорганизма без химического соединения. 3. В 12-ю лунку аналогично внести 200 мкл питательного бульона Мюллера-Хинтона без химического соединения, использовать как неинокулированная лунка отрицательного контрольного образца. 4. В лунки с 1 по 10 внести 100 мкл соответствующего инокулюма. 5. Планшеты для микроразведений перед инкубацией заклеить прозрачной пленкой и запечатать в полиэтиленовые пакеты для предотвращения высушивания. Планшеты инкубировать в термостате в течение 16-20 часов при 37 °С. Для более равномерного нагревания планшеты сложить в стопки не больше чем по пять штук.  ГЛАВА 3: РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ ГЛАВА 3: РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ3.1. Определение величины ДДМ исследуемых антибиотиков При измерении зон задержки роста нужно обращать внимание на зону полного подавления видимого роста. Результаты тестируемых химических соединений представлены в таблице 1. Таблица 1.
ДДМ  Примечание: «0» - подавления микробного роста не наблюдалось. 3.1.1. Результаты антимикробной активности исследуемых антибиотиков ДДМ Постановка методом дисков показало, что исследуемые антибиотики являются эффективными в отношении E. coli(№ 25922 АТСС), S. aureus (№206 ФТСС USA),P. aeruginosa (№27853 АТСС) C. albicans (№181210169-1). По полученным данным получили следующие результаты: 1) цефтазидим оказался эффективным в отношении E. coli(№ 25922 АТСС) минимальная подавляющая концентрация 22 мм, S. aureus (№206 ФТСС USA) 16 мм, C. albicans (№181210169-1) 17 мм и неэффективным для P. aeruginosa (№27853 АТСС). 2) цефтриаксон оказался эффективным в отношении E. coli(№ 25922 АТСС) минимальная подавляющая концентрация 26 мм, S. aureus (№206 ФТСС USA) 10 мм,P. aeruginosa (№27853 АТСС) 10 мм, C. albicans (№181210169-1) 10 мм. 3) цефепим оказался эффективным в отношении E. coli(№ 25922 АТСС) минимальная подавляющая концентрация 20 мм, S. aureus (№206 ФТСС USA) 13 мм, C. albicans (№181210169-1) 10 мм, но не эффективным для P. aeruginosa (№27853 АТСС). 4) цефоперазон оказался эффективным в отношении E. coli(№ 25922 АТСС) минимальная подавляющая концентрация 20 мм, S. aureus (№206 ФТСС USA) 12 мм,P. aeruginosa (№27853 АТСС) 15 мм, C. albicans (№181210169-1) 15 мм. 5) цефозолин оказался эффективным в отношении E. coli(№ 25922 АТСС) минимальная подавляющая концентрация 14 мм, P. aeruginosa (№27853 АТСС) 12 мм, C. albicans (№181210169-1) 10 мм, но не эффективен для S. aureus (№206 ФТСС USA). 6) амикацин оказался эффективным в отношении E. coli(№ 25922 АТСС) минимальная подавляющая концентрация 17 мм, S. aureus (№206 ФТСС USA) 16 мм,P. aeruginosa (№27853 АТСС) 20 мм, C. albicans (№181210169-1) 20 мм. 3.2. Определение величины референтным методом исследуемых антибиотиков Результаты учитывать только при наличии достаточного роста испытуемого микроорганизма в положительном контроле, а также при отсутствии бактериального роста в отрицательном контроле. Размер роста в каждой лунке сравнить с размером роста в положительном контроле и наиболее низкую концентрацию препарата, которая полностью тормозила видимый рост, регистрировать как минимальную подавляющую концентрацию. Результаты определения МПК тестируемых химических соединений представлены в таблицах 2,3,4,5. Таблица 2
E.coli  Таблица 3
S. aureus 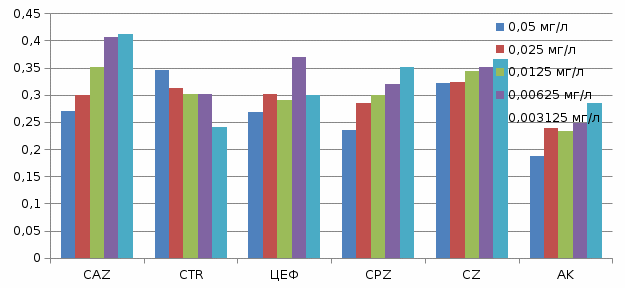 Таблица 4
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
