Юмагузина. Учреждение высшего образования башкирский государственный медицинский университет министерства здравоохранения российской федерации
 Скачать 1.4 Mb. Скачать 1.4 Mb.
|
|
P. aeruginosa 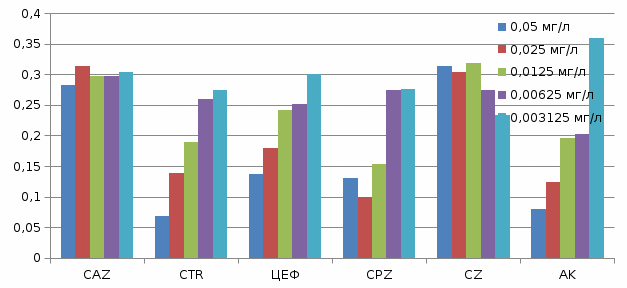 Таблица 5
C. albicans 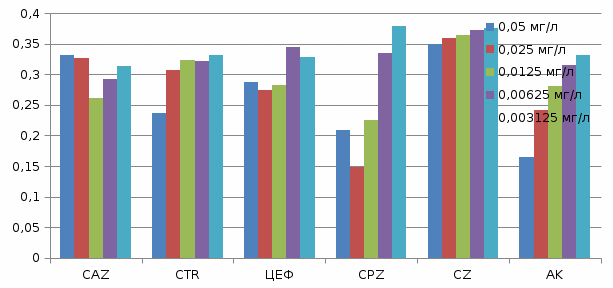 3.2.1 Результаты антимикробной активности исследуемых антибиотиков референтным методом По полученным данным можно сказать, о том, что действительно данные антибиотики эффективны в отношении E. coli(№ 25922 АТСС), S. aureus (№206 ФТСС USA),P. aeruginosa (№27853 АТСС), C. albicans (№181210169-1). Антибиотик цефтазидим оказался эффективным в отношении E. coli(№ 25922 АТСС), так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,256; 0,234; 0,242; 0,268; 0,286 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. S. aureus (№206 ФТСС USA), так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,270; 0,299; 0,351; 0,406; 0,412 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. P. aeruginosa (№27853 АТСС) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,282; 0,314; 0,297; 0,298, 0,304 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. Но не эффективным для С. albicans (№181210169-1), так как не наблюдалось линейного повышения оптических плотностей культуры микроорганизмов. Антибиотик цефтриаксон оказался эффективным в отношении P. aeruginosa (№27853 АТСС) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,069 0,138; 0,189; 0,259; 0,275, при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. С. albicans (№181210169-1) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,236; 0,307; 0,324;0,321; 0,322, при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. Но не эффективным для E. coli(№ 25922 АТСС) и S. aureus (№206 ФТСС USA), так как не наблюдалось линейного повышения оптических плотностей культуры микроорганизмов. Антибиотик цефепим оказался эффективным только в отношении P. aeruginosa (№27853 АТСС), так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,137; 0,179; 0,241; 0,251; 0,301 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. Но не эффективным для E. coli(№ 25922 АТСС), S. aureus (№206 ФТСС USA) и C. albicans (№181210169-1), так как не наблюдалось линейного повышения оптических плотностей культуры микроорганизмов. Антибиотик цефоперазон оказался эффективным в отношении E. coli(№ 25922 АТСС) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,176; 0,268; 0,191; 0,257; 0,306 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. S. aureus (№206 ФТСС USA) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,235; 0,285; 0,299; 0,320; 0,351 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. P. aeruginosa (№27853 АТСС) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,131; 0,100; 0,153; 0,275; 0,276 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. C. albicans (№181210169-1) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,209; 0,148; 0,225; 0,335; 0,379 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. Антибиотик цефозолин оказался эффективным в отношении S. aureus (№206 ФТСС USA) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,321; 0,323; 0,344; 0,351; 0,366 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. C. albicans (№181210169-1) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили: 0,350; 0,360;0,365; 0,373; 0,375 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. Но не эффективным для E. coli(№ 25922 АТСС), P. aeruginosa (№27853 АТСС), так как не наблюдалось линейного повышения оптических плотностей культуры микроорганизмов. Антибиотик амикацин оказался эффективным в отношении E. coli(№ 25922 АТСС) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,160; 0,193; 0,241; 0,310; 0,504 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. S. aureus (№206 ФТСС USA) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,187; 0238; 0,234; 0248; 0,285 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. P. aeruginosa (№27853 АТСС) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили 0,080; 0,124; 0,196; 0,203; 0,360 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. C. albicans (№181210169-1) так как наблюдалась линейное повышение оптических плотностей культуры микроорганизмов, которые составили: 0,164; 0,242; 0,281; 0,316; 0,332 при концентрациях антибиотика равных 0,05; 0,025, 0,0125, 0,00625, 0,003125 мг/л, соответственно. ЗАКЛЮЧЕНИЕ Результаты соответствуют данным полученным при ДДМ. Тест проведенный референтным методом более информативный, так как концентрация исследуемых антибиотиков были взяты на много меньше, чем концентрация антибиотиков в дисках. Результаты референтного метода полностью совпали с результатами диско-дифузионного метода для антибиотиков цефоперазон и амикацин. Было получено не совпадение данных методов для антибиотиков: 1) цефтазидим методом дисков показал положительный результат в отношении E. coli(№ 25922 АТСС), S. aureus (№206 ФТСС USA),C. albicans (№181210169-1). Референтный метод дал отрицательный результат в отношении E. coli(№ 25922 АТСС), C. albicans (№181210169-1). 2) цефтриаксон методом дисков показал положительный результат в отношении E. coli(№ 25922 АТСС), S. aureus (№206 ФТСС USA), P. aeruginosa (№27853 АТСС)C. albicans (№181210169-1). Референтный метод дал отрицательный результат в отношении E. coli(№ 25922 АТСС), S. aureus (№206 ФТСС USA). 3) цефепим методом дисков показал положительный результат в отношении E. coli(№ 25922 АТСС), S. aureus (№206 ФТСС USA),C. albicans (№181210169-1). Референтный метод дал отрицательный результат в отношении E. coli(№ 25922 АТСС), S. aureus (№206 ФТСС USA),C. albicans (№181210169-1). 4) цефозолин методом дисков показал положительный результат в отношении E. coli(№ 25922 АТСС), P. aeruginosa (№27853 АТСС)C. albicans (№181210169-1). Референтный метод дал отрицательный результат в отношении E. coli(№ 25922 АТСС), P. aeruginosa (№27853 АТСС). Все это говорит о том, что концентрация в дисках на много выше, чем концентрации при использовании референтным методом. Выводы 1. Оценка активности антибиотиков по отношению к испытуемым клиническим штаммам условно-патогенных микроогранизмов показало, что данный метод позволяет оценить при высоких концентрациях антибиотико-содержащих дисков, но невозможно оценить качества антибиотиков в самих дисков. 2. Референтный метод позволяет методом разведений, тонко оценить влияние антибиотика в пределах концентраций, что позволяет сразу определить дозы антибиотика, которые эффективно ингибируют рост этих штаммов. 3. Результаты наших исследований показали, что референтный метод отличается в лучшую сторону от ДДМ, вследствие возможности изначально определить действующие концентрации антибиотика. Список использованной литературы 1. Домотенко, Л.В. Лабораторная диагностика чувствительности микроорганизмов к антимикробным препаратам.2017; № 8: 8-16. 2. Allan L., Wiley-Blackwell Manual of Commercial Methods in Clinical Microbiology. 2016; 612. 3. X'Salton M., Kim K., Baron's Medical Microbiology, 1996. 4. Черномордик А. Б., Рациональное применение антибиотиков, 1966; 185-194. 5. Герчина Н.И., Бесчастнова Н.Ю., Крепкович Ю.А., Осипов Л.М., Сидельников А.С., Медицинский вестник. 2016; № 2 (81): 43-46. 6. Pollack M., Pseudomonas aeruginosa, in Principles and Practice of Infectious Diseases. 1995. 7. Алексеев А.А. Ожоговый сепсис: диагностика, профилактика, лечение, Москва.1993. 8. Naber K.G., Bishop M.C., Guidelines on the management ofurinary and malegenital tractinfections. 2006. 9. Sobhy N. Community-acquired methicillin-resistant Staphylococcus aureus from skin and soft tissue infections 2012; 16(5):426-31 10. Агаджанян Н.А., Ушаков И.Б., Торшин В.И., Турзин П.С., Северин А.Е., Дубовой Л.И., Ермакова Н.В., Экология человека. 1997. 11. Fotadar U., Zaveloff P., Terracio L., “Growth of Escherichia coli at elevated temperatures”. 2005; 45 (5): 403—4. 12. Ingledew W.J., Poole R.K., The respiratory chains of Escherichia coli. 1984; 48 (3): 222—71. 13. Воробьев А.А., Микробиология.2004. 104-105. 14. Афанасьева В.М., Носов С.Д., Большая медицинская энциклопедия. 1979. 15. Ogston A.А., On Abscesses. Classics in Infectious Diseases. Rev Infect Dis.1984; 6 (1): 122—28. 16. Kluytmans J., van Belkum A., Verbrugh H., Nasal carriage of Staphylococcus aureus: epidemiology, underlying mechanisms, and associated risks.1997; 10(3): 505—20. 17. Черкес Ф.К., БогоявленскаяЛ.Б., Бельская Н.А., Миробиология. 1986. 18. Ющук Н.Д., Венгеров Ю.Я. Инфекционные болезни. 2003. 19. Селькова Е.Р., Чижов А.А., Гренкова Т.И., Как организовать обработку эндоскопов? 2006; № 76. 20. Коротяев А.И., Бабичев С.А., Медицинская микробиология, иммунология и вирусология. 2008; 431—767. 21. Фурсова П.В., Милько Е. С., Левич А. П., Культивирование диссоциантов Pseudomonas aeruginosa в условиях заданного лимитирования. № 1. 1–6. 22. Руднов В.А., Русский медицинский журнал. 2005; Том 13, № 7. 23. Kurahashi K.Н., Kajikawa O.Е., Sawa T.Т., 1999; 104:743-50.4. 24. Roy-Burman A.Т., Savel R.H., Racine S.2001; 183:1767-74. 25. Сидоренко С.В., Резван С.П., Стерхова Г.А., Грудинина С.А., Госпитальные инфекции, вызванные Pseudomonas aeruginosa. Распространение и клиническое значение антибиотикорезистентности. 1999; № 3: 25–34. 26. Зеленова Е.Г., Заславская М.И., Махрова Т.В. Микробиология.2002. 27. Борисов Л.В. Микробиология.2005. 28. Черненькая Т.В., Годков М.Л., «Проблемные» полирезистентные бактерии – возбудители внутрибольничных инфекций у пациентов в критических состояниях. 2015. 29. Kallen A.Т., Guh A.Т., United states centers for disease control and prevention issue updated guidance for tackling carbapenem-resistant enterobacteriaceae. 2012. 30. Roel M., Harten К.В., Rob J.L., Nathaniel I.M., Antoni P.A., Multidrug-Resistant Enterococcal Infections.2007;25:467-479. 31. Delcour Т.Т., Outer membrane permeability and antibiotic resistance. 2009; 808–816. 32. Braz J.М., Community-acquired methicillin-resistant Staphylococcus aureus from skin and soft tissue infections.2012; 16(5):426-31. 33. Diaz-Guerra T.M., Mellado E.М,, Cuenca-Estrella M.Т., Rodriguez-Tudela J.L., A point mutation in the alpha-sterol demethylase gene cypa contributes to itraconazole resistance in Aspergillus fumigatus.2003; 47:1120-1124. 34. Онищенко Г.Г. Методические указания МУК.4.2.1890-04; Клин микробиал антимикроб химиотер. 2004;Том 6, № 4. 35. Поздеев O.K., Медицинская микробиология. 2001. 36. Vandepitte J.Т., Engbaek K.С., Piot P.С., Heuck C.C., Basic laboratory procedures in clinical bacteriology. 1991. 37. Barry A.L., Thornsberry C.Т., Diffusion test procedures. 1993. 38. Сидоренко С.В., Клиническое значение резистентности микроорганизмов к антимикробным препаратам. 1998; 1:28-34. 39. Morrison G.H., Critical Reviews in Analytical Chemistry.1969; (14) 28A. | |||||||||||||||||||||||||||||||||||||||||||||||
