Юмагузина. Учреждение высшего образования башкирский государственный медицинский университет министерства здравоохранения российской федерации
 Скачать 1.4 Mb. Скачать 1.4 Mb.
|
|
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Медико-профилактический факультет с отделением биологии Кафедра фундаментальной и прикладной микробиологии На правах рукописи Юмагузина Ильсюяр Ильгизовна СТАНДАРТИЗАЦИЯ УСЛОВИЙ ОПРЕДЕЛЕНИЯ МИНИМАЛЬНЫХ ПОДАВЛЯЮЩИХ КОНЦЕТРАЦИЙ НОВЫХ АНТИМИКРОБНЫХ СОЕДИНЕНИЙ В МИКРООБЪЕМАХ Научный руководитель: Доктор биологических наук Ал. Х. Баймиев профессор, д.б.н Уфа – 2019 ОГЛАВЛЕНИЕ Список сокращений и условных обозначений 4 ВВЕДЕНИЕ 5 ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ 1.1. Инфекционные заболевания, вызванные грамотрицательными бактериями 7 1.2. Инфекционные заболевания, вызванные грамотрицательными бактериями 8 . Escherihiacoli общая микробиологическая характеристика 9 1.4.Staphylococcusaureus общая микробиологическая характеристика 10 1.5. Pseudomonas aeruginosa общая характеристика 13 1.6. Candida аlbicansобщая микробиологическая характеристика 16 1.7. Антибиотики с выраженной активностью в отношении грамотрицательных бактерий 18 1.8. Антибиотики с выраженной активностью в отношении грамположительных бактерий 20 1.9. Методы определения чувствительности к антимикробным Препаратам 22 1.9.1. Метод серийных разведений 23 1.9.2. Метод серийных разведений в агаре 24 1.9.3. Метод серийных разведений в бульоне 26 1.9.4. Диско-диффузионный метод (ДДМ) 26 1.9.5. Метод Е-тестов 27 1.9.6 Референтный метод 30 ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ 2.1. Объекты исследования 32 2.2. Приготовление питательных сред для культивирования 33 2.2.1. Приготовление инокулюма 33 2.3. Проведение диско-диффузионного метода 35 2.4. Приготовление рабочих растворов антибиотиков 36 2.5. Постановка референтного метода в планшетах 37 ГЛАВА 3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ 3.1. Определение величины ДДМ исследуемых антибиотиков 38 3.1.1. Результаты антимикробной активности исследуемых антибиотиков ДДМ 42 3.2. Определение величины референтным методом исследуемых антибиотиков 42 3.2.1. Результаты антимикробной активности исследуемых антибиотиков референтным методом 45 ЗАКЛЮЧЕНИЕ 47 ВЫВОДЫ 47 СПИСОК ЛИТЕРАТУРЫ 48 Список сокращений и условных обозначений АБП – антибактериальный препарат АК – амикацин БЛРС – бета-лактамаза расширенного спектра ВРЭ – ванкомицин-резистентные энтерококки ДДМ – диско-диффузионный метод МБК – минимальная бактерицидная концентрация МИК – минимальная ингибирующая концентрация МПА – мясо-пептонный агар МПБ – мясо-пептонный бульон МПК – минимальная подавляющая концентрация МРС – метициллин-резистентный стафилококк ЭПКП – энтеропатогенная кишечная палочка РМ – референтный метод ЦЕФ – цефепим EUCAST – European Committeeon Antimicrobial Susceptibility Testing (Европейский комитетом по определению чувствительности к антимикробным препаратам) CAZ – цефтазидим (сeftazidime) CPZ – цефоперазон (сefoperazone) CTR – цефтриаксон (сeftriaxone) CZ – цефозолин (сefazolin) ВВЕДЕНИЕ Актуальность. Определение чувствительности микроорганизмов к антибиотикам приобретает все важное значение, в связи сложившейся ситуации, связанной с распространением патогенных и условно патогенных микроорганизмов – возбудителей инфекционных болезней, устойчивых к антимикробным препаратам. Действующих препаратов остается все меньше: устойчивость возникла даже к карбапенемам, являющиеся самыми эффективными препаратами при лечении инфекций. Устойчивость к антимикробным препаратам (АБП) – большая проблема, которая касается всего человечества и определяемая множеством взаимосвязанных факторов. Неправильное назначение антибиотиков могут навредить не только пациенту, но и всему обществу. Быстрый рост резистентности микробов к существующим АБП может оставить общество без эффективных лекарств (Домотенко, 2017). Все, что требуется – правильное выполнение всех звеньев бактериологического исследования: от взятия клинического материала, транспортировки его в бактериологическую лабораторию, идентификации возбудителя до определения его чувствительности к антибиотикам и интерпретации полученных результатов. Исследования, которые проводили американские ученые, показали, что правильное и своевременное выполнение оценки чувствительности микроорганизмов способствует получению хороших результатов лечения пациентов путем быстрого обнаружения резистентности и дальнейшего выбора подходящих АБП. Испытания чувствительности in vitro проводятся на микроорганизмах, предположительно являющихся причиной заболевания, особенно если организм относят к видам, которые могут проявлять резистентность к часто используемым АБП. Данные исследования также важны для контроля над резистентностью в эпидемиологических исследованиях чувствительности и при сравнении новых и существующих препаратов (Allan, 2016). Внедрение в клиническую практику значительного количества новых антибактериальных препаратов и появление новых механизмов антибиотико-резистентности у бактерий потребовало более строгой стандартизации процедуры тестирования, разработки новых подходов к интерпретации результатов, внедрения современной системы внутреннего контроля качества на каждом этапе исследования. Методы оценки чувствительности, использующиеся на сегодняшний день, не отличаются высокой чувствительностью и специфичностью. В основе таких методов лежат фенотипические методы оценки, которые не позволяют давать точные результаты. Таким образом, остается актуальным поиск и совершенствование методов оценки антимикробной активности (Клин микробиал антимикроб химиотер 2004). Цель исследования. Стандартизация условий определения минимальных подавляющих концентраций новых антимикробных соединений в микрообъемах. Задачи исследования: 1. Оценка активности коммерческих антибиотиков диско-диффузионным методом в отношении клинических штаммов микроорганизмов. 2. Проверка антибиотиков последовательными микроразведениями (референтный метод) в планшетах. 3. Сравнительная оценка полученных данными методами результатов. ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ 1.1. Инфекционные заболевания, вызванные грамотрицательными бактериями В последнее годы в большинстве странах отметился значительный рост числа заболеваний, вызываемых условно-патогенными грамотрицательными бактериями: эшерихиями, синегнойной палочкой, протеем, клебсиеллой, цитробактером, серрацией и др. Грамотрицательные бактерии – бактерии, которые в отличии от грамположительных бактерий не окрашиваются кристаллическим фиолетовым при окрашивании по Граму (Х'Salton, Kim,1996). Вызываемые грамположительными бактериями инфекции чаще осложняют различные хирургические, особенно урологические заболевания. Возбудители гнойно-воспалительных заболеваний наиболее часто обнаруживают при заболеваниях мочеполового канала и пищеварительного тракта. Все это связано с тем, что основным местом обитания обеих бактерий являются кишечник (Черномордик, 1958; Sutter, 1966). Условно-патогенные бактерии вызывают заболевания таких органов и систем как: желудочно-кишечного тракта, дыхательной, мочеполовой систем и др. Отмечается спорадические случаи заболеваний в течение всего года. С точки зрения биологии нет разницы между облигатно-патогенными и условно-патогенными микроорганизмами. Они отличаются лишь по степени выраженности инвазивных свойств. Условно-патогенные микроорганизмы обладают более слабым патогенным потенциалом, ограниченной возможностью колонизации макроорганизма и проявляют вирулентные свойства только при определенных условиях (Герчина, Бесчастнова, Крепкович, Осипов, Сидельников 2016). Грамотрицательные бактерии является частым возбудителем госпитальных инфекций, в основном это отделения реанимации и интенсивной терапии. Благодаря возможности существовать во влажной среде грамотрицательные бактерии контаминирует разнообразные растворы, оборудование и поверхности. В связи с этим широкое распространение госпитальной среде является быстрая колонизация ею слизистых оболочек и кожных покровов пациентов (Pollack, Mandell, Bennett, Dolin). Наиболее частым возбудителем сепсиса является Pseudomonas aeruginosa выделяющееся, из ожоговых ран у 70–80% больных (Алексеев, 1993). Этиологический спектр возбудителей острых не осложненных инфекций верхних (цистит) и нижних отделов (пиелонефрит) мочевыводящих путей сходен. В основном возбудителем является Escherichia coli которая составляет 70–95% случаев заболеваний (Naber, 2006). 1.2. Инфекционные заболевания вызванные грамположительными бактериями Многие микроорганизмы, поддающиеся фиолетовому красителю – имеют проницаемую клеточную стенку, опасны для человека. Это стрептококки, микобактерии, актиномицеты, стафилококки, бациллы, клостридии, микобактерии, актиномицеты. Большую опасность несет золотистый стафилококк, он поражает ослабленный организм и если во время не провести лечение может привести к смерти больного. Грамположительные бактерии вызывают столбняк, ботулизм, дифтерию и другие заболевания (Агаджанян, Ушаков, Торшин, Турзин, Северин, Дубовой, Ермакова, 1997). Staphylococcus aureus, устойчивы к метициллину, умеренно чувствительны или устойчивы к ванкомицину. Этот микроорганизм способен поражать ткани организма человека, вызывая пневмонии, сепсис, маститы, инфекции кожи и тканей, мочевыводящих путей. Устойчивые штаммы, можно выявить при заражении крови и осложненных инфекциях мочеполовой системы (Sobhy, 2012). 1.3. Escherihiacoliобщая микробиологическая характеристика E. coli была описана немецким педиатром и бактериологом Теодором Эшерихом в 1885 году. E. coli относят к роду эшерихий семейства энтеробактерий названная в честь Теодора Эшериха. E.coli - грамотрицательная бактерия, факультативный анаэроб, эндоспор не образует. Имеют палочковидную форму, концы закругленные, размер имеет 0,4–0,8 × 1–3 мкм, объём клетки около 0,6–0,7 мкм³. У Е. coli высокая ферментативная активность. Е. coli обладает соматическим (О), жгутиковым (Н) и поверхностным (К) антигенами. Каждый из антигенов неоднороден: О-антигенна считывает более 170 вариантов, К-антиген – более 100, Н-антиген – более 50. Строение О-антигена относится к серогруппе. Штамм, который имеет свой набор антигенов, свою антигенную формулу, называется серологическим вариантом Е. coli. Оптимальный рост для E. coli 37°C (Fotadar, Zaveloff, Terracio, 2005). Рост может достигаться аэробным или анаэробным дыханием, различными парами окислителей и восстановителей. Для того чтобы обнаружить кишечную палочку используют дифференциально-диагностические среды – Эндо, Левина и др. Е. coli обладает высокой ферментативной активностью. Кишечная палочка, расщепляет лактозу в течение 24 ч (Воробьев, 2004). Патогенность. Е. coli образует эндотоксин, оказывает нейротропное, пирогенное действие. Энтеропатогенная кишечная палочка (ЭПКП) продуцирует экзотоксин, которая адсорбируются на эпителии тонкой кишки, вызывает секрецию воды и хлоридов в просвет тонкой кишки и происходит нарушение обратного всасывания натрия, что приводит к усилению перистальтики, поносу и обезвоживанию. У некоторых диареегенных эшерихий, как и у возбудителей дизентерии, обнаружен инвазивный фактор, способствующий проникновению бактерий внутрь клеток. Патогенность ЭПКП также может проявляться в нефротоксическом действии, возникновении геморрагии. Также к факторам патогенности можно отнести пили и белки, которые способствуют адгезии, и микрокапсула, препятствующая фагоцитозу. Кишечная палочка чувствительна к антибиотикам, как стрептомицин или гентамицин. Но кишечная палочка быстро приобретает лекарственную устойчивость. Эпидемиология. Источником возбудителя инфекции являются люди, болеющие коли-энтеритом, выделяющие Е. coli в больших количествах. Огромную опасность представляют, больной человек который перенес болезнь в лёгкой и стёртой формах. Не так часто заражение может быть от реконвалесцентов и здоровых носителей. Носительство среди взрослого поколения встречается редко и имеет относительно не значительное эпидемиологическое значение. Механизм заражения кишечной палочкой фекально-оральный путь, который характерен для кишечных инфекций. Возбудители могут передаваться передаются через руки, а также через различные предметы ухода. Предметы, которые окружают больных, обычно подвергаются массивному распространению возбудителя, он обладает выраженной устойчивостью и может месяцами сохранять свою жизнеспособность. Также отмечается заражение пищевым путём и через воду. Заболевание может возникнуть и при повышении патогенности кишечной палочки в организме человека в результате снижении сопротивляемости организма. В детских больницах, роддомах, при нарушении санитарно-эпидемического норм или несвоевременной изоляции больных могут возникать эпидемические вспышки кишечной инфекции (Афанасьева, Носов, 1979). 1.4. Staphylococcusaureusобщая микробиологическая характеристика Впервые было обнаружено в 1880 году Александром Огстоном выделенное в гное из хирургических абсцессов (Ogston, 1984). Золотистый стафилококк – грамположительная бактерия из рода стафилококков. Около 25-40 % населения являются носителями этой бактерии, и может сохраняться на кожных покровах и слизистых оболочках верхних дыхательных путей (Kluytmans, Belkum, Verbrugh, 1997). Размножаясь S. aureus, образуются в виде виноградной грозди. Эта форма является результатом того, что происходит деление микробов в различных плоскостях. Однако в гное могут, встречаются единичные и парные кокки. S. aureus, не имеют спор, неподвижны при условиях культивирования образуют микрокапсулу. S. aureus – факультативные анаэробы, но лучше всего растут в присутствии кислорода. Растут и размножаются на простых питательных средах, средах с кровью, оптимальные условия - температура 37°С, рН 7,2-7,4. Элективными средами являются желточно-солевой агар и солевой агар. На мясо-пептонный агар (МПА) колонии стафилококка имеют выпуклый, круглый, непрозрачный, блестящий вид, размер 2-4 мм, ровные края. При росте стафилококки образуют пигмент: золотистый, лимонно-желтый или белый. Лучше всего пигмент образуется на молочной среде при комнатной температуре и рассеянном свете. Стафилококковый пигмент не растворяется в воде, растворяется в ацетоне, эфире, спирте и т. д. Рост некоторых штаммов S. aureus на агаре с кровью вокруг колонии образуется зона гемолиза. Рост на бульоне характерно равномерное помутнение и осадок на дне. S. aureus вырабатывают сахаролитические и протеолитические ферменты. Сахаролитические ферменты расщепляют: лактозу, глюкозу, сахарозу, мальтозу, глицерин. Протеолитические свойства стафилококка выражаются в способности растворять казеин, разжижать желатин (медленно), расщеплять другие белковые субстраты. Стафилококки вырабатывают экзотоксины. К ним относятся гемолизины четырех типов, из которых большее значение имеет α-токсин. Помимо гемолизинов S. aureus образуют лейкоцидин который убивает лейкоциты, энтеротоксины шести типов, вызывающие пищевые отравления. S. aureus имеет протеиновый антиген А, общий для всех золотистых стафилококков и полисахаридные антигены: А, Б, С. Среди золотистых стафилокков различают 40 фаговаров. Определение чувствительности выделенных из различных стафилококковых культур к типовым фагам имеет важнейшее эпидемиологическое значение (Черкес, Богоявленская, Бельская, 1986). Патогенность. S. aureus проникают через кожу и слизистые оболочки. Наибольшее значение при заболеваниях стафилококком имеет золотистый стафилококк, наименьшее Staphylococcus epidermidis и Staphylococcus saprophyticus . Патогенез обусловливается свойствами возбудителя – веществами бактериальной клетки, ферментами, экзотоксинами, и состоянием иммунной системы макроорганизма. Чаще всего происходит поражение кожи и подкожной клетчатки – образуются пиодермиты, фурункулы, панариции. Не чаще стафилококки обусловливают вторичные заболевания, например пневмонию при гриппе. Они могут вызывать раневые инфекции. Особенно важна роль стафилококков в акушерстве, так как новорожденные очень чувствительны к ним. В течении, стафилококковых заболеваний могут развиться аллергии, поэтому заболевание характеризуется рецидивами. Важно отметить, что особое место среди стафилококковых заболеваний занимают пищевые интоксикации. Они протекают как токсикозы, вызывая рвоту, понос, головную боль и другие явления. Эпидимиология. Источником заражения является больной человек, заболевшей любой клинической формой стафилококковой инфекции, а так же здоровые носители стафилококка. Около у 20–30 % здоровых людей S. aureus можно обнаружить в носовых ходах. Особенно подвержены медицинские работники, так как они являются носителями «госпитальных штаммов» возбудителя, обладающих полирезистентностью к антимикробным препаратам. Источником возбудителя могут быть: собаки, крупный рогатый скот, лошади, свиньи. Наибольшую опасность представляют коровы со стафилококковым маститом. Разнообразны пути передачи инфекции, это в основном воздушно-капельный путь передачи, но более важный контактно-бытовой путь – через предметы быта, руки. Не так, часто отмечают алиментарный путь заражения, через молоко, молочные продукты, кондитерские изделия. Восприимчивость к стафилококковой инфекции невелика. В результате контакта с возбудителем у многих взрослых обнаруживаются антитела к стафилококку и его токсинам. Больше всего восприимчивы дети до 1 года и лица с отягощенным анамнезом. Различные клинические формы стафилококковой инфекции чаще развиваются как аутоинфекция (Ющук, Венгеров, 2003). Pseudomonas aeruginosa общая характеристка Pseudomonas aeruginosa – грамотрицательная палочка, подвижна. Обитает в воде, почве, условно-патогенна для человека, возбудитель нозокомиальных инфекций у человека (Селькова, Чижов, Гренкова, 2006). Имеет вид прямой или искривлённой с закруглёнными концами палочки, 1– 5 × 0,5– 1,0 мкм, монотрих или лофотрих. (Коротяев А. И., Бабичев С. А. 2008). Хемоорганогетеротроф, облигатный аэроб. Растёт на мясо-пептонном агаре, среда окрашивается в сине-зелёный цвет, мясо-пептонном бульоне (МПБ) в среде помутнение и пленка, также сине-зелёный цвет. Может расти при 42 °C, селективная среда – питательный агар с цетилперидиниум-хлоридом. Образует протеазы. На плотных питательных средах диссоциирует на три формы – R-, S- и M-форму (Фурсова, Милько, Левич). Продуцирует характерные пигменты: пиоцианин (сине-зелёный цвет), пиовердин (желто-зелёный цвет). Микроорганизмы рода Pseudomonas – неферментирующие грамотрицательные бациллы. Они свободно живут, и распространенны в окружающей среде, используют в качестве источника энергии органические природные соединения.Так как они могут существовать во влажной среде контаминируют самые разнообразные растворы, в том числе и некоторые из дезинфектантов, а также медицинский инструментарий и оборудование, особенно там где есть скопления жидкости. Облигатная аэробность P. aeruginosa имеет мощную систему антиоксидантной защиты делает их устойчивыми и к действию синглетного кислорода. Синегнойную палочку можно обнаружить в раковине, кранах, посуды, респираторов, увлажнителей, влагосборников, кондиционеров. Причиной высокого распространения синегнойной палочки в среде лечебных учреждений является колонизация ими слизистых и кожных покровов больных. P. aeruginosa относится к бактериям, которые в естественных условиях патогенны и для человека, и для животных (Руднов, 2005).Если сравнивать с подавляющим большинством представителей своего рода синегнойная палочка обладает многочисленными факторами вирулентности. У P. aeruginosa описана система экскреции III типа, обеспечивающий выведение экзоэнзимов из внутренней среды бактериальной клетки и их транслокацию внутрь эукариотической клетки, непосредственно к мишеням. К веществам, которые выделяют данную систему, у синегнойной палочки относятся экзотоксины (Frithz-Lindsten, 1997). Внутриклеточные эффекты под действием экзотоксинов заключаются в ингибиции синтеза дезоксирибонуклеииновой, стимуляции апоптоза, изменяется клеточная форма, теряется способность к локальной адгезии. Было доказано, что секреция указанных экзотоксинов происходит со снижением системного артериального давления и развивается септический шок. Популяции синегнойной палочки – гетерогенны с позиций способности к синтезу и секреции факторов токсичности: различные штаммы этого микроорганизма обладают различной токсичностью (Kurahashi, Kajikawa, Sawa, 1999). Патогенность. Синегнойную палочку можно обнаружить при абсцессах и гнойных ранах, ассоциирована с энтеритами и циститами. P. aeruginosa является распространенным возбудителей нозокомиальных инфекций и P. aeruginosa особенно легко поражает лиц с ослабленным иммунным статусом. Факторами патогенности синегнойной палочки является то, что они подвижны, образуют токсины, продуцируют гидролитические ферменты. Прогноз ухудшается высокой резистентностью к действию антибиотиков. Синегнойная палочка устойчива к действию беталактамов, аминогликозидов, фторированных, хинолонов (Сидоренко, Резван, Стерхова, Грудинина, 1999). Эпидимиология. Заболевание синегнойной этиологии может развиться в результате эндогенногозаражения или экзогенно. Источником инфекции являются больные люди либо носители, а также различные резервуары природы это как: почва и различные пресные и соленые водоемы. Отмечено, что около 5-10% здоровых людей являются носителями. P. aeruginosa также встречается повсеместно: в водопроводных трубах, вентиляциях на фруктах и овощах, на поверхности мыла, полотенцах, в дыхательных аппаратах и т.д. Поэтому синегнойную инфекцию можно считают сапроантропонозом. Механизмы и пути заражения при инфекциях, вызванных P. aeruginosa контактный, респираторный, фекально-оральный. Синегнойная инфекция может возникнуть у людей с диабетом, ожоговой болезни, лейкозом, муковисцидозом, так и на фойе нормальной иммунологической реактивности организма. Известно, что адгезивная активность синегнойной палочки усиливается когда повышается температуры окружающей среды, поэтому можно подхватить инфекцию при посещении бассейна, бани. P. aeruginosa является возбудителем внутрибольничных инфекций, т.е. заболеваний, у людей находящиеся в стационаре. Заразиться синегнойной инфекцией в стационаре можно через медицинские манипуляциями, если инфицирование происходит через грязные руки персонала, инструменты, на поверхности которых микроб образует биопленку. P. aeruginosa может проникать в организм человека через поврежденные ткани. Прикрепляясь, они размножаются на раневой или ожоговой поверхности, слизистой оболочки. Если у человека отсутствует иммунный механизм против синегнойной инфекции, локальный процесс может стать распространенным. Инфекция приводит к распространению синегнойной палочки и может развиться сепсиса (Воробьев, 2004). 1.6. Candidaalbicans общая микробиологическая характеристика Существуют несколько морфологических вариантов кандид: от дрожжей до гифальных форм. Гифальные элементы считаются патогенными, а дрожжеподобная форма является комменсальной, и менее патогенной. C.albicansназывают диморфными, они полиморфны и могут обретать вид дрожжей, гиф и псевдогиф – тонких удлиненных клеток, располагающихся друг за другом в виде нитей и не имеют общей оболочки. C. albicansразмножаются неполовым путем и в процессе жизнидеятельности формируются неполовые споры С. аlbicans, которые могут образовывать гроздеподобные скопления бластоконидий. Бластические конидии кандид отпочковываются от материнской клетки и располагаются на перетяжках псевдомицелия. Они формируют ростовые трубки, которые предшествуют возникновению новых гиф и дрожжевых форм . Если в течение 2 ч инукубировать С. аlbicans при температуре 37оС в 10% сыворотке, то из бластоконидий формируются удлиненные клетки – ростовые трубки. Они отличаются от других подобных выростов отсутствием перетяжек на основной трубке. Для С. аlbicans является характерно образование хламидоконидий на концах или коротких боковых отростках гиф. Хламидоспоры служат, чтобы пережить неблагоприятные условия. Поверхностный кандидоз кожи и слизистой оболочки в очагах поражения больше преобладают бластоспоры, а при глубоких микозах можно обнаружить вегетирующие клетки. Не маловажное влияние на морфогенез кандид оказывает температура. При температуре 250С происходит формированию хламидоконидий. При температуре от 37 до 400С образуются гифы и псевдогифы. Но не все виды кандид могут расти при 370С и выше, и это свойство является важной патогенетической характеристикой и отделяет потенциально патогенные штаммы от сапрофитов внешней среды. Строение С. аlbicans: есть рибосомы, митохондрии, включения в виде гликогена, ядро, ограниченное ядерной мембраной, аппарат Гольджи, эндоплазматическая сеть. Клеточная стенка это структура, которая обеспечивает жизнедеятельность С. аlbicans, и ее взаимодействие с тканями хозяина. Она состоит из углеводов, которые представлены бета-глюканом, хитином и маннаном. Компоненты клеточной стенки дрожжевой и гифальной форм похожи по своему химическому составу. При электронной микроскопии можно разглядеть вариабельность числа слоев клеточной стенки, которая зависит от техники посева, штамма и при каких условиях выращивается грибы. Результатом этих слоев может быть количественная выраженность главных компонентов клеточной стенки кандид: b-1,3-глюкана, b-1,6-глюкана, хитина, маннопротеина. Плазматическая мембрана кандид содержит большое количество эргостерола и систему энзимов, который обеспечивает его биосинтез. По типу дыхания С. аlbicans аэробы и могут метаболизировать глюкозу по гексозо-монофосфатному. С. аlbicans хорошо растут питательных средах с добавлением углеводов, и размножаются на простых. Оптимальная температура для роста грибов +22-36оС; pH 5,8–6,5. Специальными средами для выращивания являются глюкозо-пептонныйагар, кукурузный питательный агар, среда Сабуро. Колонии на глюкозо-пептонной среде при температуре +25оС через 1-3 дня роста – молочно-белого, беловато-кремового цвета, гладкие, влажные, если дальше инкубировать могут стать морщинистыми. Патогенность. Кандидозная инфекция носит эндогенный характер .Заселение колониями слизистых может закончиться тем, что приобретают и сохраняют стабильной популяции кандид, и не развивается клиническая инфекция. Факторы патогенности C. albicansможно условно разделить на несколько групп: 1. Грибы способны к адгезии на тканях хозяина – взаимодействие с макроорганизмом. В этот процесс включены адгезины кандид и рецепторный аппарат слизистых оболочек человека. 2. Продукция протеолитических энзимов – секреторных аспартил-протеаз облегчают пенетрацию и инвазию кандид в ткани. 3. Дрожжевая-гифальная форма, может облегчить проникновение кандид в ткани и микроорганизм обходить защитные системы хозяина. 4. Различные иммуномодуляторные механизмы некоторых поверхностных молекул С. аlbicans, содействуют снижению активности защитных сил хозяина (Зеленова, Заславская, Махрова, 2002). Эпидимиология. Многие люди сталкиваются с грибами Candida в первый год жизни. Инфицирования плода подтверждается обнаружением грибов в околоплодной жидкости, плаценте, оболочках пуповины. При контакте новорожденного ребенка с C. albicansпроисходит, когда плод проходит родовые пути, со слизистой оболочкой рта, с кожей соска при кормлении, кожей рук при уходе и с пищей. Значительное обсеменение было обнаружено в сыром мясе, молочных продуктах и овощах и фруктов. Источником заражения могут быть молодые домашние животные. Проявление C. albicansэто как побочный эффект, возникающий при употреблении сильных антибиотиков широкого спектра действия и активных по отношению грамположительных и грамотрицательных бактерий. В окружающей среде распространены разные виды, а С. albicans является нормальной микрофлоры организма человека, и они устойчивы к воздействию внешних факторов (Борисов, 2016). 1.7. Антибиотики с выраженной активностью в отношении грамотрицательных бактерий Вредоносные микроорганизмами, с точки зрения антибактериальной терапии, считаются патогенными, и не менее важны в структуре возбудителей внутрибольничных инфекций и приобретают устойчивость к противомикробным препаратам. Устойчивость штаммов бактерий связано с использованием антибиотиков в клинике. Еще в 1942 году пенициллин применяли при лечении инфекционных заболеваний, но к большому сожалению в 1944 г. большинство штаммов стафилококков были чувствительны к этому препарату. Но в 1948 г. около 65-85% штаммов стафилококков в больницах оказались резистентными к пенициллину. После того, как начали использовать пенициллин в 1950-1960-х гг. устойчивых к действию стафилококковой пенициллиназы произошел спад стафилококковых инфекций. Так же был отмечен рост числа заболеваний, вызванными грамотрицательными бактериями. Однако, врачи опасались и стали вызывать метициллин-резистентные стафилококки (МРС). В 1970-х гг. в появились цефалоспорины 2-й, 3-й генераций, высокоэффективные по отношению грамотрицательных возбудителей. В 1980 - х гг. в разных контингентах мира, были отмечены вспышки внутрибольничных инфекций, вызванных грамотрицательными бактериями. Главным механизмом формирования устойчивости грамотрицательных бактерий к цефалоспоринам стала продукция бактериальных ферментов, разрушающих бета-лактамное кольцо антибиотиков. После того, как внедрили в практику имипинем, это позволило около 20 лет держать под контролем инфекции, вызванные грамотрицательными микроорганизмами. В литературе можно встретить термины, которые можно охарактеризовать резистентность грамотрицательных микроорганизмов к антибиотикам: микроогранизмы с множественной лекарственной устойчивостью – которые резистентны к трем классам антибиотиков и более; со значительной лекарственной устойчивостью – резистентные ко всем, только кроме одного или двух классов антибиотиков; панрезистентные – устойчивые абсолютно ко всем известным классам препаратов (Черненькая, Годков, 2015). Семейство Enterobacteriaceae устойчивы к карбапенемам. Кишечные бактерии с ферментами бета-лактамазы расширенного спектра (БЛРС) могут обнаружить сопротивляемость к широкому диапазону цефалоспоринов. За последние годы эти микрооргнизмы стали проявлять резистентность к антибиотикам типа карбапенемов. Карбапенемы, а точнее имипенем и меропенем – это основные агенты в борьбе с грамотрицательными бактериями, которые обладают ЛУ. Карбапенем – устойчивые Enterobacteriaceae резистентны почти ко всем антибмикробным препаратам. В США за 2009-2010 годы в 13% случаев инфекций кровотока и катетер-ассоциированных инфекций мочевыводящих путей, вызванных Klebsiella, возбудитель был устойчив к карбапенемам. Для E.coli этот показатель составил около 2% (Kallen, Guh, 2012). Бактерии, как P. aeruginosa, устойчивы на уровне проницаемости мембраны благодаря низкому количеству поринов в составе внешней мембраны, что в совокупности с высокоэффективной работой трансмембранных помп, делает этот микроорганизм устойчивым к широкому спектру антибиотиков (Delcour, 2009). Энтерококковая резистентность уже появилась к ампициллину и ванкомицину. Так же устойчивость появилась к антибиотикам последнего поколения – даптомицину и линезолиду (Roel, Rob, Nathaniel, Martin, Antoni, 2017). 1.8. Антибиотики с выраженной активностью в отношении грамположительных бактерий В 1980-х гг. грамположительные микроорганизмы стали самыми тяжело уничтожаемыми возбудителями. Все это связано с тем, что единственным препаратом для лечения, вызванных этими микроорганизмами, в течение долгого времени был ванкомицин. В первые, устойчивые к ванкомицину клинические штаммы энтерококков – ванкомицин-резистентные энтерококки (ВРЭ) были описаны в конце 80-х г. На данный момент в Европейских странах можно выделить от 1,1 до 11,5% ВРЭ. С начала 90-х гг. было отмечено широкое распространение в больницах всего мира МРС. С конца 90-х гг. выделили штаммы стафилококков со сниженной чувствительностью к ванкомицину. Эти штаммы выделяли в США и Японии, а потом и по всему миру. При заболеваниях, вызвынных такими стафилококками, лечение ванкомицином не всегда эффективно. В связи с тем, что увеличилось число заболеваний, вызванных грамположительными микроорганизмами, начали искать и внедрять в практику новых противомикробных препаратов. Так, в конце 1990-х гг. было разрешено применять при грамположительных инфекциях антибиотики нового класса: линезолид даптомицин. Был открыт тигециклин – антибиотик из группы глицилциклинов, активный против МРС, ВРЭ, пенициллин-резистентных пневмококков и энтеробактерий, продуцирующих БЛРС. Начали применять цефалоспорины с анти-МРС-активностью. В настоящее время в стационарах есть огромный выбор препаратов, которые позволяют излечивать инфекционные болезни, вызванные грамположительными бактериями. В связи с тем увеличилось число инфекций причиной, которой стали грамположительные микроорганизмы, начали искать новые противомикробные препараты (Черненькая, Годков, 2015). Проявляют устойчивость к β-лактамным антибиотикам за счет модификации пенициллин-связывающих белков, являющихся их мишенями действия. S. aureus может поражать практически любые ткани организма человека. Золотистый стафилакокк устойчив к цефалоспоринам, и другим классам антибиотиков. Устойчивые штаммы, обозначаемые как МРС, выявляются при заражении крови и осложненных инфекциях мочеполовой системы (Sobhy, 2012). 1.9. Методы определения чувствительности к антимикробным препаратам Цель определения чувствительности микроорганизмов к антибиотикам является прогнозирование их эффективности при лечении пациентов. На сегодняшнее время теоретически наиболее обоснованным представляется комплекс подходов к оценке чувствительности и интерпретации результатов, предлагаемый European Committeeon Antimicrobial Susceptibility Testing (EUCAST). К антибиотикам EUCAST можно отнести вещества природного, полусинтетического или синтетического происхождения, которые проявляют активность к бактерий, применяются и для лечения инфекционных болезней (Diaz-Guerra, Mellado, Cuenca-Estrella, Rodriguez-Tudela, 2003). Современные методы определения чувствительности микроорганизмов к антимикробным препаратам разделают на методы серийных разведений и диффузионные. Методы серийного разведения заключается в том, что оно основано на прямом определении основного количественного показателя, характеризующего микробиологическую активность АБП – величины его минимальной подавляющей концентрации (МПК). МПК – минимальная подавляющая концентрация видимый рост исследуемого микроорганизма в бульонной культуре или на твердой среде. Диффузионные методы определения чувствительности основаны на диффузии АБП из носителя в плотную питательную среду и подавлении роста исследуемой микроорганизмов в той зоне, где концентрация АБП выше МПК. На сегодняшнее время существуют два диффузионного метода: диско-диффузионный и Е-тест (Клин микробиал антимикроб химиотер 2004). 1.9.1. Метод серийных разведений Важным для всех методов серийных разведений является приготовление растворов АБП. Различают "основные" растворы АБП и "рабочие" – те, которые необходимо использовать для приготовления питательных сред. Для того, чтобы приготовить основный растворов АБП нужно использовать субстанции АБП с известной активностью, лекарственные формы не пригодны. Чтобы взвесить субстанций, нужны электронные лабораторные весы, для измерения объемов – калиброванные дозаторы и пипетки. Основные растворы АБП готовят в концентрации 1000,0 мкг/мл и выше. Для того, чтобы приготовить навески АБП готовят с учетом их активности. Чтобы приготовить базовый раствор навески АБП, необходима формула: где – активность АБП (сколько активного вещества, содержится в субстанции). Так, как взвесить точно расчетное количество порошка невозможно, готовят близкую к расчетной навеску, а затем пересчитывают количество необходимого растворителя. 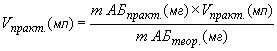 , ,где 1.9.2. Метод серийных разведений в агаре При помощи метода серийных разведений в агаре можно определить МПК партии штаммов. Принцип метода заключается в посеве тестируемых микроорганизмов на чашки Петри с агаром, которые содержат последовательные двойные разведения антибиотиков, и проводят тестирование партии клинических штаммов и соответствующих контрольных штаммов, а также контроль роста микроорганизмов на чашках без АБП и контроль чистоты культуры путем высева образцов инокулюма на неселективные питательные среды. Для того чтобы приготовить серийное разведение АБП, из основного раствора исследуемого АБП готовят рабочий раствор в концентрации, в 10 раз превосходящей максимальную из используемых в конкретном исследовании. Далее готовят серию двукратных разведений рабочего раствора. И в конце, концентрация АБП в каждом последующем разведении должна быть в 2 раза меньшей, чем в предыдущем. Для того, чтобы приготовить серии разведений можно использовать любые стерильные химически лабораторные емкости, чтобы крышка была завинчивающей. Сухуой агар готовят по инструкции. После автоклавирования колбы с питательной средой нужно поставить на водяную баню при температуре 48-50°С, далее внести раствор с антибиотиком. Затем среду разлить по чашкам Петри. Приготовление инокулюма и инокуляция. Дозировка посева микроорганизма на поверхности среды составляет 10 После инокуляции чашки Петри нужно оставить при комнатной температуре, затем перевернуть и инкубировать при температуре 35°С в течение 18-24 ч. Для учета результатов необходимо поместить чашку на темную поверхность. За МПК принимают концентрацию, которая вызвает полную ингибицию видимого роста. Для дифференцировки роста от налета, оставшегося после инокулята, в ряде случаев используют увеличение. Появившееся единственные колонии на чашке с концентрацией на 1 разведение выше, чем МПК, можно не учитывать. Результат оценки антибиотико-чувствительности имеет смысл лишь при подтверждении чистоты культуры. При методе серийных разведений в агаре проводят контроль роста культуры на чашке Петри с питательной средой, которые не содержащей АБП. Требование контроля качества это высев, которую используют для инокуляции суспензии на плотную неселективную среду для того, чтобы подтвердить чистоту культуры. Тестируемые штаммы проходят контроль качества исследования с использованием соответствующих контрольных штаммов. 1.9.3. Метод серийных разведений в бульоне Метод серийных разведений в бульоне устанавливает минимальную ингибирующую концентрацию (МИК) и минимальную бактерицидную концентрацию (МБК) препарата для выделенного возбудителя. Используют жидкие питательные среды, которые соответствуют пищевым потребностям возбудителя. В пробирках готовят серию двойных разведений препарата на питательной среде. Концентрацию нужно уменьшить от 128 до 0,06 мкг/мл. Конечный объём среды в каждой пробирке составляет 1 мл. Контролем служит пробирка, которая содержит чистую питательную среду. В каждую пробирку вносят по 0,05 мл физиологического раствора, содержащего 106/мл микробных клеток. Пробирки нужно проинкубировать в течении 10-18 ч при 37°С. После того, как прошел указанный срок результаты нужно учитывать по изменению оптической плотности среды визуально (Поздеев, 2001). 1.9.4. Диско-диффузионный метод Самый распространенный метод определения чувствительности бактерий к антибиотикам среди всех является диско-диффузионный метод. ДДМ является легкодоступная, низкая стоимость, высокая воспроизводимость результатов (Vandepitte, Engbaek, Piot, Heuck, 1991). При определении чувствительности ДДМ в чашку Петри с агаром наносят бактериальную суспензию микроорганизма, затем помещают диски с антибиотиками. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков (Barry, Thornsberry, 1993). Результат учитывют по величине диаметра зоны подавления роста вокруг диска, измеряется в миллиметрах. Зоны подавления роста возбудителя вокруг дисков с антибиотиками тестируемые штаммы делят на чувствительные, умеренно-резистентные и резистентные. Для того чтобы определить к какой чувствительности относится между собой, используют пограничные значения, диаметров зон подавления роста микроорганизмов. Пограничные значения не являются неизменными величинами. Существуют два подхода к интерпретации результатов определения чувствительности: микробиологический и клинический. Микробиологическая интерпретация основана на анализе распределения значений концентрации антибиотика, подавляющей жизнеспособность микроорганизмов. Основой клинической интерпретации является эффект от антибактериальной терапии. К чувствительным относят микроорганизмы, если при лечении стандартными дозами антибиотика инфекций, вызванных этими бактериями, наблюдается терапевтический эффект. Резистентныемикроорганизмы. При микробиологической интерпретации к резистентным относят бактерии, которые имеют приобретенные механизмы резистентности. Клиническая резистентность происходит в том случае, если нет эффекта от антибактериальной терапии. К микроорганизмам с промежуточной резистентностью относят субпопуляцию, которые находятся в соответствии со значениями МПК между чувствительными и резистентными бактериями (Сидоренко, 1998). 1.9.5. Метод Е-тестов Е-тест представляет собой узкую полоску полимера, на которую наносится градиент концентраций АБП. Подавление роста бактерий вокруг полоски Е-теста только в той зоне, где концентрация АБП, диффундирующего из носителя, выше МПК. Значения концентрации АБП в каждом участке носителя типографским способом наносится на наружной поверхности Е-теста. Величину МПК учитывают в том месте, зона подавления роста плотно подходит к носителю (Клин микробиал антимикроб химиотер 2004). 1.9.6. Референтный метод Референтным метод (РМ) – это последовательное микроразведение. РМ, предназначен для количественного определения МПК антибактериальных веществ в отношении чистых культур аэробных бактерий, растущих в бульоне Мюллера-Хинтон, с добавками, либо без. Многие лаборатории РМ определения МПК применяют достаточно редко. Этот метод используют в исследованиях по надзору за распространением резистентности, при сравнительных испытаниях новых антибактериальных веществ, в тех случаях, когда рутинные исследования антибиотико-чувствительности дают сомнительные результаты и при необходимости получить количественные результаты для обоснования рациональной этиотропной терапии. Величина МПК служит руководством для клинициста при оценке чувствительности организма к антибактериальному препарату и помогает сделать правильный выбор при лечении. Нужен тщательный контроль и стандартизация внутри - и межлабораторной воспроизводимости, так как результаты могут отличаться в зависимости от используемого метода. РМ микроразведений в бульоне предназначен для определения МПК. МПК показывает активность препарата в описанных условиях проведения теста и может быть использована для целей оптимизации лечения, принимая в расчет такие факторы, как фармакология препарата или механизмы резистентности бактерий. Это позволяет осуществить классификацию бактерий как "чувствительную", "умереннорезистентную" и "резистентную" формы. Так же, распределения МПК используют для определения «дикого» или «не дикого» типов бактериальной популяции (Morrison, 1969). |
